硫酸锰在农业上是重要的微量元素肥料,也是植物合成叶绿素的催化剂。一种以高硫锰矿(主要成分为含锰化合物及 ,还有含Mg化合物等杂质)与氧化锰矿(主要成分为
,还有含Mg化合物等杂质)与氧化锰矿(主要成分为 等锰的氧化物)为原料制备硫酸锰的工艺流程如图:
等锰的氧化物)为原料制备硫酸锰的工艺流程如图:
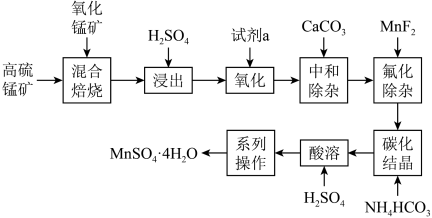
已知:①金属离子在水溶液中沉淀的 范围如下表所示(25℃):
范围如下表所示(25℃):
②离子浓度≤10-5mol/L时,离子沉淀完全。
(1)混合焙烧时一般需要将原料粉碎,这样做的主要目的是___________ 。
(2)混合焙烧过程会产生 气体,用
气体,用 溶液吸收
溶液吸收 可能生成
可能生成 或
或 ,请用离子方程式解释
,请用离子方程式解释 溶液显碱性的原因
溶液显碱性的原因___________ , 溶液显酸性,则在
溶液显酸性,则在 溶液中,下列两种微粒浓度大小关系是
溶液中,下列两种微粒浓度大小关系是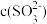
___________ 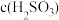 。(填“>”“=”或“<”)。
。(填“>”“=”或“<”)。
(3) 溶液和
溶液和 溶液中,各微柆浓度存在完全相同的等量关系式是
溶液中,各微柆浓度存在完全相同的等量关系式是___________ 。
(4)25℃时,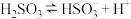 的电离常数
的电离常数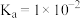 ,则该温度下
,则该温度下 水解反应的平衡常数
水解反应的平衡常数
___________ 。
(5)①若试剂a一般用 ,完成并配平氧化步骤发生反应的离子方程式:
,完成并配平氧化步骤发生反应的离子方程式:________
___________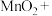 ___________
___________ ___________=___________
___________=___________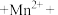 ___________
___________
②若没有“氧化”这一步,可能会造成的影响是___________ 。
(6)中和除杂时,加 调节
调节 在
在___________ 范围,请从平衡移动的角度解释调节溶液的 能达到去除
能达到去除 的目的
的目的___________ 。
(7)氟化除杂时,若使溶液中的 和
和 沉淀完全,需维持
沉淀完全,需维持 不低于
不低于___________ 。(已知: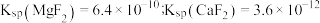 )
)
(8)“碳化结晶”时,加入碳酸氢铵,产生 沉淀。已知常温下部分弱电解质的电离平衡常数如下表,则碳酸氢铵的电离方程式为:
沉淀。已知常温下部分弱电解质的电离平衡常数如下表,则碳酸氢铵的电离方程式为:___________ ,根据下述表格,得出碳酸氢铵溶液呈___________ 性(填“酸”、“碱”或“中”)
(9)碳酸氢铵溶液中下列微粒浓度关系合理的是___________。
(10)流程中“系列操作”应该为___________ 、___________ 、过滤、洗涤、干燥。
 ,还有含Mg化合物等杂质)与氧化锰矿(主要成分为
,还有含Mg化合物等杂质)与氧化锰矿(主要成分为 等锰的氧化物)为原料制备硫酸锰的工艺流程如图:
等锰的氧化物)为原料制备硫酸锰的工艺流程如图:
已知:①金属离子在水溶液中沉淀的
 范围如下表所示(25℃):
范围如下表所示(25℃):| 物质 |  |  |  |  |
开始沉淀的 | 1.9 | 7.6 | 7.3 | 10.4 |
完全沉淀的 | 3.2 | 9.6 | 9.3 | 12.4 |
(1)混合焙烧时一般需要将原料粉碎,这样做的主要目的是
(2)混合焙烧过程会产生
 气体,用
气体,用 溶液吸收
溶液吸收 可能生成
可能生成 或
或 ,请用离子方程式解释
,请用离子方程式解释 溶液显碱性的原因
溶液显碱性的原因 溶液显酸性,则在
溶液显酸性,则在 溶液中,下列两种微粒浓度大小关系是
溶液中,下列两种微粒浓度大小关系是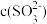
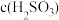 。(填“>”“=”或“<”)。
。(填“>”“=”或“<”)。(3)
 溶液和
溶液和 溶液中,各微柆浓度存在完全相同的等量关系式是
溶液中,各微柆浓度存在完全相同的等量关系式是(4)25℃时,
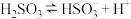 的电离常数
的电离常数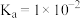 ,则该温度下
,则该温度下 水解反应的平衡常数
水解反应的平衡常数
(5)①若试剂a一般用
 ,完成并配平氧化步骤发生反应的离子方程式:
,完成并配平氧化步骤发生反应的离子方程式:___________
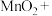 ___________
___________ ___________=___________
___________=___________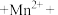 ___________
___________②若没有“氧化”这一步,可能会造成的影响是
(6)中和除杂时,加
 调节
调节 在
在 能达到去除
能达到去除 的目的
的目的(7)氟化除杂时,若使溶液中的
 和
和 沉淀完全,需维持
沉淀完全,需维持 不低于
不低于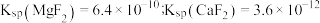 )
)(8)“碳化结晶”时,加入碳酸氢铵,产生
 沉淀。已知常温下部分弱电解质的电离平衡常数如下表,则碳酸氢铵的电离方程式为:
沉淀。已知常温下部分弱电解质的电离平衡常数如下表,则碳酸氢铵的电离方程式为:| 化学式 |  |  | |
| 电离常数 | 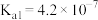 | 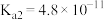 | 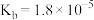 |
(9)碳酸氢铵溶液中下列微粒浓度关系合理的是___________。
A.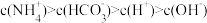 |
B.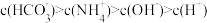 |
C.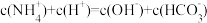 |
D. |
(10)流程中“系列操作”应该为
更新时间:2024-01-19 08:23:52
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】Ⅰ.工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,反应为N2 (g)+3H2(g) 2NH3(g) △H =−92.4kJ·mol−1, △S=−200J·mol−1·K−1。请回答下列问题:
2NH3(g) △H =−92.4kJ·mol−1, △S=−200J·mol−1·K−1。请回答下列问题:
(1)常温下,合成氨反应________ (填“能”或“不能”)自发进行,其平衡常数表达式K=_______ 。
(2)______ 温(填“高”或“低”)有利于提高反应速率,______ 温(填“高”或“低”)有利于提高平衡转化率,综合考虑催化剂活性等因素,工业常采用400~500℃。
(3)针对反应速率与平衡产率的矛盾,我国科学家提出了解决方案:双温—双控—双催化剂。使用Fe-TiO2∙xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,Fe的温度为 547℃,而TiO2∙xHy的温度为415℃)。

该方案的优势:___________ 。
Ⅱ.合成氨工艺可以进一步优化,实现尿素的合成,简易流程图如下:
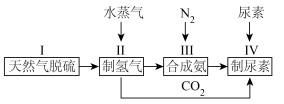
(4)步骤Ⅱ中制氢气原理如下:CH4(g)+H2O(g) CO(g)+3H2(g) ,CO(g)+H2O(g)
CO(g)+3H2(g) ,CO(g)+H2O(g) CO2(g)+H2(g),恒容容器中,对于以上反应,能加快反应速率的是___________。
CO2(g)+H2(g),恒容容器中,对于以上反应,能加快反应速率的是___________。
(5)已知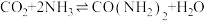 ,若合成尿素的流程中转化率为 80%时,100吨甲烷为原料能够合成
,若合成尿素的流程中转化率为 80%时,100吨甲烷为原料能够合成___________ 吨尿素。
Ⅲ.盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与 NH4Cl类似。
(6)写出盐酸肼第一步水解反应的离子方程式___________ 。
(7)盐酸肼水溶液中离子浓度的排列顺序正确的是___________。
 2NH3(g) △H =−92.4kJ·mol−1, △S=−200J·mol−1·K−1。请回答下列问题:
2NH3(g) △H =−92.4kJ·mol−1, △S=−200J·mol−1·K−1。请回答下列问题:(1)常温下,合成氨反应
(2)
(3)针对反应速率与平衡产率的矛盾,我国科学家提出了解决方案:双温—双控—双催化剂。使用Fe-TiO2∙xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,Fe的温度为 547℃,而TiO2∙xHy的温度为415℃)。

该方案的优势:
Ⅱ.合成氨工艺可以进一步优化,实现尿素的合成,简易流程图如下:

(4)步骤Ⅱ中制氢气原理如下:CH4(g)+H2O(g)
 CO(g)+3H2(g) ,CO(g)+H2O(g)
CO(g)+3H2(g) ,CO(g)+H2O(g) CO2(g)+H2(g),恒容容器中,对于以上反应,能加快反应速率的是___________。
CO2(g)+H2(g),恒容容器中,对于以上反应,能加快反应速率的是___________。| A.升高温度 | B.充入 He | C.加入催化剂 | D.降低压强 |
(5)已知
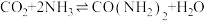 ,若合成尿素的流程中转化率为 80%时,100吨甲烷为原料能够合成
,若合成尿素的流程中转化率为 80%时,100吨甲烷为原料能够合成Ⅲ.盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与 NH4Cl类似。
(6)写出盐酸肼第一步水解反应的离子方程式
(7)盐酸肼水溶液中离子浓度的排列顺序正确的是___________。
A.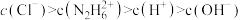 |
B.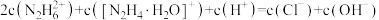 |
C.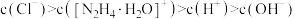 |
D.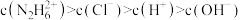 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】近期发现, 是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。常温下,有关弱电解质的电离平衡常数如下表:
是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。常温下,有关弱电解质的电离平衡常数如下表:
(1)以下事实中,能证明 是弱酸有
是弱酸有___________ 。
a.常温下, 溶液
溶液
b.等物质的量浓度的 溶液和
溶液和 溶液与锌粉反应,观察反应初期冒出气泡的快慢,
溶液与锌粉反应,观察反应初期冒出气泡的快慢, 溶液中比
溶液中比 溶液中慢
溶液中慢
c.体积相同且pH相同的 溶液和
溶液和 溶液,用相同物质的量浓度的
溶液,用相同物质的量浓度的 溶液中和,
溶液中和, 溶液消耗的
溶液消耗的 溶液更多
溶液更多
(2)纯碱可用于清除厨房的油污,用离子方程式解释原因___________ ;在配制 溶液时,加入少许浓盐酸,其目的是:
溶液时,加入少许浓盐酸,其目的是:___________ ;如果不断加热 溶液,蒸干其水分并灼烧固体,最后得到的物质是
溶液,蒸干其水分并灼烧固体,最后得到的物质是___________ 。
(3)将 溶液与
溶液与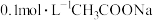 溶液等体积混合,测得室温下该混合溶液
溶液等体积混合,测得室温下该混合溶液 ,该溶液中的离子浓度由大到小排序为
,该溶液中的离子浓度由大到小排序为___________ 。
(4)常温下,向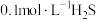 溶液中通入
溶液中通入 或加入
或加入 固体,测得
固体,测得 与溶液pH的关系如图所示(忽略体积的变化及
与溶液pH的关系如图所示(忽略体积的变化及 挥发)。
挥发)。
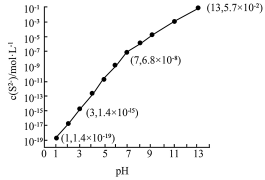
①当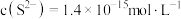 时,溶液中
时,溶液中
___________  。
。
②当溶液 时,溶液中的
时,溶液中的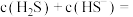
___________  。
。
(5)①相同条件下, 下列溶液中,
下列溶液中, 由大到小的排列顺序是
由大到小的排列顺序是___________ (填序号)。
A. B.
B. C.
C. D.
D. E.
E.
②下列离子方程式正确的是___________ 。
A. 溶液中通入少量
溶液中通入少量 :
: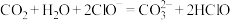
B. 溶液中通入少量
溶液中通入少量 :
: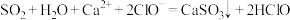
C. 溶液中滴加少量氯水:
溶液中滴加少量氯水: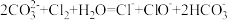
D. 溶液中通入过量
溶液中通入过量 :
:
 是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。常温下,有关弱电解质的电离平衡常数如下表:
是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。常温下,有关弱电解质的电离平衡常数如下表:| 弱酸 |  |  |  |  |  |
| 电离平衡常数(25℃) | 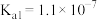 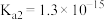 |  | 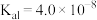 | 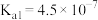 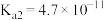 |  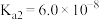 |
(1)以下事实中,能证明
 是弱酸有
是弱酸有a.常温下,
 溶液
溶液
b.等物质的量浓度的
 溶液和
溶液和 溶液与锌粉反应,观察反应初期冒出气泡的快慢,
溶液与锌粉反应,观察反应初期冒出气泡的快慢, 溶液中比
溶液中比 溶液中慢
溶液中慢c.体积相同且pH相同的
 溶液和
溶液和 溶液,用相同物质的量浓度的
溶液,用相同物质的量浓度的 溶液中和,
溶液中和, 溶液消耗的
溶液消耗的 溶液更多
溶液更多(2)纯碱可用于清除厨房的油污,用离子方程式解释原因
 溶液时,加入少许浓盐酸,其目的是:
溶液时,加入少许浓盐酸,其目的是: 溶液,蒸干其水分并灼烧固体,最后得到的物质是
溶液,蒸干其水分并灼烧固体,最后得到的物质是(3)将
 溶液与
溶液与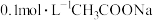 溶液等体积混合,测得室温下该混合溶液
溶液等体积混合,测得室温下该混合溶液 ,该溶液中的离子浓度由大到小排序为
,该溶液中的离子浓度由大到小排序为(4)常温下,向
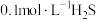 溶液中通入
溶液中通入 或加入
或加入 固体,测得
固体,测得 与溶液pH的关系如图所示(忽略体积的变化及
与溶液pH的关系如图所示(忽略体积的变化及 挥发)。
挥发)。
①当
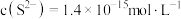 时,溶液中
时,溶液中
 。
。②当溶液
 时,溶液中的
时,溶液中的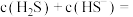
 。
。(5)①相同条件下,
 下列溶液中,
下列溶液中, 由大到小的排列顺序是
由大到小的排列顺序是A.
 B.
B. C.
C. D.
D. E.
E.
②下列离子方程式正确的是
A.
 溶液中通入少量
溶液中通入少量 :
: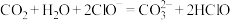
B.
 溶液中通入少量
溶液中通入少量 :
: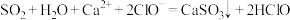
C.
 溶液中滴加少量氯水:
溶液中滴加少量氯水: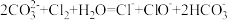
D.
 溶液中通入过量
溶液中通入过量 :
:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】常温下,用0.02mol•L-1MOH溶液滴定100mL0.01mol•L-1HA溶液,右图为加入MOH溶液的体积与混合溶液的pH变化情况(溶液体积变化勿略不计)。

回答下列问题:
(1)由图中信息可知HA为_____ 酸(填“强”或“弱”),滴定所用的最适宜指示剂为______ ,滴定时眼睛注视__________________ 。
(2)常温下一定浓度的MA稀溶液的pH=a,则a_____ 7(填“大于”、“小于”或“等于”)此时,溶液中水电离出的c(OH-)=__________ 。
(3)请写出K点所对应的溶液中离子浓度的由大到小的关系:_______________ 。
(4)K点所对应的溶液中,c(M+)+c(MOH)______ 2c(A-)。(填“大于”“小于”“等于”)
(5)室温下MOH溶液加水稀释过程中,下列数值变小的是_______________ (填序号)
①C(H+) ② C(H+)/ C(OH-) ③ C(OH-) ④ C(OH-)/ C(M+)

回答下列问题:
(1)由图中信息可知HA为
(2)常温下一定浓度的MA稀溶液的pH=a,则a
(3)请写出K点所对应的溶液中离子浓度的由大到小的关系:
(4)K点所对应的溶液中,c(M+)+c(MOH)
(5)室温下MOH溶液加水稀释过程中,下列数值变小的是
①C(H+) ② C(H+)/ C(OH-) ③ C(OH-) ④ C(OH-)/ C(M+)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间。
(1)25℃,不同pH条件下,水溶液中碳元素的存在形态如图所示。
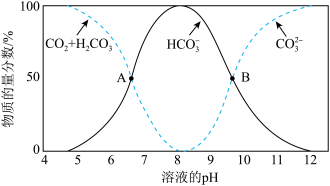
①下列说法正确的是_________ (填字母)。
a.A点,溶液中H2CO3和HCO 浓度相同
浓度相同
b.pH=8时,溶液中含碳元素的微粒主要是HCO
c.当c(HCO )=c(CO
)=c(CO )时,c(H+)>c(OH﹣)
)时,c(H+)>c(OH﹣)
②上述中性水溶液中,阴离子浓度由大到小的关系是___________ ;pH=6时,由水电离出的c(H+)=___________ 。
(2)海水pH稳定在7.9~8.4之间,可用于烟道气中CO2和SO2的吸收剂。
①海水呈弱碱性是因为主要含有___________ 、___________ 、OH﹣(填微粒符号)。
②已知:25℃时,H2CO3电离平衡常数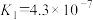 、
、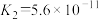 ;H2SO3电离平衡常数
;H2SO3电离平衡常数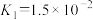 、
、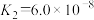 。海水中含有的HCO
。海水中含有的HCO 可用于吸收SO2,该过程的离子方程式是
可用于吸收SO2,该过程的离子方程式是___________ ,吸收后溶液呈弱酸性的原因是___________ 。
(3)洗涤烟气后的海水呈酸性,需处理后再排放。通入O2可将酸性海水中的硫(Ⅳ)(主要以HSO 形式存在)氧化,该反应的离子方程式是
形式存在)氧化,该反应的离子方程式是___________ 。
(1)25℃,不同pH条件下,水溶液中碳元素的存在形态如图所示。

①下列说法正确的是
a.A点,溶液中H2CO3和HCO
 浓度相同
浓度相同b.pH=8时,溶液中含碳元素的微粒主要是HCO

c.当c(HCO
 )=c(CO
)=c(CO )时,c(H+)>c(OH﹣)
)时,c(H+)>c(OH﹣)②上述中性水溶液中,阴离子浓度由大到小的关系是
(2)海水pH稳定在7.9~8.4之间,可用于烟道气中CO2和SO2的吸收剂。
①海水呈弱碱性是因为主要含有
②已知:25℃时,H2CO3电离平衡常数
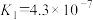 、
、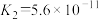 ;H2SO3电离平衡常数
;H2SO3电离平衡常数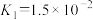 、
、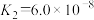 。海水中含有的HCO
。海水中含有的HCO 可用于吸收SO2,该过程的离子方程式是
可用于吸收SO2,该过程的离子方程式是(3)洗涤烟气后的海水呈酸性,需处理后再排放。通入O2可将酸性海水中的硫(Ⅳ)(主要以HSO
 形式存在)氧化,该反应的离子方程式是
形式存在)氧化,该反应的离子方程式是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向 1L 0.1mol·L-1 CH3COOH 溶液中加入 0.1molCH3COONa 固体,则溶液中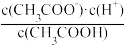
_____ (填“增大”、“不变”或“减小”);写出该溶液中的电荷守恒关系_____ 。
(2)土壤的 pH 一般在 4~9 之间。土壤中 Na2CO3 含量较高时,pH 可达 10.5,试用离子方程式解释土壤呈碱性的原因:_____ 。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为_____ 。
(3)水垢的主要成分 CaCO3可以用过量食醋溶解,请结合化学用语,从沉淀溶解平衡的角度进行解释______________ 。
(4)常温下在 20mL0.1mol·L-1Na2CO3溶液中逐滴加入 0.1mol·L-1HCl 溶液 40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液 pH 变化的部分情况如图所示。回答下列问题:

①在同一溶液中 H2CO3和CO
____________________ (填“能”或“不能”)大量共存。
②当 pH=7 时,溶液中含碳元素的最主要微粒为_____ ,溶液中各种离子的物质的量浓度的大小关系为_________ 。
③已知在 25℃时,CO 水解反应的平衡常数
水解反应的平衡常数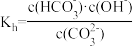 =2.0×10-4,当溶液中c(HCO
=2.0×10-4,当溶液中c(HCO ):c(CO
):c(CO )=2:1 时,溶液的 pH=
)=2:1 时,溶液的 pH=_____ 。
(1)一定温度下,向 1L 0.1mol·L-1 CH3COOH 溶液中加入 0.1molCH3COONa 固体,则溶液中
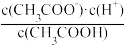
(2)土壤的 pH 一般在 4~9 之间。土壤中 Na2CO3 含量较高时,pH 可达 10.5,试用离子方程式解释土壤呈碱性的原因:
(3)水垢的主要成分 CaCO3可以用过量食醋溶解,请结合化学用语,从沉淀溶解平衡的角度进行解释
(4)常温下在 20mL0.1mol·L-1Na2CO3溶液中逐滴加入 0.1mol·L-1HCl 溶液 40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液 pH 变化的部分情况如图所示。回答下列问题:

①在同一溶液中 H2CO3和CO

②当 pH=7 时,溶液中含碳元素的最主要微粒为
③已知在 25℃时,CO
 水解反应的平衡常数
水解反应的平衡常数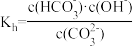 =2.0×10-4,当溶液中c(HCO
=2.0×10-4,当溶液中c(HCO ):c(CO
):c(CO )=2:1 时,溶液的 pH=
)=2:1 时,溶液的 pH=
您最近一年使用:0次
【推荐3】I.已知:乙二酸俗称草酸(结构简式为HOOC—COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10−2,K2=5.4×10−5;碳酸(H2CO3)的电离平衡常数为K1=4.5×10−7,K2=4.7×10−11.草酸钙的Ksp=4.0×10−8,碳酸钙的Ksp=2.5×10−9.回答下列问题:
(1)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH___________ (填“大”、“小”或“相等”)
(2)常温下将20mL 0.4mol/L的KOH溶液与20mL 0.2mol/L的草酸溶液混合,则混合后溶液中阴离子浓度的大小顺序为___________ 。
(3)25℃时向20mL碳酸钙的饱和溶液中逐滴加入8.0×10−4mol/L的草酸钾溶液20mL,能否产生沉淀___________ (填“能”或“不能”)。
Ⅱ. 目前高铁酸钠(Na2FeO4)被广泛应用于水的处理,具有高效、无毒的优点。某地海水样品经Na2FeO4处理后,所含离子及其浓度见下表(H+和OH-浓度小,未列出):
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2·7H2O,过程如下:
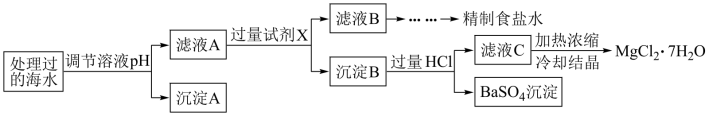
注:离子的浓度小于1.0×10−5mol·L−1,可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10−38,Ksp[Mg(OH)2]=5.0×10−12;操作过程中溶液体积的变化忽略不计。
(4)根据表中列出的离子浓度计算a=___________ ;沉淀A是___________ (填化学式)。
(5)在调节溶液pH时,理论上应调节的pH范围是___________ ;加入的过量试剂X为___________ (填化学式)。
(6)加入过量HCl的作用为___________ 。
(1)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH
(2)常温下将20mL 0.4mol/L的KOH溶液与20mL 0.2mol/L的草酸溶液混合,则混合后溶液中阴离子浓度的大小顺序为
(3)25℃时向20mL碳酸钙的饱和溶液中逐滴加入8.0×10−4mol/L的草酸钾溶液20mL,能否产生沉淀
Ⅱ. 目前高铁酸钠(Na2FeO4)被广泛应用于水的处理,具有高效、无毒的优点。某地海水样品经Na2FeO4处理后,所含离子及其浓度见下表(H+和OH-浓度小,未列出):
| 离子 | SO | Mg2+ | Fe3+ | Na+ | Cl− |
| 浓度/(mol·L-1) | a | 0.05 | 0.10 | 0.50 | 0.56 |

注:离子的浓度小于1.0×10−5mol·L−1,可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10−38,Ksp[Mg(OH)2]=5.0×10−12;操作过程中溶液体积的变化忽略不计。
(4)根据表中列出的离子浓度计算a=
(5)在调节溶液pH时,理论上应调节的pH范围是
(6)加入过量HCl的作用为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】金属镍与铁,钴相似,在常温下对水和空气都较稳定,能抗碱性腐蚀。常温下,镍即可与一氧化碳反应,形成剧毒的四羰基镍(Ni(CO)4),加热后它又会分解成金属镍和—氧化碳。工业上用含废镍废料(含有铝、铁和有机物)为原料制备兰尼镍的工艺流程如图所示:
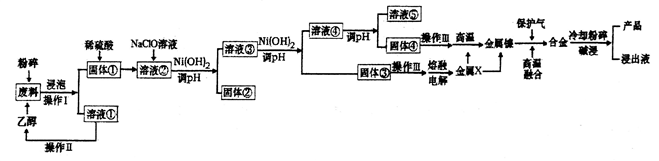
已知:25℃时Ni(OH)2的Ksp=5.4×10-16;Al(OH)3的Ksp=3.0×10-34.
(1)若将NaOH固体进行高温熔融,可选择的坩埚为_________ 。
a.铁坩埚 b.氧化铝坩埚 c.石英坩埚 d.镍坩埚
(2)操作Ⅱ的名称为__________ ;实验室中在进行操作III时,仪器除酒精灯、坩埚、三脚架外还缺______________ 。
(3)加入NaClO溶液时发生反应的离子反应方程式______________________________ 。
(4)固体④经操作III得到NiO。合金中铝和镍的物质的量之比为2:3,则前后两份金属铝用量的最佳配比为________________ 。
(5)25℃时,若测得溶液⑤pH=9,该溶液中c(Ni2+)/c(A13+)=__________ 。
(6)将金属X与金属镍进行高温融合时,可否用CO做保护气,请说明原因_________________________________ 。

已知:25℃时Ni(OH)2的Ksp=5.4×10-16;Al(OH)3的Ksp=3.0×10-34.
(1)若将NaOH固体进行高温熔融,可选择的坩埚为
a.铁坩埚 b.氧化铝坩埚 c.石英坩埚 d.镍坩埚
(2)操作Ⅱ的名称为
(3)加入NaClO溶液时发生反应的离子反应方程式
(4)固体④经操作III得到NiO。合金中铝和镍的物质的量之比为2:3,则前后两份金属铝用量的最佳配比为
(5)25℃时,若测得溶液⑤pH=9,该溶液中c(Ni2+)/c(A13+)=
(6)将金属X与金属镍进行高温融合时,可否用CO做保护气,请说明原因
您最近一年使用:0次
【推荐2】某炼铜厂烟道灰的主要成分为锌、锰、铁、铜的单质及氧化物,一种回收利用烟道灰的工艺流程如图所示:

已知:①常温下,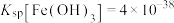 ,
,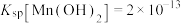 ;
;
②离子浓度小于等于 时认为沉淀完全;
时认为沉淀完全;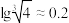 。
。
回答下列问题:
(1)“碱浸”时,Zn被浸出转化为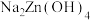 ,
,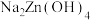 中Zn元素的化合价为
中Zn元素的化合价为_______ 价。
(2)“沉锌”时防止碱性过强生成 ,可采取的措施为
,可采取的措施为_______ (任写一条)。
(3)滤液Ⅱ的主要溶质为_______ (填化学式,下同),滤渣Ⅱ的主要成分为_______ 。
(4)“除铁”时先加入 溶液将
溶液将 氧化为
氧化为 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ ;然后再调节溶液的pH为b,若此时 ,则b的取值范围为
,则b的取值范围为_______ 。
(5)“氧化沉锰”过程中, 经
经 氧化转化为
氧化转化为 ,该反应中氧化剂和还原剂的物质的量之比为
,该反应中氧化剂和还原剂的物质的量之比为_______ ;写出 的一种用途;
的一种用途;_______ 。

已知:①常温下,
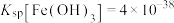 ,
,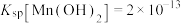 ;
;②离子浓度小于等于
 时认为沉淀完全;
时认为沉淀完全;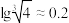 。
。回答下列问题:
(1)“碱浸”时,Zn被浸出转化为
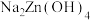 ,
,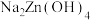 中Zn元素的化合价为
中Zn元素的化合价为(2)“沉锌”时防止碱性过强生成
 ,可采取的措施为
,可采取的措施为(3)滤液Ⅱ的主要溶质为
(4)“除铁”时先加入
 溶液将
溶液将 氧化为
氧化为 ,发生反应的离子方程式为
,发生反应的离子方程式为 ,则b的取值范围为
,则b的取值范围为(5)“氧化沉锰”过程中,
 经
经 氧化转化为
氧化转化为 ,该反应中氧化剂和还原剂的物质的量之比为
,该反应中氧化剂和还原剂的物质的量之比为 的一种用途;
的一种用途;
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】废旧钴金属片中的钴有+2价和+3价,还含有锰、铁、钙、镁、铝等金属元素及碳粉等,回收钴的工艺流程如下:
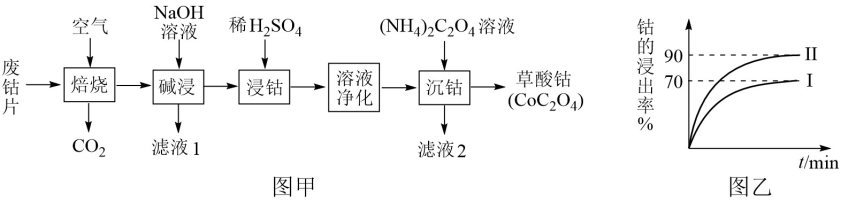
(1)焙烧时为了使废旧钴金属片充分反应,可采取的措施是____________________ (任写一条)。
(2)该流程中浸钴时,钴的浸出率最高只能达到70%,后来改进方法,加入使用硫酸进行第一次浸取后,再加入Na2SO3溶液进行第二次浸取,从而使钴的浸出率达90%以上,写出第二次浸出钴时溶液中发生反应的离子方程式:____________________ 。
(3)净化溶液的操作中含有多个步骤,先除铁后除锰。
①除铁:常温下,调节溶液pH为1.5~2.0后,加H2O2,反应一段时间,加8%Na2CO3溶液,将溶液的pH调至4.0~5.0。已知Fe(OH)3的溶度积常数为4×10-38,则当溶液的pH调至4.0时,溶液中的c(Fe3+)=__________ mol·L-1。
②除锰:加入NaClO溶液。写出该离子方程式:____________________ 。
③减钙镁:加入NH4F溶液,沉淀大部分的钙、镁的离子。
试解释为何草酸铵溶液沉钴前要减钙镁:______________________________ 。
(4)滤液2的主要成分为____________________ (以化学式表示)。
(5)得到的草酸钴沉淀须洗涤干燥。写出检验沉淀已被洗净的操作与现象__________ 。

(1)焙烧时为了使废旧钴金属片充分反应,可采取的措施是
(2)该流程中浸钴时,钴的浸出率最高只能达到70%,后来改进方法,加入使用硫酸进行第一次浸取后,再加入Na2SO3溶液进行第二次浸取,从而使钴的浸出率达90%以上,写出第二次浸出钴时溶液中发生反应的离子方程式:
(3)净化溶液的操作中含有多个步骤,先除铁后除锰。
①除铁:常温下,调节溶液pH为1.5~2.0后,加H2O2,反应一段时间,加8%Na2CO3溶液,将溶液的pH调至4.0~5.0。已知Fe(OH)3的溶度积常数为4×10-38,则当溶液的pH调至4.0时,溶液中的c(Fe3+)=
②除锰:加入NaClO溶液。写出该离子方程式:
③减钙镁:加入NH4F溶液,沉淀大部分的钙、镁的离子。
| 物质 | MgF2 | CaF2 | CoF2 | MgC2O4 | CaC2O4 | CoC2O4 |
| 溶度积 | 4×10-9 | 5.3×10-9 | 4×10-3 | 5×10-6 | 6.4×10-9 | 1.7×10-7 |
试解释为何草酸铵溶液沉钴前要减钙镁:
(4)滤液2的主要成分为
(5)得到的草酸钴沉淀须洗涤干燥。写出检验沉淀已被洗净的操作与现象
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
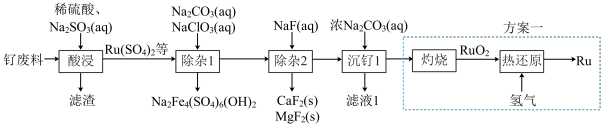
【推荐1】 (钉)被广泛用于制笔。某小组以某含
(钉)被广泛用于制笔。某小组以某含 废料[主要成分是
废料[主要成分是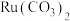 ,含
,含 (其中
(其中 为+6价)、
为+6价)、 、
、 、
、 和
和 等]为原料制备
等]为原料制备 的流程如图所示:
的流程如图所示:
已知:常温下, ,
, ;离子浓度小于或等于
;离子浓度小于或等于 时认为该离子已被完全除去。
时认为该离子已被完全除去。
回答下列问题:
(1)滤渣主要成分是___________ (填化学式)。
(2)“酸浸”中 转化成
转化成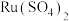 的离子方程式为
的离子方程式为___________ 。
(3)“除杂1”中氯元素被还原成最低价态,若只氧化 ,生成
,生成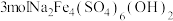 理论上需要
理论上需要___________ 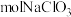 。
。
(4)“除杂1”之后,若滤液中 ,则“除杂2”中先生成的沉淀是
,则“除杂2”中先生成的沉淀是___________ (填化学式)。“除杂2”的滤液中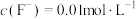 ,则
,则 和
和 是否除尽?
是否除尽?___________ (填“是”或“否”)。
(5)“除杂2”宜选择的容器有___________(填标号)。
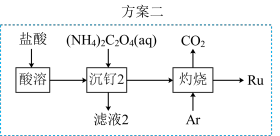
(6)该小组设计方案2优化方案1,从安全角度分析,方案2优于方案1,其理由是___________ 。
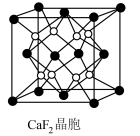
(7) 晶胞如图所示,晶胞中,钙离子将晶胞切割成8个小空隙,
晶胞如图所示,晶胞中,钙离子将晶胞切割成8个小空隙, 可以看成是填充在
可以看成是填充在 割切的空隙中,则
割切的空隙中,则 填充在
填充在 构成的
构成的___________ (填“正八面体形”“正方形”或“正四面体形”)空隙中,其填充率为___________ 。
 (钉)被广泛用于制笔。某小组以某含
(钉)被广泛用于制笔。某小组以某含 废料[主要成分是
废料[主要成分是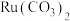 ,含
,含 (其中
(其中 为+6价)、
为+6价)、 、
、 、
、 和
和 等]为原料制备
等]为原料制备 的流程如图所示:
的流程如图所示:
已知:常温下,
 ,
, ;离子浓度小于或等于
;离子浓度小于或等于 时认为该离子已被完全除去。
时认为该离子已被完全除去。回答下列问题:
(1)滤渣主要成分是
(2)“酸浸”中
 转化成
转化成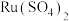 的离子方程式为
的离子方程式为(3)“除杂1”中氯元素被还原成最低价态,若只氧化
 ,生成
,生成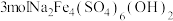 理论上需要
理论上需要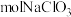 。
。(4)“除杂1”之后,若滤液中
 ,则“除杂2”中先生成的沉淀是
,则“除杂2”中先生成的沉淀是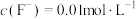 ,则
,则 和
和 是否除尽?
是否除尽?(5)“除杂2”宜选择的容器有___________(填标号)。
| A.陶瓷 | B.铁质 | C.石英 | D.氧化铝 |
(6)该小组设计方案2优化方案1,从安全角度分析,方案2优于方案1,其理由是

(7)
 晶胞如图所示,晶胞中,钙离子将晶胞切割成8个小空隙,
晶胞如图所示,晶胞中,钙离子将晶胞切割成8个小空隙, 可以看成是填充在
可以看成是填充在 割切的空隙中,则
割切的空隙中,则 填充在
填充在 构成的
构成的
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
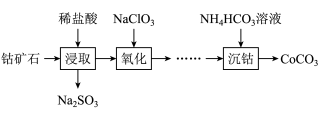
【推荐2】CoCO3主要用作选矿剂、伪装涂料的颜料等。用钴矿石(含Co2O3·CoO及少量Fe2O3、Al2O3、MnO2等)生产CoCO3的流程如下:
下表列出了几种离子生成氢氧化物沉淀的pH(“沉淀完全”是指溶液中离子浓度低于1.0×10-5 mol·L-1)
(1)写出“浸取”步骤Co2O3·CoO发生反应的离子方程式 ______________________ 。
(2)“浸取”步骤除Co2O3·CoO外,钴矿石中还能被Na2SO3还原的物质有______ (填化学式)。
(3)加NaClO3的目的是氧化Fe2+,NaClO3的用量过多会造成的不良后果是_________ 。
(4)“沉钴”步骤向CoCl2溶液加入NH4HCO3溶液需要55~57 ℃条件下进行,温度控制在
55~57 ℃的原因为________________________________________________________ 。
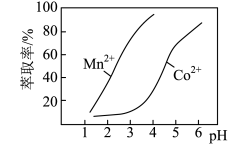
(5)已知金属萃取剂对金属离子的萃取率与pH的关系如图所示。请补充完整由“氧化”后的溶液制备CoCO3的实验方案:向“氧化”后的溶液中加入_______________________ ,得较纯CoCl2溶液,加入NH4HCO3溶液沉钴得CoCO3。(实验中须使用试剂:Na2CO3溶液、金属萃取剂、盐酸)。

下表列出了几种离子生成氢氧化物沉淀的pH(“沉淀完全”是指溶液中离子浓度低于1.0×10-5 mol·L-1)
| Al3+ | Fe3+ | Fe2+ | Mn2+ | Co2+ | |
| 开始沉淀的pH | 4.0 | 2.7 | 7.6 | 7.7 | 7.6 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.6 | 9.8 | 9.2 |
(2)“浸取”步骤除Co2O3·CoO外,钴矿石中还能被Na2SO3还原的物质有
(3)加NaClO3的目的是氧化Fe2+,NaClO3的用量过多会造成的不良后果是
(4)“沉钴”步骤向CoCl2溶液加入NH4HCO3溶液需要55~57 ℃条件下进行,温度控制在
55~57 ℃的原因为

(5)已知金属萃取剂对金属离子的萃取率与pH的关系如图所示。请补充完整由“氧化”后的溶液制备CoCO3的实验方案:向“氧化”后的溶液中加入
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种常见的氮氧化物,其中一种呈红棕色。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:为制备纯净干燥的气体,下表中缺少的药品是:_______ 、________ 。

(2)乙组同学利用甲组制得NO和Cl2制备NOCl,装置如图所示:
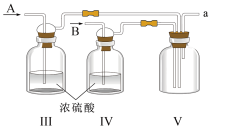

①装置连接顺序为a→________ (按气流自左向右方向,用小写字母表示)。
②为了使气体充分反应,从A处进入的气体是________ (填Cl2或NO)。实验中先通入Cl2,待装置Ⅴ中充满黄绿色气体时,再将NO缓缓通入,此操作的目的是________ (回答一条即可)。
③装置Ⅴ生成NOCl的化学方程式是________ 。
④装置Ⅵ的作用为________ ,若无该装置,Ⅷ中NOCl可能发生反应的化学方程式为________ 。
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为bmL.亚硝酰氯(NOCl)的质量分数为________ (用代数式表示即可)。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:为制备纯净干燥的气体,下表中缺少的药品是:

装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 反应漏斗中 | ||
| 制备纯净氯气 | 二氧化锰 | ①______ | 饱和食盐水 |
| 制备纯净一氧化氮 | 铜 | 稀硝酸 | ②______ |


①装置连接顺序为a→
②为了使气体充分反应,从A处进入的气体是
③装置Ⅴ生成NOCl的化学方程式是
④装置Ⅵ的作用为
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为bmL.亚硝酰氯(NOCl)的质量分数为
您最近一年使用:0次



