钯(Pd)是一种银白色金属,在航天、航空、航海、兵器和核能等高科技领域用途广泛。以硫化镍铜矿(含有 以及少量的
以及少量的 )为原料制备
)为原料制备 和
和 的工艺流程如图:
的工艺流程如图:
II.王水具有强氧化性,能将单质钯转化为 。
。
III. 时,
时,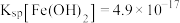 ,
, ,
,
 。
。
试回答下列问题:
(1)在硫化镍铜矿灼烧过程中,部分元素转化为氧化物,在实验室枃烧时,下列仪器中不需要用到的是____________ (填标号);“灼烧”前将矿石粉碎成细颗粒的目的是____________ (填一条即可)。 的利用率,通常“酸浸”时需加热,试分析可能的原因:
的利用率,通常“酸浸”时需加热,试分析可能的原因:____________ (从平衡移动角度作答)和加快浸取速率。
(3)“置换”时加入铁单质除去溶液中的 ,再
,再_______________ (填方法)除去引入的铁元素。
(4)“除硅”过程中发生反应的离子方程式为____________ , 的空间结构为
的空间结构为____________ 。
(5)在制备 的过程中,需加入过量的浓氨水,原因为
的过程中,需加入过量的浓氨水,原因为_________________ 。
(6)“氢气还原”时有 生成,
生成, 溶液中离子浓度大小关系为
溶液中离子浓度大小关系为____________ 。
 以及少量的
以及少量的 )为原料制备
)为原料制备 和
和 的工艺流程如图:
的工艺流程如图:
II.王水具有强氧化性,能将单质钯转化为
 。
。III.
 时,
时,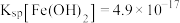 ,
, ,
,
 。
。试回答下列问题:
(1)在硫化镍铜矿灼烧过程中,部分元素转化为氧化物,在实验室枃烧时,下列仪器中不需要用到的是

 的利用率,通常“酸浸”时需加热,试分析可能的原因:
的利用率,通常“酸浸”时需加热,试分析可能的原因:(3)“置换”时加入铁单质除去溶液中的
 ,再
,再(4)“除硅”过程中发生反应的离子方程式为
 的空间结构为
的空间结构为(5)在制备
 的过程中,需加入过量的浓氨水,原因为
的过程中,需加入过量的浓氨水,原因为(6)“氢气还原”时有
 生成,
生成, 溶液中离子浓度大小关系为
溶液中离子浓度大小关系为
更新时间:2024-05-08 10:23:25
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
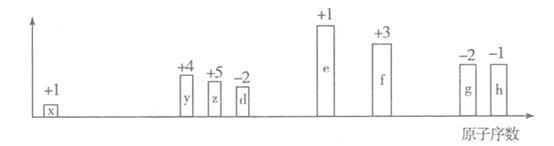
根据判断出的元素回答问题:
(1)y在元素周期表中的位置是____________________ 。z、d、e、f四种元素的简单离子中,半径最大的是_____________ (填离子符号)
(2)e的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程式___________________ 。
(3)z的氢化物和h的氢化物反应形成化合物A,A中含有的化学键类型为____________ ;
(4)含f的某化合物可用作净水剂的原理是_________________ (用离子方程式表示)
(5)25℃,f的最高价氧化物的水化物的Ksp=1.0 10-34,使含0.1 mol·L-1 f离子的溶液开始产生沉淀的pH为
10-34,使含0.1 mol·L-1 f离子的溶液开始产生沉淀的pH为________________ 。
(6)元素e和g组成的化合物B的水溶液中离子浓度由大到小的顺序为____________ 。

根据判断出的元素回答问题:
(1)y在元素周期表中的位置是
(2)e的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程式
(3)z的氢化物和h的氢化物反应形成化合物A,A中含有的化学键类型为
(4)含f的某化合物可用作净水剂的原理是
(5)25℃,f的最高价氧化物的水化物的Ksp=1.0
 10-34,使含0.1 mol·L-1 f离子的溶液开始产生沉淀的pH为
10-34,使含0.1 mol·L-1 f离子的溶液开始产生沉淀的pH为(6)元素e和g组成的化合物B的水溶液中离子浓度由大到小的顺序为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】结合表回答下列问题(均为常温下的数据):
请回答下列问题:
(1)同浓度的CH3COO-、 、
、 、
、 、ClO-中结合H+的能力最强的是
、ClO-中结合H+的能力最强的是___________ 。
(2)常温下0.1 mol/L的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
(3)取等体积pH相等的CH3COOH、HClO两溶液,别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(CH3COOH)___________ V(HClO)(填“>”、“<”或“=”)。
(4)常温下,用0.200 mol/L NaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,滴定曲线如图所示,③点所示溶液中:2c(C2O )+2c(HC2O
)+2c(HC2O )+2c(H2C2O4)=c(Na+)。点①所示溶液中该草酸溶液中离子浓度大小关系为
)+2c(H2C2O4)=c(Na+)。点①所示溶液中该草酸溶液中离子浓度大小关系为_____________ 。点③所示溶液中溶质成分为__________ (用化学式表示)。

(5)向0.1 mol/L的草酸氢钠溶液里滴加KOH溶液至中性,此时溶液里各粒子浓度关系正确的是______(填字母代号)。
| 化学式 | CH3COOH | H2SO3 | HClO | H2CO3 | H2C2O4 |
| 电离平衡常数 | K=1.8×10-5 | K1=1.2×10-2 K2=6.6×10-8 | K=3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.4×10-5 |
请回答下列问题:
(1)同浓度的CH3COO-、
 、
、 、
、 、ClO-中结合H+的能力最强的是
、ClO-中结合H+的能力最强的是(2)常温下0.1 mol/L的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
| A.c(H+) | B. | C. | D.c(OH-) |
(4)常温下,用0.200 mol/L NaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,滴定曲线如图所示,③点所示溶液中:2c(C2O
 )+2c(HC2O
)+2c(HC2O )+2c(H2C2O4)=c(Na+)。点①所示溶液中该草酸溶液中离子浓度大小关系为
)+2c(H2C2O4)=c(Na+)。点①所示溶液中该草酸溶液中离子浓度大小关系为
(5)向0.1 mol/L的草酸氢钠溶液里滴加KOH溶液至中性,此时溶液里各粒子浓度关系正确的是______(填字母代号)。
A.c(Na+)=c(HC2O )+c(H2C2O4)+c(C2O )+c(H2C2O4)+c(C2O ) ) | B.c(K+)=c(H2C2O4)+c(C2O ) ) |
C.c(K+)+c(Na+)=c(HC2O )+c(C2O )+c(C2O ) ) | D.c(K+)<c(Na+) |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示 水及部分产物已略去
水及部分产物已略去 .
.
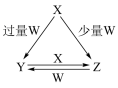
(1)若X为金属单质,W是某强酸的稀溶液,X与过量W反应生成Y的离子方程式为______ ;组成X的元素在周期表中的位置是 ______ 。
(2)若X为非金属单质,W是空气的主要成分之一,它们之间转化的能量变化如图A所示,则X+W→Z的热化学方程式为______ 。

(3)若X、Y为正盐,X的水溶液显酸性,W为一元强碱(化学式为MOH),则X与过量W反应生成Y的离子方程式为______ 。室温下,若用0.1mol/L的W溶液滴定V mL 0.1mol/L HA溶液,滴定曲线如图B所示,则a、b、c、d四点溶液中水的电离程度最大的是 ______ 点;a点溶液中离子浓度的大小顺序为 ______ .
(4)若X为强碱,常温下W为有刺激性气味的气态氧化物。常温时,将Z的水溶液露置于空气中,请在图C中画出其pH随时间(t)的变化趋势曲线图 不考虑水的挥发
不考虑水的挥发
______ 。
 水及部分产物已略去
水及部分产物已略去 .
.
(1)若X为金属单质,W是某强酸的稀溶液,X与过量W反应生成Y的离子方程式为
(2)若X为非金属单质,W是空气的主要成分之一,它们之间转化的能量变化如图A所示,则X+W→Z的热化学方程式为

(3)若X、Y为正盐,X的水溶液显酸性,W为一元强碱(化学式为MOH),则X与过量W反应生成Y的离子方程式为
(4)若X为强碱,常温下W为有刺激性气味的气态氧化物。常温时,将Z的水溶液露置于空气中,请在图C中画出其pH随时间(t)的变化趋势曲线图
 不考虑水的挥发
不考虑水的挥发
您最近一年使用:0次
【推荐1】工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备钒的主要流程如图:
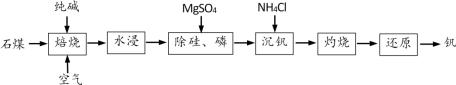
已知:①NH4VO3难溶于水。②Ksp(MgSiO3)=2.4×10-5,Ksp[Mg3(PO4)2]=2.7×10-27。
(1)焙烧:通入空气的条件下,向石煤中加纯碱焙烧,将V2O3转化为NaVO3的化学方程式为___ 。
(2)除硅、磷:
①用MgSO4溶液除硅、磷时,Si、P会形成Mg3(PO4)2、MgSiO3沉淀。若沉淀后溶液中c(PO )=1.0×10-8mol•L-1,则c(SiO
)=1.0×10-8mol•L-1,则c(SiO )=
)=___ mol•L-1。
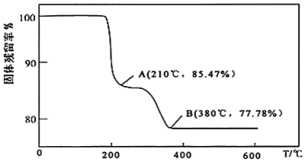
②如图所示,随着温度升高,除磷率下降,其原因是Mg3(PO4)2溶解度增大、___ ;随着温度升高,除硅率升高,其原因是___ 。

(3)沉钒:此过程反应温度需控制在50℃左右,温度不能过高的原因为___ 。
(4)灼烧:在灼烧NH4VO3的过程中,固体的残留率(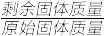 ×100%)随温度变化的曲线如图所示,则A~B段发生反应的方程式为
×100%)随温度变化的曲线如图所示,则A~B段发生反应的方程式为___ 。

已知:①NH4VO3难溶于水。②Ksp(MgSiO3)=2.4×10-5,Ksp[Mg3(PO4)2]=2.7×10-27。
(1)焙烧:通入空气的条件下,向石煤中加纯碱焙烧,将V2O3转化为NaVO3的化学方程式为
(2)除硅、磷:
①用MgSO4溶液除硅、磷时,Si、P会形成Mg3(PO4)2、MgSiO3沉淀。若沉淀后溶液中c(PO
 )=1.0×10-8mol•L-1,则c(SiO
)=1.0×10-8mol•L-1,则c(SiO )=
)=②如图所示,随着温度升高,除磷率下降,其原因是Mg3(PO4)2溶解度增大、

(3)沉钒:此过程反应温度需控制在50℃左右,温度不能过高的原因为
(4)灼烧:在灼烧NH4VO3的过程中,固体的残留率(
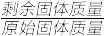 ×100%)随温度变化的曲线如图所示,则A~B段发生反应的方程式为
×100%)随温度变化的曲线如图所示,则A~B段发生反应的方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】草酸(H2C2O4)是一种二元酸。已知在常温下,草酸的电离常数K1=6×10-2,K2=6×10-5。草酸钙Ksp(CaC2O4)=4×10-8。请回答下列问题:
(1)常温下,NaHC2O4溶液的pH值_______ 7(填“>”“<”或“=”)。
(2)常温下,在足量NaHC2O4溶液中加入少量CaCl2固体,发生反应:Ca2++2HC2O =CaC2O4↓+H2C2O4。
=CaC2O4↓+H2C2O4。
①该反应的化学平衡常数表达式为:K=_______ 。
②若反应后溶液的pH值为2,此时,溶液中c(HC2O )×c(Ca2+)=
)×c(Ca2+)=_______ (计算结果保留两位有效数字)。
(3)一水草酸钙(CaC2O4∙H2O)制备方法如下:
步骤Ⅰ:用精制氯化钙溶液与草酸溶液共热,过滤,洗涤,将固体溶于热盐酸中;
步骤Ⅱ:加氨水反应得一水草酸钙,过滤,热水洗涤,在105℃干燥得产品。
步骤Ⅰ中反应需加热,关于加热的作用下列选项中正确的有_______ 。
A.加快反应速率 B.促进草酸电离 C.减少沉淀吸附杂质
(4)等物质的量的H2C2O4与NaOH反应生成NaHC2O4。基于此原理,某学生试图用甲基橙作指示剂,通过酸碱滴定测定草酸溶液浓度。
①甲基橙(用化学式HIn表示)本身是一种有机弱酸,其电离方程式为:HIn H++In-。酸根离子In-的颜色是
H++In-。酸根离子In-的颜色是_______ 。甲基橙的酸性与草酸相比,_______ (填“前者强”“前者弱”“几乎相等”或“无法判断”)。
②若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得草酸浓度会_______ (填“偏大”“偏小”或“无影响”)。
(1)常温下,NaHC2O4溶液的pH值
(2)常温下,在足量NaHC2O4溶液中加入少量CaCl2固体,发生反应:Ca2++2HC2O
 =CaC2O4↓+H2C2O4。
=CaC2O4↓+H2C2O4。①该反应的化学平衡常数表达式为:K=
②若反应后溶液的pH值为2,此时,溶液中c(HC2O
 )×c(Ca2+)=
)×c(Ca2+)=(3)一水草酸钙(CaC2O4∙H2O)制备方法如下:
步骤Ⅰ:用精制氯化钙溶液与草酸溶液共热,过滤,洗涤,将固体溶于热盐酸中;
步骤Ⅱ:加氨水反应得一水草酸钙,过滤,热水洗涤,在105℃干燥得产品。
步骤Ⅰ中反应需加热,关于加热的作用下列选项中正确的有
A.加快反应速率 B.促进草酸电离 C.减少沉淀吸附杂质
(4)等物质的量的H2C2O4与NaOH反应生成NaHC2O4。基于此原理,某学生试图用甲基橙作指示剂,通过酸碱滴定测定草酸溶液浓度。
①甲基橙(用化学式HIn表示)本身是一种有机弱酸,其电离方程式为:HIn
 H++In-。酸根离子In-的颜色是
H++In-。酸根离子In-的颜色是②若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得草酸浓度会
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】以钴渣(主要成分是Co2O3,含少量Al2O3、CuO、CdO、Fe2O3等)为原料制备钴和钴酸锂的流程如图,请回答下列问题:
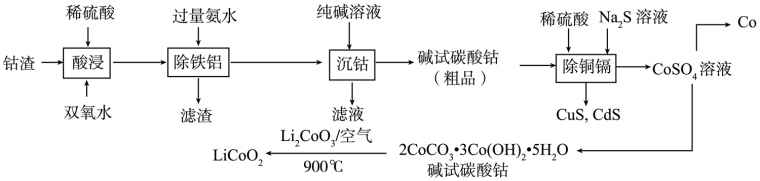
已知:①常温下,几种物质的溶度积如表所示。
②常温下,NH3·H2O的电离常数Kb=2.0×10-5。
请回答下列问题:
(1)“酸浸”前需要将钴渣粉碎,原因是____ 。
(2)滤渣的主要成分____ (写化学式)。
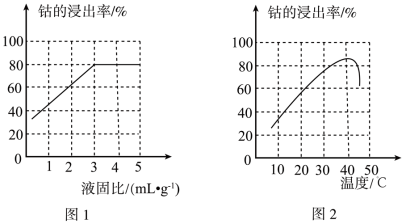
(3)“酸浸”时钴的浸出率与液固比的关系如图1所示。最佳液固比为____ mL·g-1;当液固比一定时,相同时间内钴的浸出率与温度的关系如图2所示,解释40℃时钴的浸出率达到峰值的原因为:____ 。
(4)“除铜镉”中,溶液中c(Co2+)=0.1mol·L-1,当c(Cd2+)=1×10-5mol·L-1时,____ (填“有”或“没有”)CoS生成。
(5)CoSO4溶液中加入小苏打溶液产生碱式碳酸钴并放出气体,写出该反应的离子方程式:____ 。

已知:①常温下,几种物质的溶度积如表所示。
| 物质 | Al(OH)3 | Fe(OH)3 | CuS | CdS | CoS |
| Ksp的近似值 | 1×10-33 | 1×10-38 | 6.4×10-44 | 8×10-27 | 4×10-21 |
请回答下列问题:
(1)“酸浸”前需要将钴渣粉碎,原因是
(2)滤渣的主要成分
(3)“酸浸”时钴的浸出率与液固比的关系如图1所示。最佳液固比为

(4)“除铜镉”中,溶液中c(Co2+)=0.1mol·L-1,当c(Cd2+)=1×10-5mol·L-1时,
(5)CoSO4溶液中加入小苏打溶液产生碱式碳酸钴并放出气体,写出该反应的离子方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X的原子结构示意图为________________ Y原子核外价电子排布图 ________________。
(2)XZ2与YZ2分子的立体结构分别是________和________________,相同条件下两者在水中的溶解度较大的是__________(写分子式),理由是_________________________。
(3)Q的元素符号是__________,它的基态原子的核外电子排布式为______________,在形成化合物时它的最高化合价为__________。
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键_____________________。
(1)X的原子结构示意图为________________ Y原子核外价电子排布图 ________________。
(2)XZ2与YZ2分子的立体结构分别是________和________________,相同条件下两者在水中的溶解度较大的是__________(写分子式),理由是_________________________。
(3)Q的元素符号是__________,它的基态原子的核外电子排布式为______________,在形成化合物时它的最高化合价为__________。
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键_____________________。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】氮可以形成多种离子,如N3-、 、
、 、
、 、
、 、
、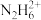 等,已知
等,已知 与
与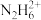 是由中性分子结合质子形成的,类似于
是由中性分子结合质子形成的,类似于 ,因此有类似于
,因此有类似于  的性质。
的性质。
(1)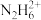 在碱性溶液中反应的离子方程式:
在碱性溶液中反应的离子方程式:_____________________________________ 。
(2) 的电子式为
的电子式为__________________________ , 的构型为
的构型为____________ 。
(3)写出一种与 是等电子体的微粒化学式
是等电子体的微粒化学式___________ 。
(4)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为 “盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N N键。则“N5”分子碎片所带电荷是
N键。则“N5”分子碎片所带电荷是_______ 。
 、
、 、
、 、
、 、
、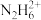 等,已知
等,已知 与
与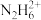 是由中性分子结合质子形成的,类似于
是由中性分子结合质子形成的,类似于 ,因此有类似于
,因此有类似于  的性质。
的性质。(1)
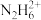 在碱性溶液中反应的离子方程式:
在碱性溶液中反应的离子方程式:(2)
 的电子式为
的电子式为 的构型为
的构型为(3)写出一种与
 是等电子体的微粒化学式
是等电子体的微粒化学式(4)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为 “盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N
 N键。则“N5”分子碎片所带电荷是
N键。则“N5”分子碎片所带电荷是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】硒是一种非金属,可以用作光敏材料、电解锰行业的催化剂。
(1)Se是元素周期表中第34号元素,其基态原子的核外电子排布式为___________ ,其价电子的轨道表示式为___________ 。
(2)根据价层电子对互斥理论,可以推知SeO 的空间构型为
的空间构型为___________ ,其中Se原子采用的轨道杂化方式为___________ 。
(3)已知CSe2与CO2结构相似,①CSe2分子内的键角Se—C—Se、②H2Se分子内的键角H—Se—H、③SeO3分子内的键角O—Se—O,三种键角由大到小的顺序为___________ (填序号)。H2Se、SeO3、Na2Se的沸点由大到小的顺序为___________ 。
(4)铜的某种硒化物的晶胞结构如图所示,则该化合物的化学式为___________ 。若其晶体密度为d g·cm-3,NA为阿伏加德罗常数的值,则晶胞参数a=___________ pm(用含d和NA的式子表示)。

(1)Se是元素周期表中第34号元素,其基态原子的核外电子排布式为
(2)根据价层电子对互斥理论,可以推知SeO
 的空间构型为
的空间构型为(3)已知CSe2与CO2结构相似,①CSe2分子内的键角Se—C—Se、②H2Se分子内的键角H—Se—H、③SeO3分子内的键角O—Se—O,三种键角由大到小的顺序为
(4)铜的某种硒化物的晶胞结构如图所示,则该化合物的化学式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】以废旧铅酸电池中的含铅废料( 等)为原料制备
等)为原料制备 ,实现铅的再生利用。流程示意图如下:
,实现铅的再生利用。流程示意图如下:
ii.
(1)溶浸
 均转化为
均转化为 。
。
①上述流程中能提高含铅废料中铅的浸出率的措施有_______ 。
② 转化为
转化为 的反应有:
的反应有: 、
、_______ 。
(2)结晶
①所得 中含有少量
中含有少量 ,原因是
,原因是_______ (用方程式表示)。
②向母液中补加一定量盐酸,可继续浸取含铅废料。重复操作的结果如下:
循环3次后, 纯度急剧降低,此时向母液中加入
纯度急剧降低,此时向母液中加入_____ (填试剂),过滤,滤液可再次参与循环。
(3)脱氯
 在某浓度
在某浓度 溶液中的溶解度曲线如下图所示。
溶液中的溶解度曲线如下图所示。_______ 。
(4)测定废料中铅的含量
将 含铅废料与足量盐酸、
含铅废料与足量盐酸、 溶液充分反应,得到
溶液充分反应,得到 溶液。取
溶液。取 溶液加水稀释,再加几滴二甲酚橙作指示剂,用
溶液加水稀释,再加几滴二甲酚橙作指示剂,用 的乙二胺四乙酸二钠盐(用
的乙二胺四乙酸二钠盐(用 表示)进行滴定,滴定终点时消耗
表示)进行滴定,滴定终点时消耗 溶液
溶液 。计算废料中铅的质量分数
。计算废料中铅的质量分数_______ 。
资料:滴定原理为:
 等)为原料制备
等)为原料制备 ,实现铅的再生利用。流程示意图如下:
,实现铅的再生利用。流程示意图如下:

ii.

(1)溶浸
 均转化为
均转化为 。
。①上述流程中能提高含铅废料中铅的浸出率的措施有
②
 转化为
转化为 的反应有:
的反应有: 、
、(2)结晶
①所得
 中含有少量
中含有少量 ,原因是
,原因是②向母液中补加一定量盐酸,可继续浸取含铅废料。重复操作的结果如下:
| 循环次数 | 0 | 1 | 2 | 3 | 4 |
| 铅回收率/% | 85.4 | 93.5 | 95.8 | 97.1 | 98.2 |
 纯度/% 纯度/% | 99.4 | 99.3 | 99.2 | 99.1 | 96.1 |
 纯度急剧降低,此时向母液中加入
纯度急剧降低,此时向母液中加入(3)脱氯
 在某浓度
在某浓度 溶液中的溶解度曲线如下图所示。
溶液中的溶解度曲线如下图所示。
(4)测定废料中铅的含量
将
 含铅废料与足量盐酸、
含铅废料与足量盐酸、 溶液充分反应,得到
溶液充分反应,得到 溶液。取
溶液。取 溶液加水稀释,再加几滴二甲酚橙作指示剂,用
溶液加水稀释,再加几滴二甲酚橙作指示剂,用 的乙二胺四乙酸二钠盐(用
的乙二胺四乙酸二钠盐(用 表示)进行滴定,滴定终点时消耗
表示)进行滴定,滴定终点时消耗 溶液
溶液 。计算废料中铅的质量分数
。计算废料中铅的质量分数资料:滴定原理为:

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】亚硝酞氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图I、II、III所示:

图中A导管的作用是___________ 为制备纯净干燥的气体,下表中缺少的药品是:
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→_____ (按气流自左向右方向,用小写字母表示)。
②装置IV、V除可进一步干燥NO、Cl2外,另一个作用是______ 。
③装置VII的作用是______________ 。
④装置VIII中吸收尾气时,NOCl发生反应的化学方程式为_________________ 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为________ 。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图I、II、III所示:

图中A导管的作用是
| 装置I | 装置II | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净Cl2 | ① | 浓盐酸 | ② |
| 制备纯净NO | Cu | 稀硝酸 | ③ |

①装置连接顺序为a→
②装置IV、V除可进一步干燥NO、Cl2外,另一个作用是
③装置VII的作用是
④装置VIII中吸收尾气时,NOCl发生反应的化学方程式为
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某工厂的工业废水中含有大量的 FeSO4、较多的 Cu2+和少量的 Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图完成回收硫酸亚铁和铜的简单实验方案,回答下列问题:(流程图中无需填写)
(1)操作②的名称为__________ ,所需要的玻璃仪器为________ 、___________ 、烧杯。
(2)试剂⑤的化学式为___________ ,所发生的化学方程式为__________ 。
(3) 对④和⑧的混合溶液,不选用蒸发(余热蒸干)获得FeSO4·7H2O,原因是_________ 、___________ 。(说出两点原因)

(1)操作②的名称为
(2)试剂⑤的化学式为
(3) 对④和⑧的混合溶液,不选用蒸发(余热蒸干)获得FeSO4·7H2O,原因是
您最近一年使用:0次



