根据要求回答下列有关问题。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ∆H=-28.5kJ/mol
2Fe(s)+3CO2(g) ∆H=-28.5kJ/mol
冶炼铁反应的平衡常数表达式K=____________ ,温度升高后,K 值________ (填“增大”、“不变”或“减小”)。
(2)已知:①Fe2O3(s)+3C(石墨)2Fe(s)+3CO(g) ∆H1=+489.0kJ/mol
②Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ∆H2=-28.5kJ/mol
2Fe(s)+3CO2(g) ∆H2=-28.5kJ/mol
③C(石墨)+ CO2(g)=2CO(g) ∆H3=akJ/mol
则a=__________ kJ/mol。
(3)在T℃时,反应Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。(已知
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。(已知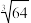 =4)
=4)
①平衡时CO 的转化率为___________ 。
②下列情况标志反应达到平衡状态正确的是________ (填字母)。
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
(4)一定条件下发生反应:N2(g)+ 3H2(g) 2NH3(g)∆H<0。
2NH3(g)∆H<0。
① 在某温度时,向容积固定的容器中加入1mol N2和3mol H2,达到平衡后:
a.若向容器中通入N2,则N2的转化率将___________ (填“增大”、“减小”或“不变”,下同)。
b.若再通入1mol N2和3mol H2,氮气的转化率将________ 。
②三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨气的体积分数随时间变化如图,下列说法正确的是___________ 。

a.图Ⅰ可能是不同温度对反应的影响,且T1>T2
b.图Ⅱ可能是同温同压下有无催化剂, 1表示没加入催化剂, 2表示加入了催化剂
c.图Ⅲ可能是不同压强对反应的影响,且p1>p2
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g) ∆H=-28.5kJ/mol
2Fe(s)+3CO2(g) ∆H=-28.5kJ/mol冶炼铁反应的平衡常数表达式K=
(2)已知:①Fe2O3(s)+3C(石墨)2Fe(s)+3CO(g) ∆H1=+489.0kJ/mol
②Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g) ∆H2=-28.5kJ/mol
2Fe(s)+3CO2(g) ∆H2=-28.5kJ/mol③C(石墨)+ CO2(g)=2CO(g) ∆H3=akJ/mol
则a=
(3)在T℃时,反应Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。(已知
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。(已知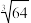 =4)
=4)| Fe2O3 | CO | Fe | CO2 | |
| 始态mol | 1.0 | 1.0 | 1.0 | 1.0 |
①平衡时CO 的转化率为
②下列情况标志反应达到平衡状态正确的是
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
(4)一定条件下发生反应:N2(g)+ 3H2(g)
 2NH3(g)∆H<0。
2NH3(g)∆H<0。① 在某温度时,向容积固定的容器中加入1mol N2和3mol H2,达到平衡后:
a.若向容器中通入N2,则N2的转化率将
b.若再通入1mol N2和3mol H2,氮气的转化率将
②三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨气的体积分数随时间变化如图,下列说法正确的是

a.图Ⅰ可能是不同温度对反应的影响,且T1>T2
b.图Ⅱ可能是同温同压下有无催化剂, 1表示没加入催化剂, 2表示加入了催化剂
c.图Ⅲ可能是不同压强对反应的影响,且p1>p2
更新时间:2017/02/17 15:03:27
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】X、Y、Z、W四种常见元素,其相关信息如表:
(1)写出下列元素的元素符号:Z:__ ;N:__ 。
(2)W位于周期表的第__ 周期,第__ 族,该元素的基态原子的简化电子排布式为__ ,价层电子的轨道表示式为__ 。
(3)用“>”或“<”填空。
(4)X2、碳和Z的氧化物在1300℃时可合成Z3X4。写出该反应化学方程式__ 。Z3X4是一种耐高温的结构陶瓷材料,是__ 化合物(填“共价”或“离子”)。
(5)查阅资料知道:
4Y(s)+3O2(g)=2Y2O3(s) △H=-3351.4 kJ/mol
3W(s)+2O2(g)=W3O4(s) △H=-1120 kJ/mol
则Y与W3O4反应的热化学方程式是:__ 。
| 元素 | 相关信息 |
| X | 空气含量最多的元素 |
| Y | 3p能级只有一个电子 |
| Z | 单质用于制造集成电路和太阳能板的主要原料 |
| W | 常见化合价有+2、+3,其中一种氧化物为红棕色 |
| N | 原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能低于同周期相邻元素 |
(2)W位于周期表的第
(3)用“>”或“<”填空。
| 离子半径 | 电负性 | 第一电离能 | 单质熔点 |
| X | Z | X | X |
(5)查阅资料知道:
4Y(s)+3O2(g)=2Y2O3(s) △H=-3351.4 kJ/mol
3W(s)+2O2(g)=W3O4(s) △H=-1120 kJ/mol
则Y与W3O4反应的热化学方程式是:
您最近一年使用:0次
【推荐2】由某精矿石(MCO3·ZCO3)可以制备单质M,制备过程中排放出的二氧化碳可以作为原料制备甲醇,取该矿石样品1.84g,高温灼烧至恒重,得到0.96g仅含两种金属氧化物的固体,其中m(M)︰m(Z)=3:5,请回答:
(1)该矿石的化学式为_______ 。
(2)①以该矿石灼烧后的固体产物为原料,真空高温条件下用单质硅还原,仅得到单质M和一种含氧酸盐(只含Z、Si和O元素,且Z和Si的物质的量之比为2︰1)。写出该反应的化学方程式_______ 。
②单质M还可以通过电解熔融MCl2得到,不能用电解MCl2溶液的方法制备M的理由是_______ 。
(3)一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g) CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1
反应2:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
反应3:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
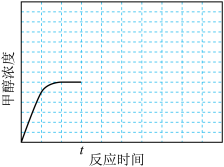
其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图所示。

则△H3_______ △H2 (填“大于”、“小于”、“等于”),理由是_______ 。
(4)在温度T1时,使体积比为3︰1的H2和CO2在体积恒定的密闭容器内进行反应。T1温度下甲醇浓度随时间变化曲线如图所示;不改变其他条件,假定t时刻迅速降温到T2,一段时间后体系重新达到平衡。试在图中画出t时刻后甲醇浓度随时间变化至平衡的示意曲线。_______
(1)该矿石的化学式为
(2)①以该矿石灼烧后的固体产物为原料,真空高温条件下用单质硅还原,仅得到单质M和一种含氧酸盐(只含Z、Si和O元素,且Z和Si的物质的量之比为2︰1)。写出该反应的化学方程式
②单质M还可以通过电解熔融MCl2得到,不能用电解MCl2溶液的方法制备M的理由是
(3)一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g)
 CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1反应2:CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2反应3:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图所示。

则△H3
(4)在温度T1时,使体积比为3︰1的H2和CO2在体积恒定的密闭容器内进行反应。T1温度下甲醇浓度随时间变化曲线如图所示;不改变其他条件,假定t时刻迅速降温到T2,一段时间后体系重新达到平衡。试在图中画出t时刻后甲醇浓度随时间变化至平衡的示意曲线。

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】甲醇是重要的有机化工原料,目前世界甲醇年产量超过2.1×107吨,在能源紧张的今天,甲醇的需求也在增大。
甲醇的合成方法是:(ⅰ)CO(g)+2H2(g) CH3OH(g) ΔH=-90.1kJ·mol-1
CH3OH(g) ΔH=-90.1kJ·mol-1
另外:(ⅱ)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
(ⅲ)2H2(g)+O2(g)=2H2O(l) ΔH=-572.0kJ·mol-1
若混合气体中有二氧化碳存在时,还发生下列反应:
(ⅳ)CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH=+41.1kJ·mol-1
(1)甲醇的燃烧热为____ kJ·mol-1。
(2)在碱性条件下利用一氯甲烷(CH3Cl)水解也可制备少量的甲醇,该反应的化学方程式为___ 。
(3)若反应在密闭恒容绝热容器中进行,反应(ⅳ)对合成甲醇反应中CO的转化率的影响是___ 。
a.增大 b.减小 c.无影响 d.无法判断
(4)在恒温恒容的密闭容器中发生反应(ⅰ),各物质的浓度如表:
①x=___ 。
②该温度下,反应(ⅰ)的平衡常数K=___ 。
③反应进行到第2min时,改变了反应条件,改变的这个条件可能是___ (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
(5)如图是温度、压强与反应(ⅰ)中CO转化率的关系:

①由图像可知,较低温度时,CO转化率对___ (选填“温度”或“压强”)敏感。
②由图像可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400℃和10MPa的条件,其原因是___ 。
(6)在一容积为2L的密闭容器内加入2mol的CO和6mol的H2,在一定条件下发生反应(ⅰ)。该反应的逆反应速率与时间的关系如图所示:

①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是___ 。
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线___ 。
甲醇的合成方法是:(ⅰ)CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.1kJ·mol-1
CH3OH(g) ΔH=-90.1kJ·mol-1另外:(ⅱ)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
(ⅲ)2H2(g)+O2(g)=2H2O(l) ΔH=-572.0kJ·mol-1
若混合气体中有二氧化碳存在时,还发生下列反应:
(ⅳ)CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH=+41.1kJ·mol-1(1)甲醇的燃烧热为
(2)在碱性条件下利用一氯甲烷(CH3Cl)水解也可制备少量的甲醇,该反应的化学方程式为
(3)若反应在密闭恒容绝热容器中进行,反应(ⅳ)对合成甲醇反应中CO的转化率的影响是
a.增大 b.减小 c.无影响 d.无法判断
(4)在恒温恒容的密闭容器中发生反应(ⅰ),各物质的浓度如表:
| 时间/min 浓度/mol·L-1 | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | x | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
①x=
②该温度下,反应(ⅰ)的平衡常数K=
③反应进行到第2min时,改变了反应条件,改变的这个条件可能是
a.使用催化剂 b.降低温度 c.增加H2的浓度
(5)如图是温度、压强与反应(ⅰ)中CO转化率的关系:

①由图像可知,较低温度时,CO转化率对
②由图像可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400℃和10MPa的条件,其原因是
(6)在一容积为2L的密闭容器内加入2mol的CO和6mol的H2,在一定条件下发生反应(ⅰ)。该反应的逆反应速率与时间的关系如图所示:

①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
①一定条件下,将体积比为1:2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_________ (填字母)。
A.体系压强保持不变 B.混合气体颜色保持不变
C. N2和CO2的体积比保持不变 D. v正(CO)=2v逆(N2)
②20min时,若改变反应条件,导致N2浓度发生如下图1所示的变化,则改变的条件可能是_____ (填字母)。
A.加入催化剂 B.降低温度 C.增加CO2量 D.缩小容器体积
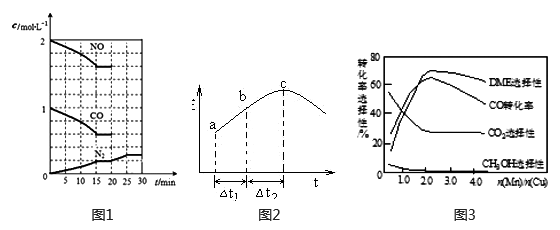
(2)在一定条件下,将SO2和NO2通入绝热恒容密闭容器中,发生反应:SO2(g)+NO2(g) SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是
SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是_____________ (填字母)。
A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2 时,SO2的转化率:a~b段小于b~c段
(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2可制备二甲醚(DME)。观察图3回答问题。催化剂中n(Mn)/n(Cu)约为__________ 时最有利于二甲醚的合成。
(4)工业上可以用CO和H2生产燃料甲醇:CO(g)+2H2(g) CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
下列说法中正确的是______
A.2c1>c3 B. a+b=92.9 C.2p23 D.a1+a3<1
(1)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0①一定条件下,将体积比为1:2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变 B.混合气体颜色保持不变
C. N2和CO2的体积比保持不变 D. v正(CO)=2v逆(N2)
②20min时,若改变反应条件,导致N2浓度发生如下图1所示的变化,则改变的条件可能是
A.加入催化剂 B.降低温度 C.增加CO2量 D.缩小容器体积

(2)在一定条件下,将SO2和NO2通入绝热恒容密闭容器中,发生反应:SO2(g)+NO2(g)
 SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是
SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2 时,SO2的转化率:a~b段小于b~c段
(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2可制备二甲醚(DME)。观察图3回答问题。催化剂中n(Mn)/n(Cu)约为
(4)工业上可以用CO和H2生产燃料甲醇:CO(g)+2H2(g)
 CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2molH2 | lmolCH3OH | 2molCH3OH | |
| 平衡 时的 数据 | CH3OH/mol·L-1 | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ | |
| 体系压强/Pa | p1 | p2 | p3 | |
| 反应物转化率 | a1 | a2 | a3 | |
下列说法中正确的是
A.2c1>c3 B. a+b=92.9 C.2p23 D.a1+a3<1
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】为了减少温室气体排放,目前工业上采用CO2与H2在CuO-ZnO/ZrO催化下反应制备重要化工原料CH3OH的工艺:CO2(g)+3H2(g) CH3OH(g)+H2O(g);⊿H<0。为了探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
CH3OH(g)+H2O(g);⊿H<0。为了探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
根据题目回答下列问题:
(1)0~3 s内用H2表示的平均反应速率是__________ ,
(2)平衡时CO2的转化率是_______ 。
(3)能说明反应已达平衡状态的是_________________ 。
A.υ(H2)=3υ(CO2) B.容器内压强保持不变
C.υ逆(CO2)=υ正(CH3OH) D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是______________ 。(填序号)
A.及时分离出产物 B.适当升高温度
C.增大CO2浓度 D.选择适当的催化剂
 CH3OH(g)+H2O(g);⊿H<0。为了探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
CH3OH(g)+H2O(g);⊿H<0。为了探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
根据题目回答下列问题:
(1)0~3 s内用H2表示的平均反应速率是
(2)平衡时CO2的转化率是
(3)能说明反应已达平衡状态的是
A.υ(H2)=3υ(CO2) B.容器内压强保持不变
C.υ逆(CO2)=υ正(CH3OH) D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是
A.及时分离出产物 B.适当升高温度
C.增大CO2浓度 D.选择适当的催化剂
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
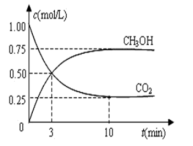
(1)若CO2的转化率为40%时,反应放出的热量为_______ kJ;
(2)判断该可逆反应达到化学平衡状态的标志是_______ (填字母)。
a.v生成(CH3OH)=v消耗(CO2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO2、H2、CH3OH、H2O的浓度均不再变化
(3)下列表示该反应速率最快的是_______ ;
a.v(H2)=2 mol·L-1·min-1
b.v(CO2)=4.5 mol·L-1·min-1
c.v(CH3OH)=3 mol·L-1·min-1
d.v(H2O)=0.2 mol·L-1·s-1
(4)该反应的平衡常数表达式为K=_______ 反应的平衡常数K数值为_______ 。(保留一位小数)

(1)若CO2的转化率为40%时,反应放出的热量为
(2)判断该可逆反应达到化学平衡状态的标志是
a.v生成(CH3OH)=v消耗(CO2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO2、H2、CH3OH、H2O的浓度均不再变化
(3)下列表示该反应速率最快的是
a.v(H2)=2 mol·L-1·min-1
b.v(CO2)=4.5 mol·L-1·min-1
c.v(CH3OH)=3 mol·L-1·min-1
d.v(H2O)=0.2 mol·L-1·s-1
(4)该反应的平衡常数表达式为K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O +H2O
+H2O 2HCrO
2HCrO
 2CrO
2CrO +2H+
+2H+
(1)在强碱溶液中,铬元素的主要存在形式为___________ (填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O )/c(CrO
)/c(CrO )将
)将___________ (填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、 、Cl-四种离子,某同学推测该溶液中各离子浓度大小 顺序可能有如下四种关系:并按要求填写下列空白:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小 顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c( )>c(H+)>c(OH-) ②c(Cl-)>c(
)>c(H+)>c(OH-) ②c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c( )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)
(2)若溶液中只溶解了一种溶质,则该溶质是___________ ,上述四种离子浓度的大小顺序为___________ (选填序号)。
(3)若上述关系中③是正确的,则溶液中的溶质为___________ ;
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)___________ c(NH3·H2O) (填“大于”“小于”或“等于”)。
Ⅲ.用酸碱中和滴定法测定某市售白醋(含 ,是一元弱酸)的总酸量。实验步骤如下:
,是一元弱酸)的总酸量。实验步骤如下:
(5)①量取10.00mL市售白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得稀释白醋溶液。取该稀释白醋溶液20.00mL于锥形瓶中,向其中滴加几滴___________ 作指示剂。
②用0.1000mol/L NaOH溶液滴定,当___________ 时,停止滴定,并记录NaOH溶液的最终读数。重复滴定4次。
③实验记录如下:
按上述数处理,可得c(市售白醋)=___________ mol/L。
④在本实验的滴定过程中,下列操作会使实验结果偏高的是___________ (填字母)。
A.碱式滴定管在滴定时未用NaOH标准溶液润洗
B.锥形瓶在滴定时剧烈摇动,有少量液体测出
C.锥形瓶中加入待测稀释白醋溶液后,再加少量水
D.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
E.滴定终点读数时俯视
 +H2O
+H2O 2HCrO
2HCrO
 2CrO
2CrO +2H+
+2H+(1)在强碱溶液中,铬元素的主要存在形式为
 )/c(CrO
)/c(CrO )将
)将Ⅱ.已知某溶液中只存在OH-、H+、
 、Cl-四种离子,某同学推测该溶液中各离子浓度大小 顺序可能有如下四种关系:并按要求填写下列空白:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小 顺序可能有如下四种关系:并按要求填写下列空白:①c(Cl-)>c(
 )>c(H+)>c(OH-) ②c(Cl-)>c(
)>c(H+)>c(OH-) ②c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)③c(
 )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)(2)若溶液中只溶解了一种溶质,则该溶质是
(3)若上述关系中③是正确的,则溶液中的溶质为
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
Ⅲ.用酸碱中和滴定法测定某市售白醋(含
 ,是一元弱酸)的总酸量。实验步骤如下:
,是一元弱酸)的总酸量。实验步骤如下:(5)①量取10.00mL市售白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得稀释白醋溶液。取该稀释白醋溶液20.00mL于锥形瓶中,向其中滴加几滴
②用0.1000mol/L NaOH溶液滴定,当
③实验记录如下:
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(稀释白醋)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
 (NaOH)/mL (NaOH)/mL | 15.00 | 15.04 | 14.96 | 16.52 |
④在本实验的滴定过程中,下列操作会使实验结果偏高的是
A.碱式滴定管在滴定时未用NaOH标准溶液润洗
B.锥形瓶在滴定时剧烈摇动,有少量液体测出
C.锥形瓶中加入待测稀释白醋溶液后,再加少量水
D.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
E.滴定终点读数时俯视
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,
I.在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)测得反应放出的热量_________ 92.4kJ.(填“小于”,“大于”或“等于”)
(2)当反应达到平衡时,N2和H2的浓度比是___________ ;N2和H2的转化率比是___________ 。
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________ 。(填“变大”、“变小”或“不变”)
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将___________ (填“正向”、“逆向”或“不”)移动。
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将____________ (填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________ (填“大于”、“小于”或“等于”)原来的2倍。
II.该反应N2(g)+3H2(g) 2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。

(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1_____________________ ,t3_____________________ ,t4_____________________ 。
(2)下列时间段中,氨的百分含量最高的是(_______ )
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,I.在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)测得反应放出的热量
(2)当反应达到平衡时,N2和H2的浓度比是
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将
II.该反应N2(g)+3H2(g)
 2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1
(2)下列时间段中,氨的百分含量最高的是(
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g) CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
③ CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
回答下列问题:
(1)反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) △H=
CH3OCH3(g)+CO2(g) △H=____ kJ·mol-1。下列措施中,能提高CH3OCH3产率的有____ 。
A.使用合适的催化剂 B.升高温度 C.增大压强
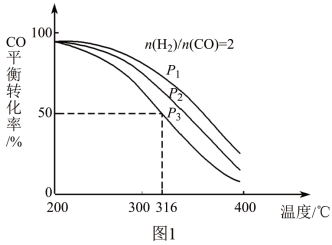
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____ 。

(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为____ 时最有利于二甲醚的合成。
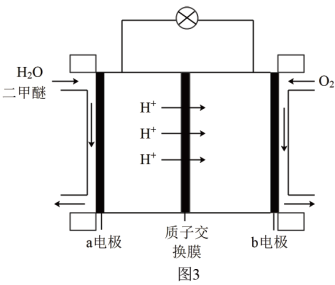
(4)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,b电极的电极反应式为____ 。
(5)甲醇液相脱水法制二甲醚的原理是:
CH3OH +H2SO4 → CH3HSO4+H2O,
CH3 HSO4+CH3OH → CH3OCH3+H2SO4。
与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是____ 。
① CO(g)+2H2(g)
 CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1② 2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1③ CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1回答下列问题:
(1)反应3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g) △H=
CH3OCH3(g)+CO2(g) △H=A.使用合适的催化剂 B.升高温度 C.增大压强
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是| A.△H < 0 |
| B.P1<P2<P3 |
| C.若在P3和316℃时,起始n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50% |



(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为
(4)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,b电极的电极反应式为
(5)甲醇液相脱水法制二甲醚的原理是:
CH3OH +H2SO4 → CH3HSO4+H2O,
CH3 HSO4+CH3OH → CH3OCH3+H2SO4。
与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是
您最近一年使用:0次
【推荐1】请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g) CO(g)+H2O(g),平衡常数 K与温度t℃的关系如下表:
CO(g)+H2O(g),平衡常数 K与温度t℃的关系如下表:
①该反应的化学平衡常数表达式为________________________ 。
②该反应为反应___________ (填“吸热”或“放热”)。
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度
为___________ ℃。
(2)工业上一般以CO和H2为原料合成甲醇,一定温度下在恒容容器中,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g)△H1=-116kJ·mol-1
CH3OH(g)△H1=-116kJ·mol-1
①下列措施中能说明反应达到平衡状态的是___________ 。
A.体系压强保持不变
B.混合气体的密度保持不变
C.CO与H2的浓度之比为1∶2
D.单位时间内,消耗2mol H2的同时消耗1mol CH3OH
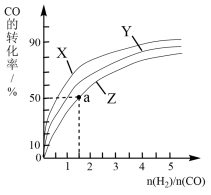
②在恒容容器中合成甲醇,当温度分别为230℃、250℃和270℃时,CO的转化率与n(H2)/n(CO)的起始组成比的关系如图所示。已知容器体积1L,起始时CO的物质的量均为1mol。据此判断在上述三种温度中,曲线Z对应的温度是___________ ;利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K等于 ___________ 。
(1)在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g)
 CO(g)+H2O(g),平衡常数 K与温度t℃的关系如下表:
CO(g)+H2O(g),平衡常数 K与温度t℃的关系如下表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应的化学平衡常数表达式为
②该反应为反应
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度
为
(2)工业上一般以CO和H2为原料合成甲醇,一定温度下在恒容容器中,该反应的热化学方程式为:CO(g)+2H2(g)
 CH3OH(g)△H1=-116kJ·mol-1
CH3OH(g)△H1=-116kJ·mol-1①下列措施中能说明反应达到平衡状态的是
A.体系压强保持不变
B.混合气体的密度保持不变
C.CO与H2的浓度之比为1∶2
D.单位时间内,消耗2mol H2的同时消耗1mol CH3OH
②在恒容容器中合成甲醇,当温度分别为230℃、250℃和270℃时,CO的转化率与n(H2)/n(CO)的起始组成比的关系如图所示。已知容器体积1L,起始时CO的物质的量均为1mol。据此判断在上述三种温度中,曲线Z对应的温度是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】研究氮氧化物的反应机理,对于消除其对环境的污染有重要意义。升高温度,绝大多数的化学反应速率增大,但是2NO(g)+O2(g) 2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g)
2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
I.2NO(g) N2O2(g)(快) ΔH1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g)(快) ΔH1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
Ⅱ.N2O2(g)+O2(g) 2NO2(g)(慢) ΔH2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g)(慢) ΔH2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
请回答下列问题:
(1)反应2NO(g)+O2(g) 2NO2(g)的ΔH =
2NO2(g)的ΔH =___________ (用含ΔH1和ΔH2的式子表示)
(2)一定温度下,恒容的密闭容器中,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=_________________ ,升高温度,K值___________ (填“增大”“减小”或“不变”)
(3)下列描述中能说明上述反应已达平衡的是__________ ;
A.容器内气体的平均摩尔质量保持不变
B.2v(NO)正=v(O2)逆
C.容器中气体的密度保持不变
D.单位时间内生成nmolO2的同时生成2nmolNO2
 2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g)
2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:I.2NO(g)
 N2O2(g)(快) ΔH1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g)(快) ΔH1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)Ⅱ.N2O2(g)+O2(g)
 2NO2(g)(慢) ΔH2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g)(慢) ΔH2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)请回答下列问题:
(1)反应2NO(g)+O2(g)
 2NO2(g)的ΔH =
2NO2(g)的ΔH =(2)一定温度下,恒容的密闭容器中,反应2NO(g)+O2(g)
 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=(3)下列描述中能说明上述反应已达平衡的是
A.容器内气体的平均摩尔质量保持不变
B.2v(NO)正=v(O2)逆
C.容器中气体的密度保持不变
D.单位时间内生成nmolO2的同时生成2nmolNO2
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ.铁及铁的氧化物广泛应于生产、生活、航天、科研领域。
(1)铁的氧化物循环分解水制H2
已知:H2O(l)=H2(g)+1/2 O2(g) ΔH1=a kJ•mol-1
6FeO(s)+O2(g)=2Fe3O4(s) ΔH2=b kJ•mol-1
则:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH3=_______
(2)Fe2O3与CH4反应可制备“纳米级”金属铁。已知,恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+Fe2O3(s)⇌2Fe(s)+6H2(g)+3CO(g)
①此反应的化学平衡常数表达式为_______
②下列条件能判断该反应达到平衡状态的是_______
a.消耗1molFe2O3的同时,消耗3molCO
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2)
Ⅱ.用CH4还原NO2的反应为CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),向两个容积均为2L温度分别为T1、T2的恒温恒容密闭容器中分别加入1mol CH4和2mol NO2,测得各容器中n(NO2)随反应时间t的变化如图所示:
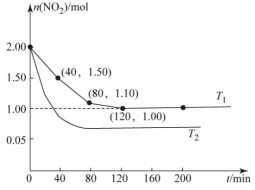
①T1_______ T2(填“>”或“<”)。
②T1时,40~80 min内,用N2的浓度变化表示的平均反应速率为v(N2)=_______
③T1下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡_______ 移动(填“正向”“逆向”或“不”)。
Ⅲ.CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使其转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO =CaCO3+SO
=CaCO3+SO ,室温下,该反应的化学平衡常数为
,室温下,该反应的化学平衡常数为_______ (室温下,Ksp(CaCO3)=3×10-9,Ksp(CaSO4)=9×10-6)。
(1)铁的氧化物循环分解水制H2
已知:H2O(l)=H2(g)+1/2 O2(g) ΔH1=a kJ•mol-1
6FeO(s)+O2(g)=2Fe3O4(s) ΔH2=b kJ•mol-1
则:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH3=
(2)Fe2O3与CH4反应可制备“纳米级”金属铁。已知,恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+Fe2O3(s)⇌2Fe(s)+6H2(g)+3CO(g)
①此反应的化学平衡常数表达式为
②下列条件能判断该反应达到平衡状态的是
a.消耗1molFe2O3的同时,消耗3molCO
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2)
Ⅱ.用CH4还原NO2的反应为CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),向两个容积均为2L温度分别为T1、T2的恒温恒容密闭容器中分别加入1mol CH4和2mol NO2,测得各容器中n(NO2)随反应时间t的变化如图所示:

①T1
②T1时,40~80 min内,用N2的浓度变化表示的平均反应速率为v(N2)=
③T1下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡
Ⅲ.CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使其转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO
 =CaCO3+SO
=CaCO3+SO ,室温下,该反应的化学平衡常数为
,室温下,该反应的化学平衡常数为
您最近一年使用:0次



