常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是( )
| A.浓度均为0.1 mol·L-1的HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者小于后者 |
| B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,前者消耗NaOH溶液的体积更多 |
| C.0.2 mol·L-1 HCOOH 与 0.1 mol·L-1 NaOH 等体积混合后的溶液中: c(HCOO-) + 2c(OH-) = c(HCOOH) + 2c(H+) |
| D.0.10 mol·L-1CH3COONa溶液中通入HCl至溶液呈中性:c(Na+) =c(Cl-) >c(CH3COOH) |
更新时间:2018-06-03 05:46:46
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】25℃时,改变醋酸溶液的pH[溶液中c(CH3COOˉ)与c(CH3COOH)之和始终为0.1mol·Lˉ1],溶液中H+、OHˉ、CH3COOˉ及CH3COOH浓度的对数值(lgc)与pH关系如图所示。

下列说法错误的是

下列说法错误的是
| A.lgK(CH3COOH)=-9.26 |
| B.图中①表示 CH3COOH浓度的对数值与pH的关系曲线 |
| C.0.1mol·Lˉ1CH3COOH溶液的pH约为2.88 |
| D.0.1mol·Lˉ1CH3 COONa溶液的pH约为8.87 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】25℃时,不同酸性条件下的0.1mol•L-1HF溶液中,c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是
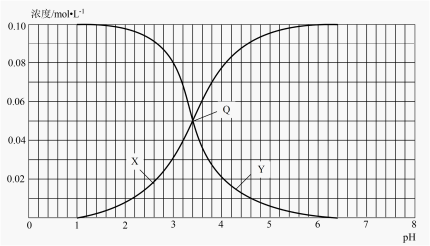

| A.随着溶液pH增大,c(H+)·c(HF)不断增大 |
| B.由水电离出的c(H+):Q>X=Y |
| C.HF的电离常数Ka=1.0×10-3.2 |
| D.0.1mol/LNaF溶液的pH约为8.2 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
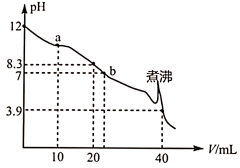
【推荐1】25℃,向
 的
的 溶液中滴加
溶液中滴加 的盐酸,溶液pH随盐酸体积(V)的变化如图所示。下列说法
的盐酸,溶液pH随盐酸体积(V)的变化如图所示。下列说法不正确 的是

 的
的 溶液中滴加
溶液中滴加 的盐酸,溶液pH随盐酸体积(V)的变化如图所示。下列说法
的盐酸,溶液pH随盐酸体积(V)的变化如图所示。下列说法
A.在a点的溶液中,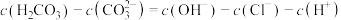 |
B.在b点的溶液中,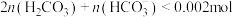 |
C.煮沸可能造成溶液中的 分解,但不影响滴定结果 分解,但不影响滴定结果 |
D.若将盐酸换成同浓度 ,当滴至 ,当滴至 时, 时,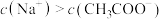 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】25℃时,下列溶液的微粒浓度关系正确的是( )
| A.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+c(H2C2O4) |
| B.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) |
| C.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
| D.(NH4)2SO4溶液和NaOH溶液混合所得的中性溶液中:c(Na+)=c(NH3• H2O) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),向20mL0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,根据图示判断,下列说法正确的是( )
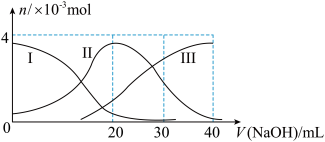

A.H2A在水中的电离方程式是:H2A=H++HA-;HA- H++A2- H++A2- |
| B.当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为:c(OH-) >c(H+) |
| C.当V(NaOH)=40 mL时,溶液中水的电离程度比纯水大 |
| D.当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】25℃时,下列说法不正确的是
A.0. 2mol/L NH4HCO3溶液(pH>7): c( )>c( )>c( )>c(H2CO3)>c(NH3·H2O) )>c(H2CO3)>c(NH3·H2O) |
| B.20. 0mL 0. 2mol/L HA溶液中加入10. 0mL 0. 2mol/L KOH溶液后pH=5,则Ka>10-5 |
| C.向0.10mol·L-1 CH3COONa溶液中通HCl至溶液pH=7 (通入气体对溶液体积的影响可忽略): c(Na+) >c( CH3COOH)=c(Cl-) |
D.亚硫酸的电离平衡常数为Ka1 =1.4 ×10-2, Ka2=6.0 ×10-8,向稀KOH溶液中通入SO2至溶液呈中性:c(K+ )>c( )>c( )>c( )>c(OH-) )>c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积的n倍。稀释过程中,两溶液pH的变化如图所示。下列叙述正确的是
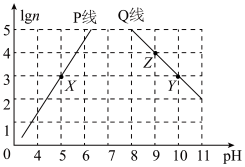
| A.P线代表HA的稀释图像且HA为强酸 |
| B.水的电离程度:Z>Y=X |
C.将X点溶液与Y点溶液混合至中性时, |
D.将X点溶液与Z点溶液等体积混合,所得溶液中一定有: |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】室温下,下列有关结论正确的是( )
| A.向稀醋酸中加水稀释使电离程度增大,溶液pH减小 |
B.将CH3COONa溶液从20℃升温至30℃,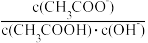 溶液中增大 溶液中增大 |
C.向0.1mol·L-1的NaHSO3溶液中加入氨水至中性,则c(Na+)+c(NH )=2c(SO )=2c(SO )+c(HSO )+c(HSO ) ) |
| D.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH<7,则H2A是强酸 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】下列有关电解质溶液的说法正确的是
| A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小 |
| B.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中c(CH3COO-)/c(CH3COOH)∙c(OH-)增大 |
C.向盐酸中加入氨水至中性,溶液中 >1 >1 |
| D.常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】类比pH,对于稀溶液pM=-lgc(M)(M:H2A、HA-、A2-),pKa=-lgKa,室温下,向某浓度H2A溶液加入NaOH(s),保持溶液体积和温度不变,测得pH与p(H2A)、p(HA-)、p(A2-)变化如图所示。下列说法不正确的是

| A.a点c(A2-)等于b点c(H2A) |
| B.常温下,pKa1=0.80 |
| C.b点时,c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
| D.pH=6.00时,c(A2-)>c(HA-)>c(H2A) |
您最近一年使用:0次



 ]以及pH随V(NaOH溶液)变化的关系如图所示。下列叙述错误的是
]以及pH随V(NaOH溶液)变化的关系如图所示。下列叙述错误的是


