含氮化合物与生产、生活、生命和环境息息相关。
(1)NO加速臭氧层被破坏,其反应过程如图所示。
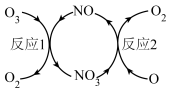
①NO的作用是________________________ 。
②已知:O3(g)+O(g) =2O2(g) △H=-143kJ·mol-1
反应l:O3(g)+NO(g) =NO2(g)+O2(g)△H1=-200.2kJ·mol-1
则反应2的热化学方程式为____________________________ 。
(2)肌红蛋白(Mb)是肌肉内储存氧的蛋白质,构成肌红蛋白的甘氨酸(H2NCH2COOH)是一种两性物质,在溶液中以三种离子形式存在,其转化关系如下 三种离子的物质的量分数(δ)与[
三种离子的物质的量分数(δ)与[ ]的关系如图所示。
]的关系如图所示。

①溶液呈中性时,三种离子浓度由大到小的顺序为______________________ 。
②向AG=12的溶液中加入过量NaOH溶液时,主要反应的离子方程式为______________ 。
(3)肌红蛋白(Mb)可与O2结合生成MbO2: 。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的物质的量分数]
①计算37℃时,上述反应的平衡常数K=__________ kPa-1(气体和溶液中的溶质分别用分压和物质的量浓度表示)。
②37℃时,若空气中氧气分压为21.0 kPa,则人正常呼吸时α的最大值为________ %(保留1位小数)。
③温度不变时,游客在山顶时体内MbO2的浓度比在山下________ (填“高”或“低”)。
④研究发现,v正=k正·c(Mb)·p(O2),v逆=k逆·c(MbO2)。已知37℃时k逆=60 s-1,则k正=______________ (注明速率常数单位)。
(1)NO加速臭氧层被破坏,其反应过程如图所示。

①NO的作用是
②已知:O3(g)+O(g) =2O2(g) △H=-143kJ·mol-1
反应l:O3(g)+NO(g) =NO2(g)+O2(g)△H1=-200.2kJ·mol-1
则反应2的热化学方程式为
(2)肌红蛋白(Mb)是肌肉内储存氧的蛋白质,构成肌红蛋白的甘氨酸(H2NCH2COOH)是一种两性物质,在溶液中以三种离子形式存在,其转化关系如下
 三种离子的物质的量分数(δ)与[
三种离子的物质的量分数(δ)与[ ]的关系如图所示。
]的关系如图所示。
①溶液呈中性时,三种离子浓度由大到小的顺序为
②向AG=12的溶液中加入过量NaOH溶液时,主要反应的离子方程式为
(3)肌红蛋白(Mb)可与O2结合生成MbO2:
 。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的物质的量分数]
| p(O2)/kPa | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
| α(MbO2)% | 50.0 | 66.7 | 80.0 | 85.7 | 88.9 | 90.9 | 92.3 |
②37℃时,若空气中氧气分压为21.0 kPa,则人正常呼吸时α的最大值为
③温度不变时,游客在山顶时体内MbO2的浓度比在山下
④研究发现,v正=k正·c(Mb)·p(O2),v逆=k逆·c(MbO2)。已知37℃时k逆=60 s-1,则k正=
更新时间:2019-05-17 15:05:04
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】“绿水青山就是金山银山”,研究并消除氮氧化物污染对建设美丽家乡,打造宜居环境有重娶意义。
(1)已知:
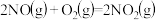
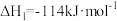

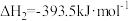
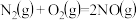
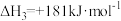
某反应的平衡常数表达式为 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式_______ 。
(2)目前可利用以下化学原理解决汽车尾气: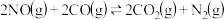 。一定条件下,在容积固定的容器中进行上述反应,CO浓度c(CO)与时间关系如图所示:
。一定条件下,在容积固定的容器中进行上述反应,CO浓度c(CO)与时间关系如图所示:
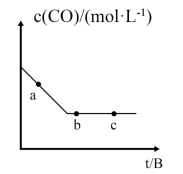
①a、b、c三点的正反应速率明v(a)、v(b)、v(c)的大小关系是_______ 。
②下列可说明反应到达图中c点的是_______ 。
A.NO、CO、 、
、 的浓度比值保持2:2:2:1不变
的浓度比值保持2:2:2:1不变
B.CO的浓度不再改变
C.反应消耗2mol NO的同时消耗1mol
D.容器中气体质量不发生变化
(3)用活性炭还原法处理氮氧化物的有关反应为: 。向某密闭容器中加入一定量的活性炭和NO,其反应速率与时间的关系如图所示,在
。向某密闭容器中加入一定量的活性炭和NO,其反应速率与时间的关系如图所示,在 时刻某条件发生改变。
时刻某条件发生改变。
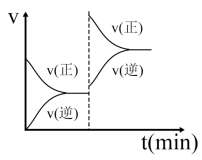
①由图可判断该反应为_______ (填“吸热”或“放热”)反应。
②一定温度下,随着NO的起始浓度增大,则NO的平衡转化率_______ (填“增大”、“不变”或“减小”)。
(4)T℃时,存在如下平衡: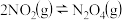 。该反应正逆反应速率与
。该反应正逆反应速率与 、
、 的度关系为:
的度关系为: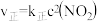 ,
, (
( 、
、 是速率常数),图中直线①表示
是速率常数),图中直线①表示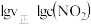 的关系,直线②表示
的关系,直线②表示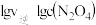 的关系。
的关系。
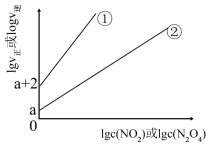
①T℃时该反应的平衡常数K=_______ 。
②T℃时,往刚性容器中充入一定量 ,平衡后测得c(
,平衡后测得c( )为1.0mol/L,则平衡后
)为1.0mol/L,则平衡后
_______ (用含a的表达式表示)。
(1)已知:
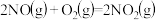
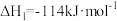

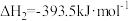
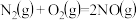
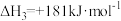
某反应的平衡常数表达式为
 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(2)目前可利用以下化学原理解决汽车尾气:
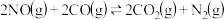 。一定条件下,在容积固定的容器中进行上述反应,CO浓度c(CO)与时间关系如图所示:
。一定条件下,在容积固定的容器中进行上述反应,CO浓度c(CO)与时间关系如图所示:
①a、b、c三点的正反应速率明v(a)、v(b)、v(c)的大小关系是
②下列可说明反应到达图中c点的是
A.NO、CO、
 、
、 的浓度比值保持2:2:2:1不变
的浓度比值保持2:2:2:1不变B.CO的浓度不再改变
C.反应消耗2mol NO的同时消耗1mol

D.容器中气体质量不发生变化
(3)用活性炭还原法处理氮氧化物的有关反应为:
 。向某密闭容器中加入一定量的活性炭和NO,其反应速率与时间的关系如图所示,在
。向某密闭容器中加入一定量的活性炭和NO,其反应速率与时间的关系如图所示,在 时刻某条件发生改变。
时刻某条件发生改变。
①由图可判断该反应为
②一定温度下,随着NO的起始浓度增大,则NO的平衡转化率
(4)T℃时,存在如下平衡:
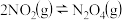 。该反应正逆反应速率与
。该反应正逆反应速率与 、
、 的度关系为:
的度关系为: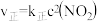 ,
, (
( 、
、 是速率常数),图中直线①表示
是速率常数),图中直线①表示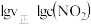 的关系,直线②表示
的关系,直线②表示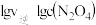 的关系。
的关系。
①T℃时该反应的平衡常数K=
②T℃时,往刚性容器中充入一定量
 ,平衡后测得c(
,平衡后测得c( )为1.0mol/L,则平衡后
)为1.0mol/L,则平衡后
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】氨是重要的化工原料,也是潜在的储氢材料。回答下列问题:
(1)氨的沸点为 ,易液化,工业上常用于做制冷剂,其易液化的主要原因是
,易液化,工业上常用于做制冷剂,其易液化的主要原因是___________ 。
(2)在液氨中制备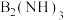 的有机反应如下:
的有机反应如下:
① ;
;
② ;
;
③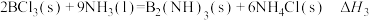 。
。
上述反应中, 、
、 、
、 之间等式关系为
之间等式关系为___________ 。
(3)氨分解制备氢气,反应历程如图所示。

① 的键能为
的键能为___________  。
。
②写出 分解总反应的热化学方程式:
分解总反应的热化学方程式:___________ 。
(4)化学上,把反应物消耗一半所用时间叫作“半衰期”。在恒容密闭容器中充入适量钨和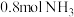 ,实验测得在钨表面氨气分解反应半衰期与温度(
,实验测得在钨表面氨气分解反应半衰期与温度( )、初始压强(
)、初始压强( )的关系如图所示。
)的关系如图所示。


___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 温度下,反应进行到
温度下,反应进行到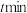 时容器内反应体系总压强为
时容器内反应体系总压强为___________  。
。
(5)一定温度下,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,合成氨气。
,合成氨气。 的平衡体积分数与投料比
的平衡体积分数与投料比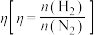 关系如图所示。
关系如图所示。
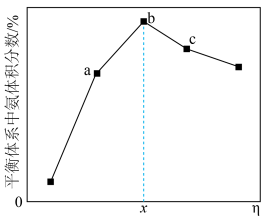
①在 、
、 、
、 点中,
点中, 的平衡转化率最大的是
的平衡转化率最大的是___________ (填字母)。
②若 点对应体系中,
点对应体系中, 体积分数为
体积分数为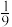 ,则该温度下,平衡常数
,则该温度下,平衡常数 为
为___________  (只列计算式)。
(只列计算式)。
(1)氨的沸点为
 ,易液化,工业上常用于做制冷剂,其易液化的主要原因是
,易液化,工业上常用于做制冷剂,其易液化的主要原因是(2)在液氨中制备
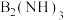 的有机反应如下:
的有机反应如下:①
 ;
;②
 ;
;③
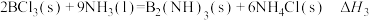 。
。上述反应中,
 、
、 、
、 之间等式关系为
之间等式关系为(3)氨分解制备氢气,反应历程如图所示。

①
 的键能为
的键能为 。
。②写出
 分解总反应的热化学方程式:
分解总反应的热化学方程式:(4)化学上,把反应物消耗一半所用时间叫作“半衰期”。在恒容密闭容器中充入适量钨和
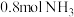 ,实验测得在钨表面氨气分解反应半衰期与温度(
,实验测得在钨表面氨气分解反应半衰期与温度( )、初始压强(
)、初始压强( )的关系如图所示。
)的关系如图所示。

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 温度下,反应进行到
温度下,反应进行到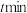 时容器内反应体系总压强为
时容器内反应体系总压强为 。
。(5)一定温度下,向
 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,合成氨气。
,合成氨气。 的平衡体积分数与投料比
的平衡体积分数与投料比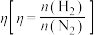 关系如图所示。
关系如图所示。
①在
 、
、 、
、 点中,
点中, 的平衡转化率最大的是
的平衡转化率最大的是②若
 点对应体系中,
点对应体系中, 体积分数为
体积分数为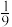 ,则该温度下,平衡常数
,则该温度下,平衡常数 为
为 (只列计算式)。
(只列计算式)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】二氧化硫是危害最为严重的大气污染物之一,它主要来自化石燃料的燃烧,研究CO催化还原SO2的适宜条件,在燃煤电厂的烟气脱硫中具有重要价值。
Ⅰ.从热力学角度研究反应
(1) C(s)+O2(g) CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s) 2CO(g) ΔH2=+172.5 kJ·mol-1
2CO(g) ΔH2=+172.5 kJ·mol-1
S(s)+O2(g) SO2(g) ΔH3=-296.0 kJ·mol-1
SO2(g) ΔH3=-296.0 kJ·mol-1
写出CO 还原SO2的热化学方程式:_________________ 。
(2)关于CO还原SO2的反应,下列说法正确的是______ 。
A.在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态
B.平衡状态时,2v正(CO)=v逆(SO2)
C.其他条件不变,增大SO2的浓度,CO的平衡转化率增大
D.在恒温恒压的容器中,向达到平衡状态的体系中充入N2,SO2的平衡转化率不变
Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g) N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol
反应b:2C(s)+2NO2(g) N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol
(3)对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
①0~10min内,NO的平均反应速率v(NO)=___________ ,当升高反应温度,该反应的平衡常数K___________ (选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________ (填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
(4)①某实验室模拟反应b,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因_____________ ;在1100kPa时,NO2的体积分数为___________ 。
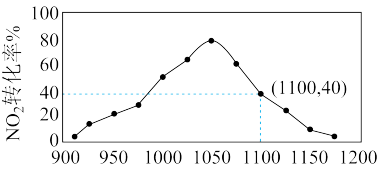
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=___________ (计算表达式表示);已知:气体分压(P分)=气体总压(P总)×体积分数。
Ⅰ.从热力学角度研究反应
(1) C(s)+O2(g)
 CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ΔH1=-393.5 kJ·mol-1CO2(g)+C(s)
 2CO(g) ΔH2=+172.5 kJ·mol-1
2CO(g) ΔH2=+172.5 kJ·mol-1S(s)+O2(g)
 SO2(g) ΔH3=-296.0 kJ·mol-1
SO2(g) ΔH3=-296.0 kJ·mol-1写出CO 还原SO2的热化学方程式:
(2)关于CO还原SO2的反应,下列说法正确的是
A.在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态
B.平衡状态时,2v正(CO)=v逆(SO2)
C.其他条件不变,增大SO2的浓度,CO的平衡转化率增大
D.在恒温恒压的容器中,向达到平衡状态的体系中充入N2,SO2的平衡转化率不变
Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)
 N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol反应b:2C(s)+2NO2(g)
 N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol(3)对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min内,NO的平均反应速率v(NO)=
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
(4)①某实验室模拟反应b,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因

②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】Ⅰ.在2L密闭容器内,t℃时发生反应: ,在体系中,
,在体系中, 随时间的变化如下表:
随时间的变化如下表:
(1)用 表示从0~2min内该反应的平均速率
表示从0~2min内该反应的平均速率
__________ ;
(2)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为__________ 。(用字母填空,下同);
a. b.
b.
c. d.
d.
(3)下列表述能作为反应达到化学平衡状态的标志是__________ 。
a.反应速率
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变
e.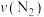 消耗
消耗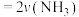 消耗
消耗
Ⅱ.
(4)在恒温条件下将一定量X和Y的混合气体通入容积为2L的密闭容器中,X和Y两物质的浓度随时间的变化情况如图所示。

①写出该反应的化学方程式(反应物或生成物用符号X、Y表示):______________________________ 。
②a、b、c、d四个点中,表示化学反应速率最小的点是__________ 。
(5)如图所示曲线是其他条件不变时,反应物的平衡转化率与温度的关系曲线。图中点1时刻,
__________  (填“大于”“小于”或“等于”,下同),且点3对应的K值
(填“大于”“小于”或“等于”,下同),且点3对应的K值__________ 点4对应的K值(K为该反应化学平衡常数)。

 ,在体系中,
,在体系中, 随时间的变化如下表:
随时间的变化如下表:时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)用
 表示从0~2min内该反应的平均速率
表示从0~2min内该反应的平均速率
(2)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为
a.
 b.
b.
c.
 d.
d.
(3)下列表述能作为反应达到化学平衡状态的标志是
a.反应速率

b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变
e.
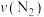 消耗
消耗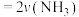 消耗
消耗Ⅱ.
(4)在恒温条件下将一定量X和Y的混合气体通入容积为2L的密闭容器中,X和Y两物质的浓度随时间的变化情况如图所示。

①写出该反应的化学方程式(反应物或生成物用符号X、Y表示):
②a、b、c、d四个点中,表示化学反应速率最小的点是
(5)如图所示曲线是其他条件不变时,反应物的平衡转化率与温度的关系曲线。图中点1时刻,

 (填“大于”“小于”或“等于”,下同),且点3对应的K值
(填“大于”“小于”或“等于”,下同),且点3对应的K值
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】甲醇是一种重要的可再生能源.
(1)已知2CH4(g)+O2(g)═2CO(g)+4H2(g) △H=akJ/mol
CO(g)+2H2(g)═CH3OH(g) △H=bkJ/mol
试写出由CH4和O2制取甲醇的热化学方程式:___ 。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g)⇌CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况.从反应开始到达平衡,用H2表示平均反应速率v(H2)=___ 。


(3)在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是___ 。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍数
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA___ PB(填“>、<、=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=___ L.
(1)已知2CH4(g)+O2(g)═2CO(g)+4H2(g) △H=akJ/mol
CO(g)+2H2(g)═CH3OH(g) △H=bkJ/mol
试写出由CH4和O2制取甲醇的热化学方程式:
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g)⇌CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况.从反应开始到达平衡,用H2表示平均反应速率v(H2)=


(3)在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是
A.H2的消耗速率等于CH3OH的生成速率的2倍数
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】将SO2转化为SO3是工业上生产硫酸的关键步骤,发生反应为: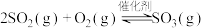
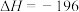 kJ⋅mol
kJ⋅mol ,某小组计划研究在相同温度下该反应的物质变化和能量变化,他们分别在恒温下的密闭容器中加入一定量的物质,获得如下数据:
,某小组计划研究在相同温度下该反应的物质变化和能量变化,他们分别在恒温下的密闭容器中加入一定量的物质,获得如下数据:
回答下列问题:
(1)若容器①的容积变为原来的2倍,则 的平衡转化率
的平衡转化率_______ (填“增大”“减小”或“不变”)。
(2)容器①②中均达到平衡时:
_______ (填“>”“<”或“=”,下同) ;放出热量
;放出热量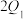
_______  。
。
(3) 与
与 在
在 作催化剂的条件下的反应历程如下:
作催化剂的条件下的反应历程如下:
① ;
;
②_______ (写出第2步反应的化学方程式);
 能加快反应速率的根本原因是
能加快反应速率的根本原因是_______ 。
(4)现向恒温恒容密闭容器中通入2 mol 和1 mol
和1 mol  ,反应
,反应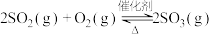 达到平衡后,再通入一定量
达到平衡后,再通入一定量 ,达到新平衡时,下列有关判断错误的是_______
,达到新平衡时,下列有关判断错误的是_______
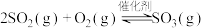
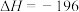 kJ⋅mol
kJ⋅mol ,某小组计划研究在相同温度下该反应的物质变化和能量变化,他们分别在恒温下的密闭容器中加入一定量的物质,获得如下数据:
,某小组计划研究在相同温度下该反应的物质变化和能量变化,他们分别在恒温下的密闭容器中加入一定量的物质,获得如下数据:| 容器编号 | 容器体积/L | 起始时各物质的物质的量/mol | 达到平衡的时间/min | 平衡时反应热量变化/kJ | ||
 |  |  | ||||
| ① | 1 | 0.050 | 0.030 |  |  | 放出热量: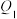 |
| ② | 1 | 0.100 | 0.060 |  |  | 放出热量: |
(1)若容器①的容积变为原来的2倍,则
 的平衡转化率
的平衡转化率(2)容器①②中均达到平衡时:

 ;放出热量
;放出热量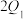
 。
。(3)
 与
与 在
在 作催化剂的条件下的反应历程如下:
作催化剂的条件下的反应历程如下:①
 ;
;②
 能加快反应速率的根本原因是
能加快反应速率的根本原因是(4)现向恒温恒容密闭容器中通入2 mol
 和1 mol
和1 mol  ,反应
,反应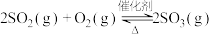 达到平衡后,再通入一定量
达到平衡后,再通入一定量 ,达到新平衡时,下列有关判断错误的是_______
,达到新平衡时,下列有关判断错误的是_______A. 的平衡浓度增大 的平衡浓度增大 | B.反应平衡常数增大 |
| C.正向反应速率增大 | D. 的转化总量增大 的转化总量增大 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】以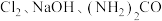 (尿素)和
(尿素)和 为原料可制备
为原料可制备 (水合肼)和无水
(水合肼)和无水 ,其主要实验流程如下:
,其主要实验流程如下:
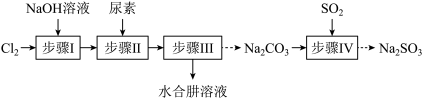
已知:①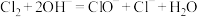 是放热反应。
是放热反应。
② 沸点约118℃,具有强还原性,高温易分解,能与
沸点约118℃,具有强还原性,高温易分解,能与 溶液剧烈反应。
溶液剧烈反应。
(1)步骤I制备 溶液时,若温度超过40℃,
溶液时,若温度超过40℃, 与
与 溶液反应生成
溶液反应生成 和
和 ,其离子方程式为
,其离子方程式为___________ ;实验中为防止温度过高,可采取的措施是___________ (任填一项)。
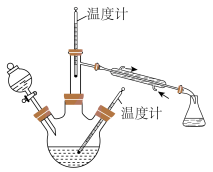
(2)步骤II合成 的装置如图所示。控制反应温度。将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集
的装置如图所示。控制反应温度。将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集 馏分。分液漏斗中的溶液是
馏分。分液漏斗中的溶液是___________ (填标号)。
A. 溶液 B.
溶液 B. 和
和 混合溶液
混合溶液
选择该项的理由是___________ 。蒸馏时需要减压,原因是___________ 。
(3)步骤IV用步骤III得到的副产品 制备无水
制备无水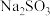 (水溶液中
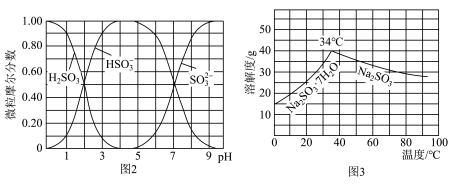
(水溶液中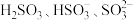 随
随 的分布如图2所示,
的分布如图2所示,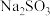 的溶解度曲线如图3所示)。
的溶解度曲线如图3所示)。
①边搅拌边向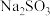 溶液中通入
溶液中通入 制备
制备 溶液。实验中确定停止通
溶液。实验中确定停止通 的操作为
的操作为___________ 。
②请补充完整由 溶液制备无水
溶液制备无水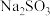 的实验方案:
的实验方案:___________ ,干燥,密封包装。
(实验中须使用的试剂: 、无水乙醇)
、无水乙醇)
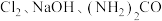 (尿素)和
(尿素)和 为原料可制备
为原料可制备 (水合肼)和无水
(水合肼)和无水 ,其主要实验流程如下:
,其主要实验流程如下:
已知:①
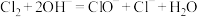 是放热反应。
是放热反应。②
 沸点约118℃,具有强还原性,高温易分解,能与
沸点约118℃,具有强还原性,高温易分解,能与 溶液剧烈反应。
溶液剧烈反应。(1)步骤I制备
 溶液时,若温度超过40℃,
溶液时,若温度超过40℃, 与
与 溶液反应生成
溶液反应生成 和
和 ,其离子方程式为
,其离子方程式为(2)步骤II合成
 的装置如图所示。控制反应温度。将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集
的装置如图所示。控制反应温度。将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集 馏分。分液漏斗中的溶液是
馏分。分液漏斗中的溶液是A.
 溶液 B.
溶液 B. 和
和 混合溶液
混合溶液选择该项的理由是

(3)步骤IV用步骤III得到的副产品
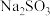 制备无水
制备无水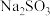 (水溶液中
(水溶液中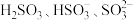 随
随 的分布如图2所示,
的分布如图2所示,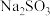 的溶解度曲线如图3所示)。
的溶解度曲线如图3所示)。
①边搅拌边向
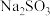 溶液中通入
溶液中通入 制备
制备 溶液。实验中确定停止通
溶液。实验中确定停止通 的操作为
的操作为②请补充完整由
 溶液制备无水
溶液制备无水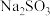 的实验方案:
的实验方案:(实验中须使用的试剂:
 、无水乙醇)
、无水乙醇)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】三氧化二镍 是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料
是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料 含有少量的铁、铝等杂质
含有少量的铁、铝等杂质 ,继而生产
,继而生产 的工艺流程如下:
的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的 开始沉淀的pH按金属离子浓度为
开始沉淀的pH按金属离子浓度为 计算
计算 。
。
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有______
A. 降低温度 搅拌
搅拌  减少盐酸的浓度
减少盐酸的浓度  将废料研成粉末
将废料研成粉末
(2)酸浸后的酸性溶液中加入 的目的:
的目的:__________ 。沉镍前需加 控制溶液pH范围为
控制溶液pH范围为______ ,所得到滤渣的主要成分是_______ 。
(3)从滤液A中可回收利用的主要物质是 和
和________ 。
(4)“氧化”生成 的离子方程式为
的离子方程式为__________________________ 。
(5)工业上用镍为阳极,电解 溶液与一定量
溶液与一定量 组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,
组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时, 的浓度对阴极电流效率及镍的成粉率的影响如图所示,则
的浓度对阴极电流效率及镍的成粉率的影响如图所示,则 的浓度最好控制为
的浓度最好控制为_________ 。

 是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料
是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料 含有少量的铁、铝等杂质
含有少量的铁、铝等杂质 ,继而生产
,继而生产 的工艺流程如下:
的工艺流程如下: 
下表列出了相关金属离子生成氢氧化物沉淀的
 开始沉淀的pH按金属离子浓度为
开始沉淀的pH按金属离子浓度为 计算
计算 。
。 | 氢氧化物 |  |  |  |  |
| 开始沉淀的pH | 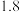 |  |  | 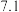 |
| 沉淀完全的pH |  |  | 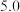 | 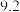 |
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有
A. 降低温度
 搅拌
搅拌  减少盐酸的浓度
减少盐酸的浓度  将废料研成粉末
将废料研成粉末 (2)酸浸后的酸性溶液中加入
 的目的:
的目的: 控制溶液pH范围为
控制溶液pH范围为(3)从滤液A中可回收利用的主要物质是
 和
和(4)“氧化”生成
 的离子方程式为
的离子方程式为(5)工业上用镍为阳极,电解
 溶液与一定量
溶液与一定量 组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,
组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时, 的浓度对阴极电流效率及镍的成粉率的影响如图所示,则
的浓度对阴极电流效率及镍的成粉率的影响如图所示,则 的浓度最好控制为
的浓度最好控制为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。回答下列问题:
(1)工业上利用CO2和H2反应合成甲醇。已知25℃ 101kPa下:
H2(g)+ O2(g)═H2O(g) △H=﹣242kJ•mol﹣1
O2(g)═H2O(g) △H=﹣242kJ•mol﹣1
CH3OH(g)+ O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJ•mol﹣1
O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJ•mol﹣1
①写出CO2和H2反应生成CH3OH(g)与H2O(g)的热化学方程式______
②下列表示该合成甲醇反应的能量变化示意图中正确的是______ (填字母)
a. b.
b.  c.
c.  d.
d. 
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)⇌H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L﹣1,c(H2O)=2mol•L﹣1,则达到平衡时H2O的转化率为______
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H=﹣90.1kJ•mol﹣1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质浓度(mol•L﹣1)变化如下表所示(前6min没有改变条件)
①x=______ ,250℃时该反应的平衡常数K=______
②若6~8min时只改变了一个条件,则改变的条件是______ ,第8min时,该反应是否达到平衡状态?______ (填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性;
Ⅱ.______
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL 0.1000mol•L﹣1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH______ (填“<”“>”或“=”)原因是______ (用离子方程式表示)
(1)工业上利用CO2和H2反应合成甲醇。已知25℃ 101kPa下:
H2(g)+
 O2(g)═H2O(g) △H=﹣242kJ•mol﹣1
O2(g)═H2O(g) △H=﹣242kJ•mol﹣1CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJ•mol﹣1
O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJ•mol﹣1①写出CO2和H2反应生成CH3OH(g)与H2O(g)的热化学方程式
②下列表示该合成甲醇反应的能量变化示意图中正确的是
a.
 b.
b.  c.
c.  d.
d. 
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)⇌H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L﹣1,c(H2O)=2mol•L﹣1,则达到平衡时H2O的转化率为
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H=﹣90.1kJ•mol﹣1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质浓度(mol•L﹣1)变化如下表所示(前6min没有改变条件)
| 2min | 4min | 6min | 8min | ||
| CO | 0.07 | 0.06 | 0.06 | 0.05 | …… |
| H2 | x | 0.12 | 0.12 | 0.2 | …… |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | …… |
②若6~8min时只改变了一个条件,则改变的条件是
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性;
Ⅱ.
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL 0.1000mol•L﹣1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】草酸 及其化合广泛分布于动植物体中。
及其化合广泛分布于动植物体中。
Ⅰ.某实验小组用灼烧检验法对菠菜中的铁元素(主要以难溶的 形式存在)进行检测。
形式存在)进行检测。
实验如下:
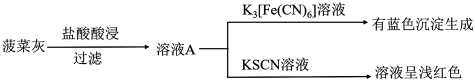
(1)灼烧菠菜时应将其放在___________ (填仪器名称)中加热。
(2)写出菠菜灰加盐酸酸浸时发生的主要离子方程式___________ 。
(3)甲同学取少量溶液A,滴加酸性 溶液,振荡后,溶液紫色消失,因此得出结论,溶液A含有
溶液,振荡后,溶液紫色消失,因此得出结论,溶液A含有 ,乙同学认为甲同学的实验方法不严谨,理由是
,乙同学认为甲同学的实验方法不严谨,理由是___________ 。
Ⅱ.草酸晶体的组成可表示为 。为测定草酸晶体中草酸的质量分数,进行下列实验。
。为测定草酸晶体中草酸的质量分数,进行下列实验。
①称取 草酸晶体,配成
草酸晶体,配成 溶液。
溶液。
②取 所配草酸溶液放入于锥形瓶中,加入适量稀
所配草酸溶液放入于锥形瓶中,加入适量稀 后,用浓度为
后,用浓度为 溶液滴定。请回答下列问题:
溶液滴定。请回答下列问题:
(4)本实验滴定过程中操作滴定管的图示正确的是___________ (填编号)。
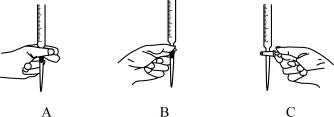
(5)判断达到滴定终点的现象是___________ 。
(6)若滴定时,滴定前后两次读数分别为 和
和 ,由此计算出草酸晶体中草酸的质量分数为
,由此计算出草酸晶体中草酸的质量分数为___________ 。若读取读数a时仰视,读取读数b时俯视,则所测得草酸的质量分数___________ (选填“偏大”、“偏小”或“不变”)。
Ⅲ.
(7)25℃时,用 溶液滴定
溶液滴定 溶液,溶液中
溶液,溶液中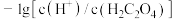 和
和 或
或 和
和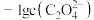 关系如图所示,下列说法正确的是________(填选项)。
关系如图所示,下列说法正确的是________(填选项)。

 及其化合广泛分布于动植物体中。
及其化合广泛分布于动植物体中。Ⅰ.某实验小组用灼烧检验法对菠菜中的铁元素(主要以难溶的
 形式存在)进行检测。
形式存在)进行检测。实验如下:

(1)灼烧菠菜时应将其放在
(2)写出菠菜灰加盐酸酸浸时发生的主要离子方程式
(3)甲同学取少量溶液A,滴加酸性
 溶液,振荡后,溶液紫色消失,因此得出结论,溶液A含有
溶液,振荡后,溶液紫色消失,因此得出结论,溶液A含有 ,乙同学认为甲同学的实验方法不严谨,理由是
,乙同学认为甲同学的实验方法不严谨,理由是Ⅱ.草酸晶体的组成可表示为
 。为测定草酸晶体中草酸的质量分数,进行下列实验。
。为测定草酸晶体中草酸的质量分数,进行下列实验。①称取
 草酸晶体,配成
草酸晶体,配成 溶液。
溶液。②取
 所配草酸溶液放入于锥形瓶中,加入适量稀
所配草酸溶液放入于锥形瓶中,加入适量稀 后,用浓度为
后,用浓度为 溶液滴定。请回答下列问题:
溶液滴定。请回答下列问题:(4)本实验滴定过程中操作滴定管的图示正确的是

(5)判断达到滴定终点的现象是
(6)若滴定时,滴定前后两次读数分别为
 和
和 ,由此计算出草酸晶体中草酸的质量分数为
,由此计算出草酸晶体中草酸的质量分数为Ⅲ.
(7)25℃时,用
 溶液滴定
溶液滴定 溶液,溶液中
溶液,溶液中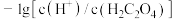 和
和 或
或 和
和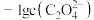 关系如图所示,下列说法正确的是________(填选项)。
关系如图所示,下列说法正确的是________(填选项)。
A.曲线L1表示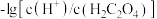 和 和 的关系 的关系 |
B. 的数量级为 的数量级为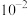 |
C. 溶液中 溶液中 |
D.向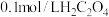 溶液中加入少量水,则 溶液中加入少量水,则 减小 减小 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钾是其常见的盐。请回答下列问题:
(1)0. 2 mol· L-1CH3COOK溶液中离子浓度由大到小的顺序为___________ 。
(2)物质的量浓度均为0.2 mol·L-1的CH3COOH和CH3COOK溶液等体积混合(混合前后忽略溶液体积变化),混合液中的下列关系式正确的是___________ (填字母)。
A. c(CH3COOH) +c(H+ )= c(CH3COO- ) +c(OH- )
B.c(H+)+c(K+ )=c(CH3COO- ) +c(OH- )
C.c(CH3COO- )+c(CH3COOH)=0.2 mol·L-1
(3)常温下0. 1 mol·L-1的CH3COOH溶液加水稀释的过程,下列表达式的数值一定变大的是______(填字母)。
(4)常温时,pH=3的醋酸溶液和pH=11的KOH溶液等体积混合后,溶液中c(K+)___________ c(CH3COO-)(填“>”“<”或“=”,下同)。
(5)常温时,将m mol· L-1的醋酸溶液和n mol·L-1的KOH溶液等体积混合后,所得溶液的pH=7,则m与n的大小关系是m___________ n。
(6)已知25° C时,三种酸的电离平衡常数如下:
下列四种离子结合H+能力最强的是___________ (填字 母)。
A. HCO B. CO
B. CO C. ClO- D. CH3COO-
C. ClO- D. CH3COO-
写出HClO+Na2CO3 (少量)反应离子方程式:___________ 。
(1)0. 2 mol· L-1CH3COOK溶液中离子浓度由大到小的顺序为
(2)物质的量浓度均为0.2 mol·L-1的CH3COOH和CH3COOK溶液等体积混合(混合前后忽略溶液体积变化),混合液中的下列关系式正确的是
A. c(CH3COOH) +c(H+ )= c(CH3COO- ) +c(OH- )
B.c(H+)+c(K+ )=c(CH3COO- ) +c(OH- )
C.c(CH3COO- )+c(CH3COOH)=0.2 mol·L-1
(3)常温下0. 1 mol·L-1的CH3COOH溶液加水稀释的过程,下列表达式的数值一定变大的是______(填字母)。
| A.c(H+ ) | B. |
| C.c(H+) · c(OH -) | D.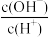 |
(5)常温时,将m mol· L-1的醋酸溶液和n mol·L-1的KOH溶液等体积混合后,所得溶液的pH=7,则m与n的大小关系是m
(6)已知25° C时,三种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| Ka1 | 1.8 ×10-5 | 4.3 ×10-7 | 3.0 ×10-8 |
| Ka2 | — | 5.6 ×10-11 | — |
A. HCO
 B. CO
B. CO C. ClO- D. CH3COO-
C. ClO- D. CH3COO-写出HClO+Na2CO3 (少量)反应离子方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
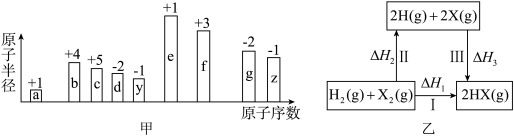
【推荐3】随原子序数的递增,九种短周期元素 用字母表示
用字母表示 原子半径的相对大小、最高正价或最低负价的变化如图所示.
原子半径的相对大小、最高正价或最低负价的变化如图所示.
请回答下列问题;
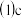 、d、e、f四种元素的简单离子中,半径最大的离子是
、d、e、f四种元素的简单离子中,半径最大的离子是 ______  填离子符号
填离子符号
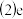 的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程式
的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程式 ______ 。
 含f元素的两种离子在溶液中不能大量共存的原因是
含f元素的两种离子在溶液中不能大量共存的原因是 ______  用离子方程式表示
用离子方程式表示
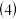 关于图乙所示转化关系
关于图乙所示转化关系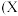 代表卤素
代表卤素 ,下列说法错误的是
,下列说法错误的是 ______ 。
A.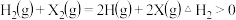
B.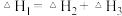
C.y、z的非金属性依次减弱,所以途径Ⅱ的热量按y、z的顺序依次增多
D.途径Ⅰ生成y的氢化物比生成z的氢化物更容易
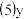 元素的某种含氧酸是一种新型氧化剂,应用性极强,通过反应:
元素的某种含氧酸是一种新型氧化剂,应用性极强,通过反应: 制得.该反应中水的作用与下列中水的作用相同的是
制得.该反应中水的作用与下列中水的作用相同的是 ______ 。
A.钠与水反应制氢气 过氧化钠与水反应制氧气
过氧化钠与水反应制氧气
C.氯气与水反应制次氯酸 氟单质与水反应制氧气
氟单质与水反应制氧气
 ,f的最高价氧化物的水化物的
,f的最高价氧化物的水化物的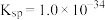 ,使含
,使含 的离子的溶液开始产生沉淀的pH为
的离子的溶液开始产生沉淀的pH为 ______ 。
 元素e和g组成的简单化合物B的水溶液中离子浓度由大到小的顺序为
元素e和g组成的简单化合物B的水溶液中离子浓度由大到小的顺序为 ______ 。
 用字母表示
用字母表示 原子半径的相对大小、最高正价或最低负价的变化如图所示.
原子半径的相对大小、最高正价或最低负价的变化如图所示. 
请回答下列问题;
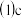 、d、e、f四种元素的简单离子中,半径最大的离子是
、d、e、f四种元素的简单离子中,半径最大的离子是  填离子符号
填离子符号
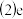 的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程式
的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程式  含f元素的两种离子在溶液中不能大量共存的原因是
含f元素的两种离子在溶液中不能大量共存的原因是  用离子方程式表示
用离子方程式表示
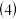 关于图乙所示转化关系
关于图乙所示转化关系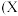 代表卤素
代表卤素 ,下列说法错误的是
,下列说法错误的是 A.
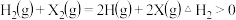
B.
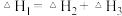
C.y、z的非金属性依次减弱,所以途径Ⅱ的热量按y、z的顺序依次增多
D.途径Ⅰ生成y的氢化物比生成z的氢化物更容易
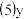 元素的某种含氧酸是一种新型氧化剂,应用性极强,通过反应:
元素的某种含氧酸是一种新型氧化剂,应用性极强,通过反应: 制得.该反应中水的作用与下列中水的作用相同的是
制得.该反应中水的作用与下列中水的作用相同的是 A.钠与水反应制氢气
 过氧化钠与水反应制氧气
过氧化钠与水反应制氧气 C.氯气与水反应制次氯酸
 氟单质与水反应制氧气
氟单质与水反应制氧气  ,f的最高价氧化物的水化物的
,f的最高价氧化物的水化物的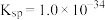 ,使含
,使含 的离子的溶液开始产生沉淀的pH为
的离子的溶液开始产生沉淀的pH为  元素e和g组成的简单化合物B的水溶液中离子浓度由大到小的顺序为
元素e和g组成的简单化合物B的水溶液中离子浓度由大到小的顺序为
您最近一年使用:0次



