习近平主席在《中央城镇化工作会议》发出号召:“让居民望得见山、看得见水、记得住乡愁”。消除含氮、硫、氯等化合物对大气和水体的污染对建设美丽家乡,打造宜居环境具有重要意义。
(1)以HCl为原料,用O2氧化制取Cl2,可提高效益,减少污染。反应为:4HCl(g)+O2(g)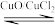 2Cl2(g)+2H2O(g) ∆H=−115.4kJ·mol−1,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。原理如图所示:
2Cl2(g)+2H2O(g) ∆H=−115.4kJ·mol−1,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。原理如图所示:

过程I的反应为:2HCl(g)+CuO(s) CuCl2(s)+H2O(g) ∆H1=−120.4kJ·mol−1,过程II反应的热化学方程式为
CuCl2(s)+H2O(g) ∆H1=−120.4kJ·mol−1,过程II反应的热化学方程式为___ 。
(2)容积均为1L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器。相同温度下,分别充入0.2mol的NO2,发生反应:2NO2(g) N2O4(g) ∆H<0,甲中NO2的相关量随时间变化如图所示。
N2O4(g) ∆H<0,甲中NO2的相关量随时间变化如图所示。
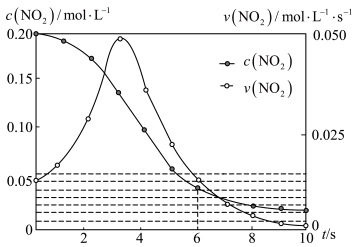
①0~3s内,甲容器中NO2的反应速率增大的原因是___ 。
②甲达平衡时,温度若为T℃,此温度下的平衡常数K=__ 。
③平衡时,K甲__ K乙,P甲__ P乙(填“>”、“<”或“=”)。
(3)水体中过量氨氮(以NH3表示)会导致水体富营养化。可用次氯酸钠除去氨氮,同时产生一种大气组成的气体。写出总反应化学方程式:__ 。
(4)工业上可用Na2SO3溶液吸收法处理SO2,25℃时用1mol·L-1的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为___ 。(已知25℃时:H2SO3的电离常数Ka1=1.3×10−2,Ka2=6.2×10−8)
(1)以HCl为原料,用O2氧化制取Cl2,可提高效益,减少污染。反应为:4HCl(g)+O2(g)
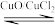 2Cl2(g)+2H2O(g) ∆H=−115.4kJ·mol−1,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。原理如图所示:
2Cl2(g)+2H2O(g) ∆H=−115.4kJ·mol−1,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。原理如图所示:
过程I的反应为:2HCl(g)+CuO(s)
 CuCl2(s)+H2O(g) ∆H1=−120.4kJ·mol−1,过程II反应的热化学方程式为
CuCl2(s)+H2O(g) ∆H1=−120.4kJ·mol−1,过程II反应的热化学方程式为(2)容积均为1L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器。相同温度下,分别充入0.2mol的NO2,发生反应:2NO2(g)
 N2O4(g) ∆H<0,甲中NO2的相关量随时间变化如图所示。
N2O4(g) ∆H<0,甲中NO2的相关量随时间变化如图所示。
①0~3s内,甲容器中NO2的反应速率增大的原因是
②甲达平衡时,温度若为T℃,此温度下的平衡常数K=
③平衡时,K甲
(3)水体中过量氨氮(以NH3表示)会导致水体富营养化。可用次氯酸钠除去氨氮,同时产生一种大气组成的气体。写出总反应化学方程式:
(4)工业上可用Na2SO3溶液吸收法处理SO2,25℃时用1mol·L-1的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为
更新时间:2019-12-27 20:34:10
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
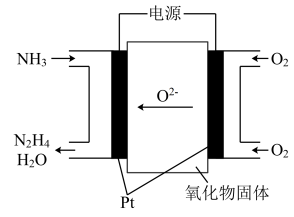
【推荐1】(1)工业上利用N2和H2合成NH3,NH3又可以进一步制备联氨(N2H4)等。由NH3制备N2H4的常用方法是NaClO氧化法,其离子反应方程式为______________________ ,有学者探究用电解法制备的效率,装置如图,试写出其阳极电极反应_________________________ ;
(2)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇(CH3CH2OH)的一种反应原理为:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g) △H=-akJ/mol,已知:CO(g)+H2O(g)
CH3CH2OH(g)+H2O(g) △H=-akJ/mol,已知:CO(g)+H2O(g) CO2(g)+H2(g) △H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇及水蒸气,并放出热量,写出该反应的热化学反应方程式:
CO2(g)+H2(g) △H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇及水蒸气,并放出热量,写出该反应的热化学反应方程式:_______________________________ 。
(3)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
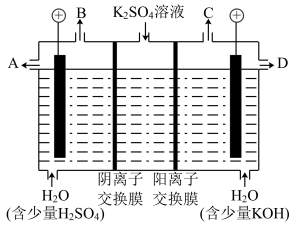
①该电解槽的阳极反应为_______________ 。此时通过阴离子交换膜的离子数_____ (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或“D”)_______ 导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因______________________ 。

(2)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇(CH3CH2OH)的一种反应原理为:2CO(g)+4H2(g)
 CH3CH2OH(g)+H2O(g) △H=-akJ/mol,已知:CO(g)+H2O(g)
CH3CH2OH(g)+H2O(g) △H=-akJ/mol,已知:CO(g)+H2O(g) CO2(g)+H2(g) △H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇及水蒸气,并放出热量,写出该反应的热化学反应方程式:
CO2(g)+H2(g) △H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇及水蒸气,并放出热量,写出该反应的热化学反应方程式:(3)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应为
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或“D”)
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因
您最近一年使用:0次
【推荐2】甲醇(CH3OH)是重要的有机化工原料,可用于制取氢气、甲酸甲酯(HCOOCH3)。(1) 在一定条件下用氧气催化氧化甲醇制氢气,原料气中n(O2)/n(CH3OH)对反应的选择性影响如图所示(选择性越大表示生成的该物质越多)。当n(O2)/n(CH3OH)=0.25 时,主要反应的化学方程式为____________ ,制备H2 时最好控制n(O2)/n(CH3OH)=___________ 。

(2)甲醇催化脱氢制甲酸甲酯的反应为:2CH3OH(g) HCOOCH3(g)+2H2(g) △H =a kJ·mol-1
HCOOCH3(g)+2H2(g) △H =a kJ·mol-1
①已知 :CO(g)+ l/2O2(g)=CO2(g) △H1 =-283kJ·mol-1
2CH3OH(g)+O2(g)=2CO2(g)+4 H2(g) △H2 =-386kJ·mol-1
2CO(g)+2 H2(g)=HCOOCH3(g ) △H3 =-134kJ·mol-1
a=_________________ 。
②在310℃下,将2mol 甲醇置于VL恒容密闭容器中,反应20 分钟后到达平衡,平衡时甲醇和氢气的分压相等。从开始到平衡时甲醇的平均反应速率为____ mol·L-1·min-1,若平衡时气体总压为P总=5×104Pa,Kp=_______ 。(已知: Kp是用平衡气体分压代替平衡浓度求得的平衡常数。气体分压=气体总压×气体的物质的量分数)。若在310℃下,将2mol 甲醇置于VL恒压密闭容器中,反应到达平衡时甲醇的分压______ 氢气的分压(填“>”,“=”或“<”)。
(3) 电解法可消除甲醇对水质造成的污染,原理是: 通电将Co2+ 氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如图所示装置模拟上述过程,请写出:
①阴极的电极反应式_______________________________________ 。
②除去甲醇的离子方程式为_________________________ 。


(2)甲醇催化脱氢制甲酸甲酯的反应为:2CH3OH(g)
 HCOOCH3(g)+2H2(g) △H =a kJ·mol-1
HCOOCH3(g)+2H2(g) △H =a kJ·mol-1 ①已知 :CO(g)+ l/2O2(g)=CO2(g) △H1 =-283kJ·mol-1
2CH3OH(g)+O2(g)=2CO2(g)+4 H2(g) △H2 =-386kJ·mol-1
2CO(g)+2 H2(g)=HCOOCH3(g ) △H3 =-134kJ·mol-1
a=
②在310℃下,将2mol 甲醇置于VL恒容密闭容器中,反应20 分钟后到达平衡,平衡时甲醇和氢气的分压相等。从开始到平衡时甲醇的平均反应速率为
(3) 电解法可消除甲醇对水质造成的污染,原理是: 通电将Co2+ 氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如图所示装置模拟上述过程,请写出:
①阴极的电极反应式
②除去甲醇的离子方程式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】党的十九大报告中多次提及“绿色环保”、“生态文明”,而 CO2 的有效利用可以缓解温室效应,解决能源短缺问题。
(1)CO2催化合成甲醇是一种回收利用CO2很有前景的方法。如图所示为该反应在无催化剂及有催化剂时的能量变化。

①由图可知,有催化剂存在的是过程_______ 。(填“I”或“II”)
②一定条件下,在恒容密闭容器中发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。
已知:2H2(g)+O2(g)=2H2O(l) ΔH1=-571.6 kJ·mol-1
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(1) ΔH2=-1523.4 kJ·mol-1
H2O(1)=H2O(g) ΔH3=+44 kJ·mol-1
则CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=_______ kJ·mol-1。
(2)回收利用的CO2还可用于制取甲醛,反应的化学方程式为CO2(g)+2H2(g)⇌CH2O(g)+H2O(g),实验室在2 L密闭容器中进行模拟上述合成CH2O的实验。T1℃时,将体积比为1:2的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
已知:vp(B)= ,则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为
,则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为_______ kPa∙min-1。
(3)近年来,有研究人员用 CO2 通过电催化生成多种燃料,实现CO2的回收利用,其工作原理如图所示。

①请写出Cu电极上产生HCOOH的电极反应式:_______ 。
②H+在电解池内部的移动方向为_______ (填“从左到右”或“从右到左”)。
③如果Cu 电极上只生成 0.15 mol C2H4和0.30 mol CH3OH,则 Pt 电极上产生O2的物质的量为_______ mol。
(1)CO2催化合成甲醇是一种回收利用CO2很有前景的方法。如图所示为该反应在无催化剂及有催化剂时的能量变化。

①由图可知,有催化剂存在的是过程
②一定条件下,在恒容密闭容器中发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。
已知:2H2(g)+O2(g)=2H2O(l) ΔH1=-571.6 kJ·mol-1
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(1) ΔH2=-1523.4 kJ·mol-1
H2O(1)=H2O(g) ΔH3=+44 kJ·mol-1
则CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=
(2)回收利用的CO2还可用于制取甲醛,反应的化学方程式为CO2(g)+2H2(g)⇌CH2O(g)+H2O(g),实验室在2 L密闭容器中进行模拟上述合成CH2O的实验。T1℃时,将体积比为1:2的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
已知:vp(B)=
 ,则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为
,则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为(3)近年来,有研究人员用 CO2 通过电催化生成多种燃料,实现CO2的回收利用,其工作原理如图所示。

①请写出Cu电极上产生HCOOH的电极反应式:
②H+在电解池内部的移动方向为
③如果Cu 电极上只生成 0.15 mol C2H4和0.30 mol CH3OH,则 Pt 电极上产生O2的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】“绿水青山就是金山银山”,研究消除氮氧化物污染对建设美丽家乡,打造宜居环境有重要意义。
(1)已知:
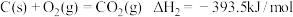

写出C与 反应生成
反应生成 的热化学方程式
的热化学方程式___________ 。
(2)已知: 。在
。在 恒容密闭容器中,投入
恒容密闭容器中,投入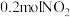 和
和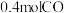 ,经过一段时间后达到平衡状态,测得
,经过一段时间后达到平衡状态,测得 的转化率为
的转化率为 。该温度下,反应的平衡常数为
。该温度下,反应的平衡常数为___________ 。
(3)原煤经热解、冷却得到的煤焦可用于 的脱除。热解温度为
的脱除。热解温度为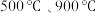 得到的煤焦分别用
得到的煤焦分别用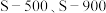 表示,相关信息如下表:
表示,相关信息如下表:
将NO浓度恒定的废气以固定流速通过反应器(图1)。不同温度下,进行多组平行实验,测定相同时间内NO的出口浓度,可得NO的脱除率与温度的关系如图2所示。
[已知: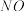 的脱除主要包含吸附和化学还原(
的脱除主要包含吸附和化学还原( )两个过程]
)两个过程]
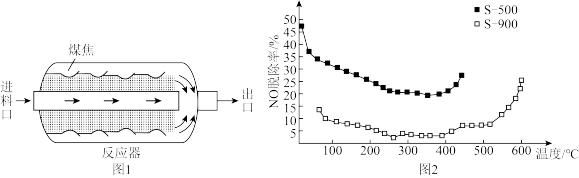
①已知煤焦表面存在的官能团有利于吸附NO,其数量与煤焦中氢碳质量比的值密切相关,比值小,表面官能团少。由图2可知,相同温度下,单位时间内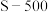 对NO的脱除率比
对NO的脱除率比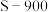 的高,可能原因是
的高,可能原因是___________ 。(答两条)。
② 后,随着温度升高,单位时间内NO的脱除率增大的原因是
后,随着温度升高,单位时间内NO的脱除率增大的原因是___________ 。
(4)电解氧化吸收法:其原理如图3所示:
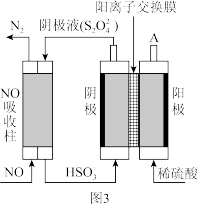
①从A口中出来的物质的是___________ 。
②写出电解池阴极的电极反应式___________ 。
(1)已知:

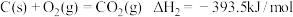

写出C与
 反应生成
反应生成 的热化学方程式
的热化学方程式(2)已知:
 。在
。在 恒容密闭容器中,投入
恒容密闭容器中,投入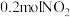 和
和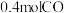 ,经过一段时间后达到平衡状态,测得
,经过一段时间后达到平衡状态,测得 的转化率为
的转化率为 。该温度下,反应的平衡常数为
。该温度下,反应的平衡常数为(3)原煤经热解、冷却得到的煤焦可用于
 的脱除。热解温度为
的脱除。热解温度为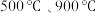 得到的煤焦分别用
得到的煤焦分别用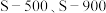 表示,相关信息如下表:
表示,相关信息如下表:| 煤焦 | 元素分析/% | 比表面积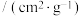 | |
| C | H | ||
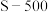 | 80.79 | 2.76 | 105.69 |
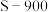 | 84.26 | 0.82 | 8.98 |
[已知:
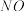 的脱除主要包含吸附和化学还原(
的脱除主要包含吸附和化学还原( )两个过程]
)两个过程]
①已知煤焦表面存在的官能团有利于吸附NO,其数量与煤焦中氢碳质量比的值密切相关,比值小,表面官能团少。由图2可知,相同温度下,单位时间内
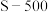 对NO的脱除率比
对NO的脱除率比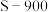 的高,可能原因是
的高,可能原因是②
 后,随着温度升高,单位时间内NO的脱除率增大的原因是
后,随着温度升高,单位时间内NO的脱除率增大的原因是(4)电解氧化吸收法:其原理如图3所示:

①从A口中出来的物质的是
②写出电解池阴极的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是____ 和____ (填分子式)。
(2)已知①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol–1
则反应CH4(g)=C(s)+2H2(g)的ΔH=_______________ kJ·mol–1
(3)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.021 6 mol/L。
①pH增大能加速O3分解,表明对O3分解起催化作用的微粒是____ 。
②在30 ℃、pH=4.0条件下,O3的分解速率为_____ mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为_____ (填字母)。
a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0
(4)O3可由臭氧发生器(原理如图)电解稀硫酸制得。

①图中阴极为____ (填“A”或“B”),其电极反应式为_________________________ 。
②若C处通入O2,则A极的电极反应式为_________ ,右室pH变化___________ (填升高、降低、不变)
(1)O3与KI溶液反应生成的两种单质是
(2)已知①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol–1
则反应CH4(g)=C(s)+2H2(g)的ΔH=
(3)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.021 6 mol/L。
| pH t /min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的微粒是
②在30 ℃、pH=4.0条件下,O3的分解速率为
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为
a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0
(4)O3可由臭氧发生器(原理如图)电解稀硫酸制得。

①图中阴极为
②若C处通入O2,则A极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)丙烷(C3H8)是一种价格低廉的常用燃料,其主要成分是碳和氢两种元素,燃烧后只有二氧化碳和气态水,不会对环境造成污染。已知1 g丙烷完全燃烧放出50.45 kJ的热量。丙烷在室温下燃烧的热化学方程式为______________________ 。
(2)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为__________________________ ;
(3)一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生反应N2O4 (g) 2NO2 (g) ,下列示意图正确且能说明反应达到平衡状态的是
2NO2 (g) ,下列示意图正确且能说明反应达到平衡状态的是___________ 。


(4)在密闭容器中充入A(g)和B(g),它们的初始浓度均为2 mol·L-1,在一定条件下发生反应:A(g)+B(g) 2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
①该反应的平衡常数的表达式为_________________ 。
②A的转化率为___________ 。
③若升温至T2时,此反应的平衡常数为1,判断该反应ΔH_____ 0(填“>”或“<”);若在T2时,投入A、B、C三种物质的浓度均为3 mol·L-1,此时v(正)____ v(逆)。(填“>”、“<”或“=”)
(2)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为
(3)一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生反应N2O4 (g)
 2NO2 (g) ,下列示意图正确且能说明反应达到平衡状态的是
2NO2 (g) ,下列示意图正确且能说明反应达到平衡状态的是

(4)在密闭容器中充入A(g)和B(g),它们的初始浓度均为2 mol·L-1,在一定条件下发生反应:A(g)+B(g)
 2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
2C(g) ΔH。该T1温度下,此反应的平衡常数为4,①该反应的平衡常数的表达式为
②A的转化率为
③若升温至T2时,此反应的平衡常数为1,判断该反应ΔH
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】传统的生物脱氮工艺如图所示,生物脱氮主要包括有氧环境下的硝化反应过程和缺氧环境下的反硝化反应过程。硝化过程中, 先后氧化为
先后氧化为 和
和 。
。

(1) 在硝化过程中会使溶液酸度提高,需要加入NaHCO3进行中和。请写出
在硝化过程中会使溶液酸度提高,需要加入NaHCO3进行中和。请写出 硝化生成
硝化生成 的离子方程式:
的离子方程式:______ 。
(2)①反硝化反应过程中,加入碳源(甲醇等有机物)将硝化反应中生成的 和
和 还原为N2,如3CH3OH+6
还原为N2,如3CH3OH+6 =3N2↑+3CO2↑+3H2O+6OH-。新型生物脱氮工艺(SCND)可将硝化过程中的产物控制在
=3N2↑+3CO2↑+3H2O+6OH-。新型生物脱氮工艺(SCND)可将硝化过程中的产物控制在 阶段,防止生成
阶段,防止生成 ,该工艺的优点是
,该工艺的优点是_______ 。
②同步硝化反硝化工艺(SND)将硝化阶段和反硝化阶段放在同一个反应器中进行,该法既有SCND法的优点,将硝化过程中的产物控制在 阶段,还有一个优点是
阶段,还有一个优点是______ 。
③现在很多国家采用半硝化工艺(ANAMMOX),工作原理如图所示:

半硝化脱氮反应器中,一半的 氧化成
氧化成 ,写出厌氧氨氧化发生反应的离子方程式:
,写出厌氧氨氧化发生反应的离子方程式:_____ 。该方法是否需要加入碳源(甲醇),并简述原因______ 。
(3)研究发现,脱氮工艺会产生一种温室气体N2O。目前普遍认为在硝化阶段会形成 N2O,试分析N2O的成因_______ 。
 先后氧化为
先后氧化为 和
和 。
。
(1)
 在硝化过程中会使溶液酸度提高,需要加入NaHCO3进行中和。请写出
在硝化过程中会使溶液酸度提高,需要加入NaHCO3进行中和。请写出 硝化生成
硝化生成 的离子方程式:
的离子方程式:(2)①反硝化反应过程中,加入碳源(甲醇等有机物)将硝化反应中生成的
 和
和 还原为N2,如3CH3OH+6
还原为N2,如3CH3OH+6 =3N2↑+3CO2↑+3H2O+6OH-。新型生物脱氮工艺(SCND)可将硝化过程中的产物控制在
=3N2↑+3CO2↑+3H2O+6OH-。新型生物脱氮工艺(SCND)可将硝化过程中的产物控制在 阶段,防止生成
阶段,防止生成 ,该工艺的优点是
,该工艺的优点是②同步硝化反硝化工艺(SND)将硝化阶段和反硝化阶段放在同一个反应器中进行,该法既有SCND法的优点,将硝化过程中的产物控制在
 阶段,还有一个优点是
阶段,还有一个优点是③现在很多国家采用半硝化工艺(ANAMMOX),工作原理如图所示:

半硝化脱氮反应器中,一半的
 氧化成
氧化成 ,写出厌氧氨氧化发生反应的离子方程式:
,写出厌氧氨氧化发生反应的离子方程式:(3)研究发现,脱氮工艺会产生一种温室气体N2O。目前普遍认为在硝化阶段会形成 N2O,试分析N2O的成因
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:


回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为___________________ 。“酸浸”实验中为了提高酸浸的效率,除了升温还可以采取的措施有___________________ (至少写两种)。
(2)“酸浸”后,“滤液①”钛主要以 形式存在,写出其水解生成TiO2·xH2O的离子方程式
形式存在,写出其水解生成TiO2·xH2O的离子方程式__________________ 。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
分析40 ℃时TiO2·xH2O转化率最高的原因__________________ 。
(4)若“滤液②”中 ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使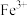 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中 ,此时是否有Mg3(PO4)2沉淀生成?
,此时是否有Mg3(PO4)2沉淀生成?_____________ (列式计算 )。FePO4、Mg3(PO4)2的Ksp分别为 。
。


回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为
(2)“酸浸”后,“滤液①”钛主要以
 形式存在,写出其水解生成TiO2·xH2O的离子方程式
形式存在,写出其水解生成TiO2·xH2O的离子方程式(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40 ℃时TiO2·xH2O转化率最高的原因
(4)若“滤液②”中
 ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使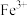 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中 ,此时是否有Mg3(PO4)2沉淀生成?
,此时是否有Mg3(PO4)2沉淀生成? 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】在反应原理部分,我们经常以H2和I2的反应为例来研究化学反应速率和平衡。
(1)在2L的容器中充入H2、I2各1mol,对于反应:H2(g)+I2(g) 2HI(g),在323K和343K时H2的转化率随时间变化的结果如图所示。
2HI(g),在323K和343K时H2的转化率随时间变化的结果如图所示。
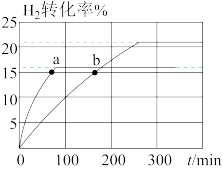
①323K时反应的平衡转化率 =
=__________ %。平衡常数K=____________ (保留2位小数)。
②在343K时,要提高I2转化率,可采取的措施是____ ( 答出两条);要缩短反应达到平衡的时间,可采取的措施有___ ( 答出两条)。
③比较a、b处反应速率大小:v(a)____ v(b)(填 “大于”“小于”或“等于”)。反应速率v正=k正x(H2)x(I2),v逆=k逆x2(HI),k正、 k逆分别为正、逆反应速率常数[k逆(323)=5,k逆(343)=7],x为物质的量分数,计算b处v正=________ mol/(L ∙ min)(保留1位小数)。
(2)对于反应:H2(g)+I2(g) 2HI(g)提出如下反应历程
2HI(g)提出如下反应历程
第一步:I2 I+I(快速平衡)
I+I(快速平衡)
第二步:H2+2I→2HI (慢反应)
其中可近似认为第二步反应不影响第一步的平衡。 下列表述正确的是______ ( 填字母序号)。
a.v(第一步的逆反应)<v(第二步的逆反应)
b.反应的中间产物只有I
c.第二步反应活化能较低
d.第二步中H2与I的碰撞仅部分有效
(3)已知反应2HI(g) H2(g)+I2(g)的能量变化如图所示,则1molHI(g)分子中化学键断裂时需吸收的能量为
H2(g)+I2(g)的能量变化如图所示,则1molHI(g)分子中化学键断裂时需吸收的能量为_______ kJ。
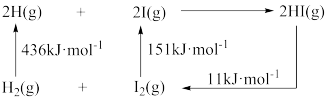
(1)在2L的容器中充入H2、I2各1mol,对于反应:H2(g)+I2(g)
 2HI(g),在323K和343K时H2的转化率随时间变化的结果如图所示。
2HI(g),在323K和343K时H2的转化率随时间变化的结果如图所示。
①323K时反应的平衡转化率
 =
=②在343K时,要提高I2转化率,可采取的措施是
③比较a、b处反应速率大小:v(a)
(2)对于反应:H2(g)+I2(g)
 2HI(g)提出如下反应历程
2HI(g)提出如下反应历程第一步:I2
 I+I(快速平衡)
I+I(快速平衡)第二步:H2+2I→2HI (慢反应)
其中可近似认为第二步反应不影响第一步的平衡。 下列表述正确的是
a.v(第一步的逆反应)<v(第二步的逆反应)
b.反应的中间产物只有I
c.第二步反应活化能较低
d.第二步中H2与I的碰撞仅部分有效
(3)已知反应2HI(g)
 H2(g)+I2(g)的能量变化如图所示,则1molHI(g)分子中化学键断裂时需吸收的能量为
H2(g)+I2(g)的能量变化如图所示,则1molHI(g)分子中化学键断裂时需吸收的能量为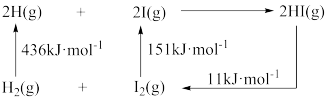
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA- H++A2-。
H++A2-。
①NaHA溶液的pH__ (填“大于”“小于”或“等于”)Na2A溶液的pH。
②某温度下,若向0.1mol•L-1的NaHA溶液中逐滴滴加0.1mol•L-1KOH溶液至溶液呈中性。此时该混合溶液中,下列关系一定正确的是__ 。
A.c(H+)•c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05mol•L-1
③已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq)△H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有
Ca2+(aq)+A2-(aq)△H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有__ 。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
(2)0.2mol•L-1HR溶液与0.1mol•L-1NaOH溶液等体积混合,测得混合溶液pH>7,则说明在相同条件下HR的电离程度__ (填“>”“<”或“=”)NaR的水解程度,混合溶液中各离子浓度的大小顺序为__ 。
(3)常温下,若在0.10mol•L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=___ mol•L-1(Ksp[Cu(OH)2]=2.2×10-20)。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-
 H++A2-。
H++A2-。①NaHA溶液的pH
②某温度下,若向0.1mol•L-1的NaHA溶液中逐滴滴加0.1mol•L-1KOH溶液至溶液呈中性。此时该混合溶液中,下列关系一定正确的是
A.c(H+)•c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05mol•L-1
③已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)
 Ca2+(aq)+A2-(aq)△H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有
Ca2+(aq)+A2-(aq)△H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
(2)0.2mol•L-1HR溶液与0.1mol•L-1NaOH溶液等体积混合,测得混合溶液pH>7,则说明在相同条件下HR的电离程度
(3)常温下,若在0.10mol•L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=
您最近一年使用:0次
解答题-实验探究题
|
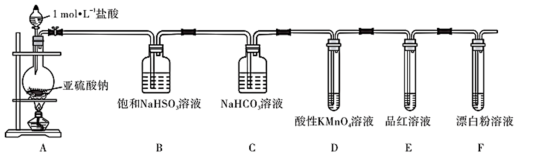
适中
(0.65)
【推荐2】 虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对
虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对 的部分性质进行了探究。
的部分性质进行了探究。
(1)二氧化硫的水溶液
 易溶于水,常温常压下溶解度为
易溶于水,常温常压下溶解度为 ,溶于水生成
,溶于水生成 。已知
。已知 ,欲验证酸性:
,欲验证酸性: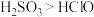 ,设计以下实验达到目的(部分夹持装置已省略)。装置图中
,设计以下实验达到目的(部分夹持装置已省略)。装置图中 处发生的反应的方程式为
处发生的反应的方程式为___________ ,装置 的作用是
的作用是___________ 。能证明 的酸性强于
的酸性强于 的实验现象为
的实验现象为___________ 。
(2)①请设计简单实验方案比较室温下 溶液中
溶液中 的电离平衡常数
的电离平衡常数 与水解平衡常数
与水解平衡常数 的相对大小:
的相对大小:___________ 。
② 时,
时,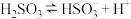 的电离常数
的电离常数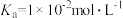 ,则该温度下
,则该温度下 、
、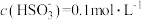 的
的 溶液中
溶液中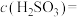
___________ 。
(3)亚硫酰氯(俗称氯化亚砜, )是一种液态化合物,沸点
)是一种液态化合物,沸点 ,在农药、制药行业、有机合成等领域用途广泛。
,在农药、制药行业、有机合成等领域用途广泛。 遇水剧烈反应,液面上产生白雾,并伴有刺激性气味的气体产生。蒸干
遇水剧烈反应,液面上产生白雾,并伴有刺激性气味的气体产生。蒸干 溶液不能得到无水
溶液不能得到无水 ,使
,使 与
与 混合加热可得到无水
混合加热可得到无水 ,试解释原因:
,试解释原因:___________ 。
 虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对
虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对 的部分性质进行了探究。
的部分性质进行了探究。(1)二氧化硫的水溶液
 易溶于水,常温常压下溶解度为
易溶于水,常温常压下溶解度为 ,溶于水生成
,溶于水生成 。已知
。已知 ,欲验证酸性:
,欲验证酸性: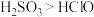 ,设计以下实验达到目的(部分夹持装置已省略)。装置图中
,设计以下实验达到目的(部分夹持装置已省略)。装置图中 处发生的反应的方程式为
处发生的反应的方程式为 的作用是
的作用是 的酸性强于
的酸性强于 的实验现象为
的实验现象为
(2)①请设计简单实验方案比较室温下
 溶液中
溶液中 的电离平衡常数
的电离平衡常数 与水解平衡常数
与水解平衡常数 的相对大小:
的相对大小:②
 时,
时,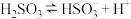 的电离常数
的电离常数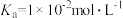 ,则该温度下
,则该温度下 、
、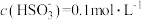 的
的 溶液中
溶液中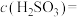
(3)亚硫酰氯(俗称氯化亚砜,
 )是一种液态化合物,沸点
)是一种液态化合物,沸点 ,在农药、制药行业、有机合成等领域用途广泛。
,在农药、制药行业、有机合成等领域用途广泛。 遇水剧烈反应,液面上产生白雾,并伴有刺激性气味的气体产生。蒸干
遇水剧烈反应,液面上产生白雾,并伴有刺激性气味的气体产生。蒸干 溶液不能得到无水
溶液不能得到无水 ,使
,使 与
与 混合加热可得到无水
混合加热可得到无水 ,试解释原因:
,试解释原因:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】将铜锌合金溶解后与足量 溶液反应(
溶液反应( 不与
不与 反应),生成的
反应),生成的 用
用 标准溶液滴定,根据消耗的
标准溶液滴定,根据消耗的 溶液体积可测算合金中铜的含量.实验过程如下:
溶液体积可测算合金中铜的含量.实验过程如下:
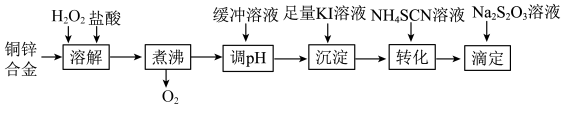
(1) 的电子式为
的电子式为______________ ,“溶解”步骤中铜发生反应的离子方程式是______________ ,“煮沸”步骤的目的是______________ .
(2)“缓冲溶液”是浓度均为 的
的 和
和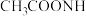 的混合溶液.
的混合溶液. 时,缓冲溶液中各种离子浓度由大到小的顺序为
时,缓冲溶液中各种离子浓度由大到小的顺序为______________ .[ 时,
时, ]
]
(3)“调 步骤将溶液
步骤将溶液 由1.调到6,如果缺少这一步,对实验的影响为
由1.调到6,如果缺少这一步,对实验的影响为______________ .
(4)“沉淀”步骤中有 沉淀产生,反应的离子方程式为
沉淀产生,反应的离子方程式为______________ .
(5)“转化”步骤中, 转化为
转化为 .沉淀完全转化后,溶液中
.沉淀完全转化后,溶液中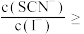
______________ [已知: ;
;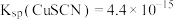 ]
]
 溶液反应(
溶液反应( 不与
不与 反应),生成的
反应),生成的 用
用 标准溶液滴定,根据消耗的
标准溶液滴定,根据消耗的 溶液体积可测算合金中铜的含量.实验过程如下:
溶液体积可测算合金中铜的含量.实验过程如下:
(1)
 的电子式为
的电子式为(2)“缓冲溶液”是浓度均为
 的
的 和
和 的混合溶液.
的混合溶液. 时,缓冲溶液中各种离子浓度由大到小的顺序为
时,缓冲溶液中各种离子浓度由大到小的顺序为 时,
时, ]
](3)“调
 步骤将溶液
步骤将溶液 由1.调到6,如果缺少这一步,对实验的影响为
由1.调到6,如果缺少这一步,对实验的影响为(4)“沉淀”步骤中有
 沉淀产生,反应的离子方程式为
沉淀产生,反应的离子方程式为(5)“转化”步骤中,
 转化为
转化为 .沉淀完全转化后,溶液中
.沉淀完全转化后,溶液中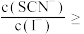
 ;
;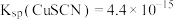 ]
]
您最近一年使用:0次



