解题方法
1 . Ⅰ.25℃时,部分弱酸的电离平衡常数如下表:
(1)H2S的二级电离平衡常数的表达式为_________ 。
(2)相同c(H+)浓度的HCOOH和HClO溶液中:c(HCOOH)______ c(HClO) (填“>”、“<”或“=”)。
Ⅱ.现将pH=3,体积均为V0的盐酸和醋酸溶液分别加水稀释至体积V,pH随lg( )的变化如图所示。
)的变化如图所示。

(3)醋酸的电离平衡常数表达式为Ka=________ ;加水稀释过程中,醋酸的电离平衡向______ (填“正”或“逆”)反应方向移动,Ka______ 填“增大”“减小”或“不变”)。
(4)比较b、c两点溶液的导电能力强弱:b_______ c(填大于、小于、等于)。
(5)已知HA的电离常数Ka1=4.9×10-10,H2B的电离常数Ka1=4.3×10-7,Ka2=5.6×10-12,试写出NaA与少量H2B反应的离子方程式___________ 。
| 弱酸 | HCOOH | H2S | H2CO3 | HClO |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka1=1.3×10-7 Ka2=7.1×10-15 | Ka1=4.4×10-7 Ka2=4.7×10-11 | Ka=3.0×10-8 |
(2)相同c(H+)浓度的HCOOH和HClO溶液中:c(HCOOH)
Ⅱ.现将pH=3,体积均为V0的盐酸和醋酸溶液分别加水稀释至体积V,pH随lg(
 )的变化如图所示。
)的变化如图所示。
(3)醋酸的电离平衡常数表达式为Ka=
(4)比较b、c两点溶液的导电能力强弱:b
(5)已知HA的电离常数Ka1=4.9×10-10,H2B的电离常数Ka1=4.3×10-7,Ka2=5.6×10-12,试写出NaA与少量H2B反应的离子方程式
您最近一年使用:0次
解题方法
2 . 下列溶液因盐的水解而呈碱性的是
A. | B. | C. | D. |
您最近一年使用:0次
2024-03-21更新
|
33次组卷
|
2卷引用:新疆乌鲁木齐第六十一中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
3 . 完成下列问题
(1)已知 和
和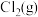 反应过程中能量变化如图所示:
反应过程中能量变化如图所示:
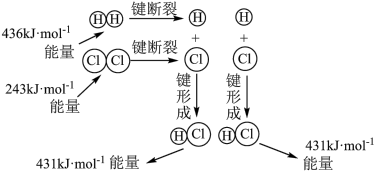
写出此反应的热化学方程式_____ 。
(2)已知 时,
时, 的电离平衡常数为:
的电离平衡常数为: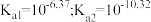 ,用离子方程式解释
,用离子方程式解释 溶液呈碱性的原因
溶液呈碱性的原因_____ ,计算 时
时 溶液中
溶液中 的水解平衡常数
的水解平衡常数
_____ 。
(3)氢气用于工业合成氨 ,一定温度下,在容积恒定的密闭容器中,一定量的
,一定温度下,在容积恒定的密闭容器中,一定量的 和
和 反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示。
反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示。
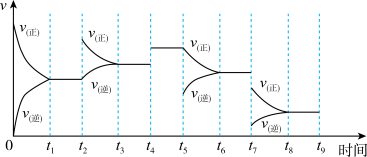
下列说法正确的是_____。
(1)已知
 和
和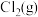 反应过程中能量变化如图所示:
反应过程中能量变化如图所示:
写出此反应的热化学方程式
(2)已知
 时,
时, 的电离平衡常数为:
的电离平衡常数为: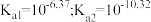 ,用离子方程式解释
,用离子方程式解释 溶液呈碱性的原因
溶液呈碱性的原因 时
时 溶液中
溶液中 的水解平衡常数
的水解平衡常数
(3)氢气用于工业合成氨
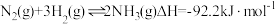 ,一定温度下,在容积恒定的密闭容器中,一定量的
,一定温度下,在容积恒定的密闭容器中,一定量的 和
和 反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示。
反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示。
下列说法正确的是_____。
A. 时刻改变的条件是增加反应物浓度,增加活化分子百分数,加快了反应速率 时刻改变的条件是增加反应物浓度,增加活化分子百分数,加快了反应速率 |
B.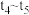 时刻改变的条件是加入催化剂,催化剂可降低活化能,加快了反应速率 时刻改变的条件是加入催化剂,催化剂可降低活化能,加快了反应速率 |
C. 时刻改变条件可能为降压 时刻改变条件可能为降压 |
D. 时刻 时刻 的转化率最大 的转化率最大 |
您最近一年使用:0次
解题方法
4 . 电离平衡、化学平衡、水解平衡、沉淀溶解平衡是重要的化学反应原理内容:
(1)常温下,将 稀释,则稀释后
稀释,则稀释后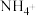 的数目
的数目______________ (填“增多”或“减少”)
(2)常温下,稀释 溶液时,
溶液时, 的
的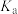 不变,水的离子积
不变,水的离子积
_______________ (填“增大”、“减小”或“不变”)
(3) 时,将
时,将 和
和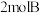 两种气体混合于
两种气体混合于 密闭容器中,发生如下反应:
密闭容器中,发生如下反应: 末达到平衡,生成
末达到平衡,生成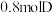 .
.
该反应的平衡常数表达式为:
_______________ ;已知 ,则
,则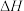
_______________ 0(填“>”或“<”),在 末时,D的平均反应速率为
末时,D的平均反应速率为______________
(4)在实验室配制 溶液时,常滴加几滴
溶液时,常滴加几滴 溶液,试用离子方程式及简要文字解释说明原因:
溶液,试用离子方程式及简要文字解释说明原因:______________
(5)某温度下,向含有 固体的
固体的 饱和溶液中加入少量稀盐酸,则
饱和溶液中加入少量稀盐酸,则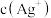
______________ (填“增大”、“减小”或“不变”)
(6)冰融化为水的过程: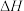
_______________ 0(填“>”、或“<”)
(1)常温下,将
 稀释,则稀释后
稀释,则稀释后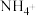 的数目
的数目(2)常温下,稀释
 溶液时,
溶液时, 的
的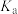 不变,水的离子积
不变,水的离子积
(3)
 时,将
时,将 和
和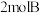 两种气体混合于
两种气体混合于 密闭容器中,发生如下反应:
密闭容器中,发生如下反应: 末达到平衡,生成
末达到平衡,生成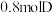 .
.该反应的平衡常数表达式为:

 ,则
,则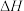
 末时,D的平均反应速率为
末时,D的平均反应速率为(4)在实验室配制
 溶液时,常滴加几滴
溶液时,常滴加几滴 溶液,试用离子方程式及简要文字解释说明原因:
溶液,试用离子方程式及简要文字解释说明原因:(5)某温度下,向含有
 固体的
固体的 饱和溶液中加入少量稀盐酸,则
饱和溶液中加入少量稀盐酸,则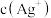
(6)冰融化为水的过程:
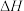
您最近一年使用:0次
名校
解题方法
5 . 党的二十大报告中强调“实现碳达峰碳中和是一场广泛而深刻的经济社会系统性变革”。 的转化和利用是实现碳中和的有效途径。请回答下列问题:
的转化和利用是实现碳中和的有效途径。请回答下列问题:
(1) 可以被
可以被 溶液捕获。室温下,若所得溶液
溶液捕获。室温下,若所得溶液 ,溶液
,溶液
_______ (已知:室温下, 的
的 ;
; )。
)。
(2)已知:①

②
 ,
,
③

则反应③中
_____  ,该反应的。自发条件是
,该反应的。自发条件是_____ (填“高温自发”“低温自发”或“任何温度下都自发”),该反应中活化能
_____ (填“>”或“<”) (逆)。
(逆)。
(3)在某压强下,上述反应③在不同温度、不同投料比时, 的平衡转化率如图所示。
的平衡转化率如图所示。 温度下,将
温度下,将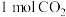 和
和 充入
充入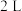 的密闭容器中,
的密闭容器中, 后达到平衡状态。
后达到平衡状态。
①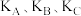 三者之间的大小关系为
三者之间的大小关系为___ 。

②达到化学平衡状态时,下列有关叙述正确的是___ (填字母序号)。
A.容器内气体压强不再发生改变
B.正、逆反应速率相等且均为零
C.向容器内再通入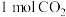 和
和 ,重新达平衡后
,重新达平衡后 体积分数增大
体积分数增大
D.向容器内通入少量氦气,则平衡向正反应方向移动
(4)近年来,有研究人员用 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示。请写出
的回收利用,其工作原理如图所示。请写出 电极上产生
电极上产生 的电极反应式:
的电极反应式:_____ 。

 的转化和利用是实现碳中和的有效途径。请回答下列问题:
的转化和利用是实现碳中和的有效途径。请回答下列问题:(1)
 可以被
可以被 溶液捕获。室温下,若所得溶液
溶液捕获。室温下,若所得溶液 ,溶液
,溶液
 的
的 ;
; )。
)。(2)已知:①


②

 ,
,③


则反应③中

 ,该反应的。自发条件是
,该反应的。自发条件是
 (逆)。
(逆)。(3)在某压强下,上述反应③在不同温度、不同投料比时,
 的平衡转化率如图所示。
的平衡转化率如图所示。 温度下,将
温度下,将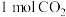 和
和 充入
充入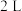 的密闭容器中,
的密闭容器中, 后达到平衡状态。
后达到平衡状态。①
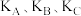 三者之间的大小关系为
三者之间的大小关系为
②达到化学平衡状态时,下列有关叙述正确的是
A.容器内气体压强不再发生改变
B.正、逆反应速率相等且均为零
C.向容器内再通入
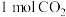 和
和 ,重新达平衡后
,重新达平衡后 体积分数增大
体积分数增大D.向容器内通入少量氦气,则平衡向正反应方向移动
(4)近年来,有研究人员用
 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示。请写出
的回收利用,其工作原理如图所示。请写出 电极上产生
电极上产生 的电极反应式:
的电极反应式:
您最近一年使用:0次
名校
解题方法
6 . 下列电离方程式正确的是
A. 溶于水: 溶于水: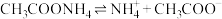 |
B. 溶于水: 溶于水: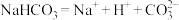 |
C.HCl溶于水: |
D. 溶于水: 溶于水: |
您最近一年使用:0次
7 . 以下事实不能 说明醋酸是弱电解质的是
| A.氢离子浓度相同的醋酸溶液和盐酸溶液,前者浓度大 |
B.醋酸溶液中CH3COOH分子和 离子共存 离子共存 |
| C.相同浓度的醋酸溶液和硫酸溶液,后者导电性强 |
D.将 醋酸溶液体积稀释十倍,稀释后 醋酸溶液体积稀释十倍,稀释后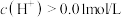 |
您最近一年使用:0次
2023-12-28更新
|
87次组卷
|
2卷引用: 北京市第一六六中学2023-2024学年高二上学期期中考试化学试卷
名校
解题方法
8 . 下列化学用语表达正确的是
A.水的电离方程式: |
B.碳燃烧的热化学方程式: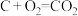 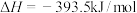 |
C.碳酸的电离方程式: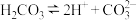 |
D.反应 的平衡常数表达式: 的平衡常数表达式: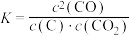 |
您最近一年使用:0次
解题方法
9 . 下列说法正确的是
| A.常温下,2.0×10-4mol/L的盐酸稀释104倍,c(H+)=2.0×10-3mol/L |
| B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
| C.常温下,pH=3的醋酸溶液中加入少量醋酸钠固体,溶液pH不变 |
| D.将KCl溶液从常温加热至60℃,溶液的pH变小但仍保持中性 |
您最近一年使用:0次
名校
解题方法
10 .  常作食品加工中的食品添加剂,用于焙烤食品;
常作食品加工中的食品添加剂,用于焙烤食品; 在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1) 可作净水剂,其原理是
可作净水剂,其原理是___________ (用离子方程式说明)。
(2)相同条件下, 溶液中的
溶液中的
___________ (填“等于”“大于”或“小于”) 溶液中的
溶液中的 。
。
(3)几种均为 的电解质溶液的pH随温度变化的曲线如图所示。
的电解质溶液的pH随温度变化的曲线如图所示。

①其中符合 溶液的pH随温度变化的曲线是
溶液的pH随温度变化的曲线是___________ (填罗马数字),导致 溶液的pH随温度变化的原因是
溶液的pH随温度变化的原因是___________ 。
②25℃时, 溶液中
溶液中
___________  。
。
(4)金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,以达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度( )如下图。
)如下图。

①若要除去 溶液中的少量
溶液中的少量 ,应该调节溶液的pH为
,应该调节溶液的pH为___________ (填字母,下同);
A.<1 B.4左右 C.5左右 D.>6
②下列试剂中适宜用来调节pH的是___________ 。
A.NaOH B.CuO C. D.Cu
D.Cu
 常作食品加工中的食品添加剂,用于焙烤食品;
常作食品加工中的食品添加剂,用于焙烤食品; 在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
在分析试剂、医药、电子工业中用途广泛。请回答下列问题:(1)
 可作净水剂,其原理是
可作净水剂,其原理是(2)相同条件下,
 溶液中的
溶液中的
 溶液中的
溶液中的 。
。(3)几种均为
 的电解质溶液的pH随温度变化的曲线如图所示。
的电解质溶液的pH随温度变化的曲线如图所示。
①其中符合
 溶液的pH随温度变化的曲线是
溶液的pH随温度变化的曲线是 溶液的pH随温度变化的原因是
溶液的pH随温度变化的原因是②25℃时,
 溶液中
溶液中
 。
。(4)金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,以达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(
 )如下图。
)如下图。
①若要除去
 溶液中的少量
溶液中的少量 ,应该调节溶液的pH为
,应该调节溶液的pH为A.<1 B.4左右 C.5左右 D.>6
②下列试剂中适宜用来调节pH的是
A.NaOH B.CuO C.
 D.Cu
D.Cu
您最近一年使用:0次



