解题方法
1 . 下列实验操作和现象,得出的相应结论正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向盛有Fe(OH)3和NiO(OH)的试管中分别滴加浓盐酸 | 盛NiO(OH)的试管中产生黄绿色气体 | 氧化性:NiO(OH)>Fe(OH)3>Cl2 |
| B | 向CuSO4溶液中通入H2S气体 | 出现黑色沉淀(CuS) | Cu2+能使H2S的电离平衡正向移动 |
| C | 乙醇和浓硫酸共热至170℃,将产生的气体通入溴水中 | 溴水褪色 | 产生的气体中只有乙烯和SO2 |
| D | 向Na2HPO4溶液中滴加AgNO3溶液 | 出现黄色沉淀(Ag3PO4) | Na2HPO4的水解程度大于其电离程度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . H₂S是生命体系信号分子,它参与调节神经信号传递,具有舒张血管的功能。已知H₂S的沸点是-60.4℃。
(1)某兴趣小组用CaS与MgCl₂反应制备高纯H₂S,实验装置如图所示(装置A内产生的H₂S气体中含有酸性气体杂质)。_______ 。
②装置B的作用是_______ 。装置C中的Ba(OH)₂可不可以换成NaHS? _______ (填“可以”或“不可以”),若填“可以”,则发生反应的离子方程式是_______ (若填不可以,则忽略此空)。
③玻璃装置骤冷骤热的温差不可超过40℃,否则容易破裂。此实验为防止玻璃装置炸裂而采取的设计是_______ 。
④装置G的作用是_______ 。
(2)NO与H₂S之间的反应及产物非常复杂,研究发现,HNO、HSNO、HSSNO、HS 等均是生理过程的关键物种。已知SSNO⁻参与多个生理过程。其中涉及SSNO⁻形成及变化的可能反应如下:
等均是生理过程的关键物种。已知SSNO⁻参与多个生理过程。其中涉及SSNO⁻形成及变化的可能反应如下:
HSNO+HS →SSNO⁻+HS⁻+H⁺ K1=5.0×10²
→SSNO⁻+HS⁻+H⁺ K1=5.0×10²
HSNO+HS →HSSNO+HS⁻ K2=25.2
→HSSNO+HS⁻ K2=25.2
计算此温度下HSSNO的电离常数Ka=_______ (保留小数点后1位数字)。
(3)H₂S的水溶液是一种重要氮量分析试剂,已知25 ℃时,在0.10 mol⋅L⁻¹ H₂S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S²⁻)关系如图所示(忽略溶液体稠的变化、H₂S的挥发)。pH=13时,溶液中的c(H₂S)+c(HS⁻)=_______ mol⋅L⁻¹。
(1)某兴趣小组用CaS与MgCl₂反应制备高纯H₂S,实验装置如图所示(装置A内产生的H₂S气体中含有酸性气体杂质)。

②装置B的作用是
③玻璃装置骤冷骤热的温差不可超过40℃,否则容易破裂。此实验为防止玻璃装置炸裂而采取的设计是
④装置G的作用是
(2)NO与H₂S之间的反应及产物非常复杂,研究发现,HNO、HSNO、HSSNO、HS
 等均是生理过程的关键物种。已知SSNO⁻参与多个生理过程。其中涉及SSNO⁻形成及变化的可能反应如下:
等均是生理过程的关键物种。已知SSNO⁻参与多个生理过程。其中涉及SSNO⁻形成及变化的可能反应如下:HSNO+HS
 →SSNO⁻+HS⁻+H⁺ K1=5.0×10²
→SSNO⁻+HS⁻+H⁺ K1=5.0×10²HSNO+HS
 →HSSNO+HS⁻ K2=25.2
→HSSNO+HS⁻ K2=25.2计算此温度下HSSNO的电离常数Ka=
(3)H₂S的水溶液是一种重要氮量分析试剂,已知25 ℃时,在0.10 mol⋅L⁻¹ H₂S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S²⁻)关系如图所示(忽略溶液体稠的变化、H₂S的挥发)。pH=13时,溶液中的c(H₂S)+c(HS⁻)=

您最近一年使用:0次
名校
解题方法
3 .  和
和 都是有毒气体,其中
都是有毒气体,其中 通过催化处理可获得氢能,
通过催化处理可获得氢能, 通过回收处理可制备化工原料(如
通过回收处理可制备化工原料(如 )。
)。
请回答下列问题:
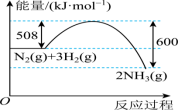
(1)工业上一种处理 的反应为
的反应为 。已知部分物质的相对能量如图所示:
。已知部分物质的相对能量如图所示:
_________________  。
。
②在恒容密闭容器中以投料比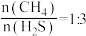 充入反应物发生该反应,下列不能说明该反应达到平衡状态的是
充入反应物发生该反应,下列不能说明该反应达到平衡状态的是_________________ (填字母)。
A.单位时间内断裂 键的数目与断裂
键的数目与断裂 键的数目相等
键的数目相等
B.混合气体的平均相对分子质量不变
C. 与
与 的体积比不变
的体积比不变
D.
(2) 也可通过高温热分解反应获得氢气和单质硫:
也可通过高温热分解反应获得氢气和单质硫: ,不同压强下,在密闭容器中进行该反应,测得平衡时
,不同压强下,在密闭容器中进行该反应,测得平衡时 的体积分数与温度、压强的关系如图所示:
的体积分数与温度、压强的关系如图所示: 由小到大的顺序为
由小到大的顺序为_____________________ 。若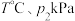 条件下,反应经过
条件下,反应经过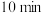 达到平衡,则
达到平衡,则 分压的平均变化速率为
分压的平均变化速率为_________________  (用含
(用含 的代数式表示,下同),该温度下反应的压强平衡常数
的代数式表示,下同),该温度下反应的压强平衡常数
_________________  (
( 用平衡时各物质的分压代替浓度计算,分压
用平衡时各物质的分压代替浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。
(3)燃煤烟气中的 可用于制备
可用于制备 ,
, 在空气中极易被氧化,某课题小组在常温下测得
在空气中极易被氧化,某课题小组在常温下测得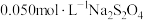 溶液的
溶液的 随时间变化的曲线如图所示。
随时间变化的曲线如图所示。 的第二步电离方程式为
的第二步电离方程式为__________________________ 。
② 内主要生成
内主要生成 ,常温下,
,常温下, 的
的
_________________  (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
③ 时得到的溶液中所含溶质为
时得到的溶液中所含溶质为_________________ (填化学式)。
 和
和 都是有毒气体,其中
都是有毒气体,其中 通过催化处理可获得氢能,
通过催化处理可获得氢能, 通过回收处理可制备化工原料(如
通过回收处理可制备化工原料(如 )。
)。请回答下列问题:
(1)工业上一种处理
 的反应为
的反应为 。已知部分物质的相对能量如图所示:
。已知部分物质的相对能量如图所示: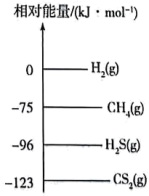

 。
。②在恒容密闭容器中以投料比
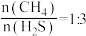 充入反应物发生该反应,下列不能说明该反应达到平衡状态的是
充入反应物发生该反应,下列不能说明该反应达到平衡状态的是A.单位时间内断裂
 键的数目与断裂
键的数目与断裂 键的数目相等
键的数目相等B.混合气体的平均相对分子质量不变
C.
 与
与 的体积比不变
的体积比不变D.

(2)
 也可通过高温热分解反应获得氢气和单质硫:
也可通过高温热分解反应获得氢气和单质硫: ,不同压强下,在密闭容器中进行该反应,测得平衡时
,不同压强下,在密闭容器中进行该反应,测得平衡时 的体积分数与温度、压强的关系如图所示:
的体积分数与温度、压强的关系如图所示: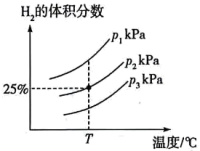
 由小到大的顺序为
由小到大的顺序为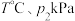 条件下,反应经过
条件下,反应经过 达到平衡,则
达到平衡,则 分压的平均变化速率为
分压的平均变化速率为 (用含
(用含 的代数式表示,下同),该温度下反应的压强平衡常数
的代数式表示,下同),该温度下反应的压强平衡常数
 (
( 用平衡时各物质的分压代替浓度计算,分压
用平衡时各物质的分压代替浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。(3)燃煤烟气中的
 可用于制备
可用于制备 ,
, 在空气中极易被氧化,某课题小组在常温下测得
在空气中极易被氧化,某课题小组在常温下测得 溶液的
溶液的 随时间变化的曲线如图所示。
随时间变化的曲线如图所示。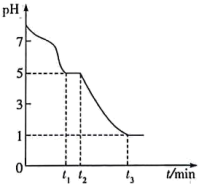
 的第二步电离方程式为
的第二步电离方程式为②
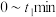 内主要生成
内主要生成 ,常温下,
,常温下, 的
的
 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。③
 时得到的溶液中所含溶质为
时得到的溶液中所含溶质为
您最近一年使用:0次
解题方法
4 . 酯化反应可用通式表示为 。在酸性条件下,
。在酸性条件下, ,
, 。假设整个过程中无环酯生成,不出现分层现象。
。假设整个过程中无环酯生成,不出现分层现象。
将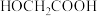 投入反应容器中,发生如下反应:
投入反应容器中,发生如下反应:
二聚: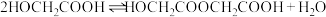
n聚: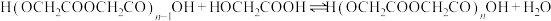
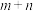 聚:
聚: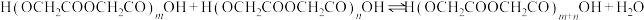 以上反应中每一步的速率常数近似认为相同,记平衡常数
以上反应中每一步的速率常数近似认为相同,记平衡常数 。
。
Ⅰ.反应平衡体系分析
(1)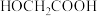 按系统命名法命名为
按系统命名法命名为______ 。
(2)定义反应程度 ,其中
,其中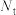 为时刻t时反应体系中-OH或者-COOH的数目,
为时刻t时反应体系中-OH或者-COOH的数目,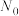 为初始反应体系中-OH或-COOH的数目。若
为初始反应体系中-OH或-COOH的数目。若 ,则
,则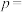
______ 。
(3)最终产物中存在多种聚合度的缩聚产物,平均聚合度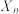 与平衡常数K的关系
与平衡常数K的关系
______ 。
(4)为了使平均聚合度增大,下列方法可行的是______ (填标号)。
A.及时移去 B.升高温度(
B.升高温度( )
)
C.提高 浓度 D.提高
浓度 D.提高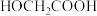 浓度
浓度
E.先将单体预聚合成低聚物,然后将低聚物进一步聚合
Ⅱ.在实际生产过程中,通常会将反应生成的水及时移去。
(5)加入少量 催化与不加入
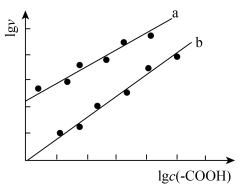
催化与不加入 催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为
催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为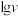 与
与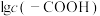 的关系]。
的关系]。
a、b两条曲线的理论斜率之比更接近______ 。 B.
B. C.
C.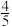 D.
D.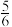
当温度升高时,b线斜率将______ (填“变大”、“变小”或“不变”)。
(6)加入少量 催化时,实验测得反应过程中平均聚合度
催化时,实验测得反应过程中平均聚合度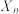 与反应时间t的关系为:
与反应时间t的关系为: ,其中
,其中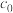 为反应初始时
为反应初始时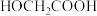 浓度,k为常数。0~t时,酯基生成的平均速率
浓度,k为常数。0~t时,酯基生成的平均速率
______ (用k、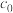 、t表示,忽略移去水对溶液体积的影响)。
、t表示,忽略移去水对溶液体积的影响)。
 。在酸性条件下,
。在酸性条件下, ,
, 。假设整个过程中无环酯生成,不出现分层现象。
。假设整个过程中无环酯生成,不出现分层现象。将
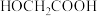 投入反应容器中,发生如下反应:
投入反应容器中,发生如下反应:二聚:
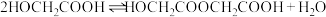
n聚:
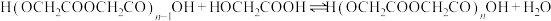
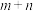 聚:
聚: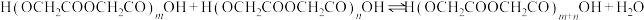 以上反应中每一步的速率常数近似认为相同,记平衡常数
以上反应中每一步的速率常数近似认为相同,记平衡常数 。
。Ⅰ.反应平衡体系分析
(1)
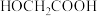 按系统命名法命名为
按系统命名法命名为(2)定义反应程度
 ,其中
,其中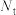 为时刻t时反应体系中-OH或者-COOH的数目,
为时刻t时反应体系中-OH或者-COOH的数目,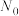 为初始反应体系中-OH或-COOH的数目。若
为初始反应体系中-OH或-COOH的数目。若 ,则
,则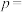
(3)最终产物中存在多种聚合度的缩聚产物,平均聚合度
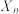 与平衡常数K的关系
与平衡常数K的关系
(4)为了使平均聚合度增大,下列方法可行的是
A.及时移去
 B.升高温度(
B.升高温度( )
)C.提高
 浓度 D.提高
浓度 D.提高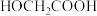 浓度
浓度E.先将单体预聚合成低聚物,然后将低聚物进一步聚合
Ⅱ.在实际生产过程中,通常会将反应生成的水及时移去。
(5)加入少量
 催化与不加入
催化与不加入 催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为
催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为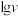 与
与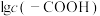 的关系]。
的关系]。a、b两条曲线的理论斜率之比更接近
 B.
B. C.
C.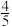 D.
D.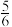
当温度升高时,b线斜率将
(6)加入少量
 催化时,实验测得反应过程中平均聚合度
催化时,实验测得反应过程中平均聚合度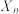 与反应时间t的关系为:
与反应时间t的关系为: ,其中
,其中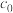 为反应初始时
为反应初始时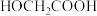 浓度,k为常数。0~t时,酯基生成的平均速率
浓度,k为常数。0~t时,酯基生成的平均速率
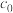 、t表示,忽略移去水对溶液体积的影响)。
、t表示,忽略移去水对溶液体积的影响)。
您最近一年使用:0次
解题方法
5 . 铁及其化合物在催化、生产中具有重要作用。
(1)以 和
和 为原料,熔融
为原料,熔融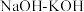 为电解质,纳米
为电解质,纳米 作催化剂,在
作催化剂,在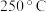 和常压下可实现电化学合成氨。
和常压下可实现电化学合成氨。
①基态 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为___________ 。
②阴极区发生的变化可视为按两步进行,请补充完整。
电极反应式:___________ 和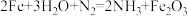 。
。
(2)在 催化作用下,合成氨反应
催化作用下,合成氨反应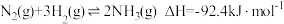 的反应历程为(*表示吸附态):
的反应历程为(*表示吸附态):
化学吸附: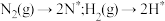 ;
;
表面反应: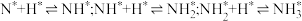 ;
;
脱附:
其中, 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
实际生产中,常用工艺条件, 作催化剂,控制温度
作催化剂,控制温度 ,压强
,压强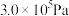 ,原料中
,原料中 和
和 物质的量之比为
物质的量之比为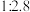 。
。
①分析说明原料气中 过量的理由
过量的理由___________ 。
②关于合成氨工艺的下列理解,正确的是___________ 。
A.控制温度( )远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
B.当温度、压强一定时,在原料气( 和
和 的比例不变)中添加少量惰性气体,有利于提高平衡转化率
的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.基于 有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
D.分离空气可得 ,通过天然气和水蒸气转化可得
,通过天然气和水蒸气转化可得 ,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
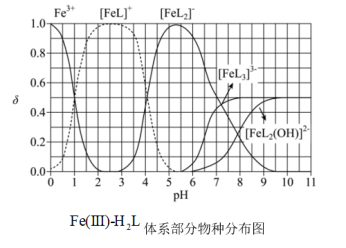
(3)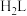 为某邻苯二酚类配体,其
为某邻苯二酚类配体,其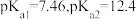 。常温下构建
。常温下构建 溶液体系,其中
溶液体系,其中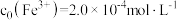 ,
,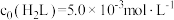 。体系中含
。体系中含 物种的组分分布系数
物种的组分分布系数 与
与 的关系如图所示,分布系数
的关系如图所示,分布系数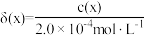 。
。 时,
时,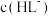
___________ 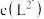 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
②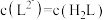 时,
时,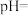
___________ ;
③当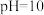 时,参与配位的
时,参与配位的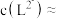
___________  (写出计算过程)。
(写出计算过程)。
(1)以
 和
和 为原料,熔融
为原料,熔融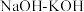 为电解质,纳米
为电解质,纳米 作催化剂,在
作催化剂,在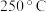 和常压下可实现电化学合成氨。
和常压下可实现电化学合成氨。①基态
 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为②阴极区发生的变化可视为按两步进行,请补充完整。
电极反应式:
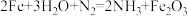 。
。(2)在
 催化作用下,合成氨反应
催化作用下,合成氨反应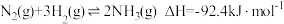 的反应历程为(*表示吸附态):
的反应历程为(*表示吸附态):化学吸附:
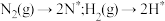 ;
;表面反应:
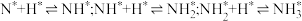 ;
;脱附:

其中,
 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中,常用工艺条件,
 作催化剂,控制温度
作催化剂,控制温度 ,压强
,压强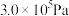 ,原料中
,原料中 和
和 物质的量之比为
物质的量之比为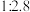 。
。①分析说明原料气中
 过量的理由
过量的理由②关于合成氨工艺的下列理解,正确的是
A.控制温度(
 )远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率B.当温度、压强一定时,在原料气(
 和
和 的比例不变)中添加少量惰性气体,有利于提高平衡转化率
的比例不变)中添加少量惰性气体,有利于提高平衡转化率C.基于
 有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行D.分离空气可得
 ,通过天然气和水蒸气转化可得
,通过天然气和水蒸气转化可得 ,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。(3)
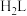 为某邻苯二酚类配体,其
为某邻苯二酚类配体,其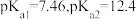 。常温下构建
。常温下构建 溶液体系,其中
溶液体系,其中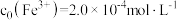 ,
,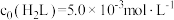 。体系中含
。体系中含 物种的组分分布系数
物种的组分分布系数 与
与 的关系如图所示,分布系数
的关系如图所示,分布系数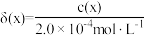 。
。
 时,
时,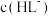
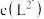 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)②
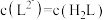 时,
时,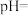
③当
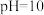 时,参与配位的
时,参与配位的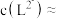
 (写出计算过程)。
(写出计算过程)。
您最近一年使用:0次
名校
解题方法
6 .  不仅是一种温室气体,也是一种来源广泛且廉价易得的碳资源,可通过热化学、电化学等方法再利用。其中甲烷干重整反应可以将两类重要的温室气体
不仅是一种温室气体,也是一种来源广泛且廉价易得的碳资源,可通过热化学、电化学等方法再利用。其中甲烷干重整反应可以将两类重要的温室气体 和
和 进行重整,涉及主要反应如下:
进行重整,涉及主要反应如下:
反应I: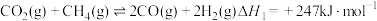
反应Ⅱ:
(1)若恒温、恒压的密闭容器中只发生反应I,下列能说明反应已达到化学平衡状态的是______。
(2)恒温刚性密闭容器中,按 投料,初始总压3MPa,达到平衡状态时测得
投料,初始总压3MPa,达到平衡状态时测得 和
和 转化率分别为60%、40%。计算该温度下反应I的压强平衡常数
转化率分别为60%、40%。计算该温度下反应I的压强平衡常数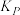 =
=______ 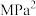 (用各物质的分压代替物质的量浓度计算,分压=总压×物质的量分数)。
(用各物质的分压代替物质的量浓度计算,分压=总压×物质的量分数)。
(3)某研究小组为了评估甲烷干重整反应中不同催化剂的性能差异,在常压、催化剂作用下,按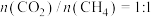 投料,不同温度下反应相同时间,测得
投料,不同温度下反应相同时间,测得 的转化率(柱形图)和产物
的转化率(柱形图)和产物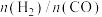 (
( )如图所示。请分析产物
)如图所示。请分析产物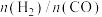 随温度变化的原因(不考虑催化剂失活)
随温度变化的原因(不考虑催化剂失活)______ 。 ;
;
(b) 。因此该小组借助X射线衍射(如图)定性评估催化剂的积碳情况。已知积碳会在
。因此该小组借助X射线衍射(如图)定性评估催化剂的积碳情况。已知积碳会在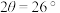 出现衍射峰,下列说法正确的是______。
出现衍射峰,下列说法正确的是______。
(5)该研究小组查阅资料发现还可利用电解还原 ,电解过程中常需要调控溶液pH以实现有效转化。现有1.0L
,电解过程中常需要调控溶液pH以实现有效转化。现有1.0L
 溶液,在298K下加入醋酸钾固体将
溶液,在298K下加入醋酸钾固体将 调至
调至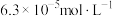 ,忽略溶液体积变化,所加醋酸钾固体的质量为
,忽略溶液体积变化,所加醋酸钾固体的质量为______ g。[已知:298K时, ]
]
 不仅是一种温室气体,也是一种来源广泛且廉价易得的碳资源,可通过热化学、电化学等方法再利用。其中甲烷干重整反应可以将两类重要的温室气体
不仅是一种温室气体,也是一种来源广泛且廉价易得的碳资源,可通过热化学、电化学等方法再利用。其中甲烷干重整反应可以将两类重要的温室气体 和
和 进行重整,涉及主要反应如下:
进行重整,涉及主要反应如下:反应I:
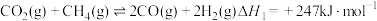
反应Ⅱ:

(1)若恒温、恒压的密闭容器中只发生反应I,下列能说明反应已达到化学平衡状态的是______。
| A.容器内气体密度不再发生变化 |
B. 和CO的物质的量之和不变 和CO的物质的量之和不变 |
C.化学反应速率 |
D.断裂4mol 键的同时生成2mol 键的同时生成2mol 键 键 |
(2)恒温刚性密闭容器中,按
 投料,初始总压3MPa,达到平衡状态时测得
投料,初始总压3MPa,达到平衡状态时测得 和
和 转化率分别为60%、40%。计算该温度下反应I的压强平衡常数
转化率分别为60%、40%。计算该温度下反应I的压强平衡常数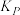 =
=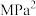 (用各物质的分压代替物质的量浓度计算,分压=总压×物质的量分数)。
(用各物质的分压代替物质的量浓度计算,分压=总压×物质的量分数)。(3)某研究小组为了评估甲烷干重整反应中不同催化剂的性能差异,在常压、催化剂作用下,按
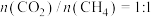 投料,不同温度下反应相同时间,测得
投料,不同温度下反应相同时间,测得 的转化率(柱形图)和产物
的转化率(柱形图)和产物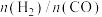 (
( )如图所示。请分析产物
)如图所示。请分析产物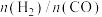 随温度变化的原因(不考虑催化剂失活)
随温度变化的原因(不考虑催化剂失活)
 ;
;(b)
 。因此该小组借助X射线衍射(如图)定性评估催化剂的积碳情况。已知积碳会在
。因此该小组借助X射线衍射(如图)定性评估催化剂的积碳情况。已知积碳会在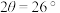 出现衍射峰,下列说法正确的是______。
出现衍射峰,下列说法正确的是______。
| A.碳附着在催化剂表面,使得活性位点与反应物之间的接触受阻,所以催化活性受到抑制 |
| B.一般甲烷干重整的反应温度都很高,因此副反应a很可能是实际过程中产生积碳的主要原因 |
| C.对比三种催化剂的X射线衍射结果可发现Ir型催化剂没有明显积碳,能在甲烷干重整过程中保持高稳定性 |
| D.该小组进一步评估新型金属复合催化剂(H型和M型)的积碳情况,将反应后的催化剂加热至恒重后,发现H型和M型催化剂的重量损失分别为16.7%和10.2%,这表明H型催化剂能在甲烷干重整过程中保持更高的稳定性 |
(5)该研究小组查阅资料发现还可利用电解还原
 ,电解过程中常需要调控溶液pH以实现有效转化。现有1.0L
,电解过程中常需要调控溶液pH以实现有效转化。现有1.0L
 溶液,在298K下加入醋酸钾固体将
溶液,在298K下加入醋酸钾固体将 调至
调至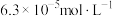 ,忽略溶液体积变化,所加醋酸钾固体的质量为
,忽略溶液体积变化,所加醋酸钾固体的质量为 ]
]
您最近一年使用:0次
名校
解题方法
7 . 利用化学反应原理分析指导工业生产具有重要的现实意义,回答下列问题。___________ 。
(2)合成氨的反应,T1℃时在容积为2L的恒容密闭容器中通入2molN2和5molH2发生反应。5min时反应达到平衡状态,达平衡时N2(g)的转化率为50%,求:
①0~5min内该反应的平均速率v(H2)=___________ mol/(L•min);平衡常数K=___________ 。___________ (填序号)。
a.升高温度 b.将平衡体系中的NH3(g)分离出来
c.减小容器的体积增大体系压强 d.加入合适的催化剂
(3)泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式___________ 。
(2)合成氨的反应,T1℃时在容积为2L的恒容密闭容器中通入2molN2和5molH2发生反应。5min时反应达到平衡状态,达平衡时N2(g)的转化率为50%,求:
①0~5min内该反应的平均速率v(H2)=
②相同条件下,改变反应物的起始通入量,某时刻测得N2、H2、NH3的物质的量分别为2mol、4mol、2mol,则此时反应达到平衡状态 ),v正
),v正
a.升高温度 b.将平衡体系中的NH3(g)分离出来
c.减小容器的体积增大体系压强 d.加入合适的催化剂
(3)泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式
您最近一年使用:0次
8 . 含硫化合物在能源、材料及环境等工业领域均有广泛的应用。
Ⅰ.工业废气 分解可制取
分解可制取 。
。
(1)已知热化学方程式:
ⅰ.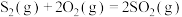

ⅱ.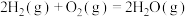

ⅲ.

 热分解反应
热分解反应 的
的
___________ (用含 、
、 、
、 的式子表示)。
的式子表示)。
(2)一定温度下,2mol 在体积为VL的恒容密闭容器中发生上述分解反应,ts时
在体积为VL的恒容密闭容器中发生上述分解反应,ts时 的产率为40%,则0~ts内
的产率为40%,则0~ts内 的平均分解速率为
的平均分解速率为___________  ;
; 充分分解达到平衡时,容器中
充分分解达到平衡时,容器中 和
和 的分压相等,则该温度下的平衡常数
的分压相等,则该温度下的平衡常数
___________ 。
Ⅱ.KSCN可用于镀铬工业。常温下,用KSCN配制电镀液,溶液中 与
与 发生第一、二步络合的反应如下:
发生第一、二步络合的反应如下:
ⅳ.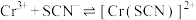
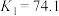
ⅴ.

(3)根据以上络合反应,下列说法正确的有___________(填字母)。
(4)常温下,某研究小组配制了起始浓度 、
、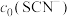 不同的系列溶液,测得平衡时
不同的系列溶液,测得平衡时 、
、 、
、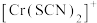 的浓度
的浓度 (含铬微粒)随
(含铬微粒)随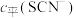 的变化曲线如图所示,平衡后其他含铬微粒
的变化曲线如图所示,平衡后其他含铬微粒 (3≤x≤6,图中未画出)总浓度为amol/L。
(3≤x≤6,图中未画出)总浓度为amol/L。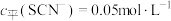 时,图中含铬微粒按浓度由大到小的顺序为
时,图中含铬微粒按浓度由大到小的顺序为___________ ;A点时,溶液中 的平衡浓度为
的平衡浓度为___________ (列出计算式即可)。
②在某电镀工艺中, 的浓度需要在
的浓度需要在 以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺________ (写出计算过程)。
Ⅰ.工业废气
 分解可制取
分解可制取 。
。(1)已知热化学方程式:
ⅰ.
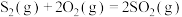

ⅱ.
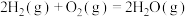

ⅲ.


 热分解反应
热分解反应 的
的
 、
、 、
、 的式子表示)。
的式子表示)。(2)一定温度下,2mol
 在体积为VL的恒容密闭容器中发生上述分解反应,ts时
在体积为VL的恒容密闭容器中发生上述分解反应,ts时 的产率为40%,则0~ts内
的产率为40%,则0~ts内 的平均分解速率为
的平均分解速率为 ;
; 充分分解达到平衡时,容器中
充分分解达到平衡时,容器中 和
和 的分压相等,则该温度下的平衡常数
的分压相等,则该温度下的平衡常数
Ⅱ.KSCN可用于镀铬工业。常温下,用KSCN配制电镀液,溶液中
 与
与 发生第一、二步络合的反应如下:
发生第一、二步络合的反应如下:ⅳ.
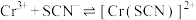
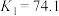
ⅴ.


(3)根据以上络合反应,下列说法正确的有___________(填字母)。
| A.加水稀释后,溶液中离子的总数减少 |
B.加入少量 固体,溶液中含铬微粒总数不变 固体,溶液中含铬微粒总数不变 |
C.反应 的平衡常数 的平衡常数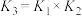 |
D.溶液中 减小, 减小, 与 与 浓度的比值减小 浓度的比值减小 |
(4)常温下,某研究小组配制了起始浓度
 、
、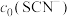 不同的系列溶液,测得平衡时
不同的系列溶液,测得平衡时 、
、 、
、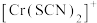 的浓度
的浓度 (含铬微粒)随
(含铬微粒)随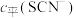 的变化曲线如图所示,平衡后其他含铬微粒
的变化曲线如图所示,平衡后其他含铬微粒 (3≤x≤6,图中未画出)总浓度为amol/L。
(3≤x≤6,图中未画出)总浓度为amol/L。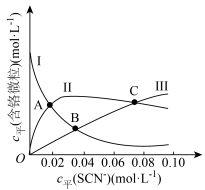
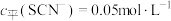 时,图中含铬微粒按浓度由大到小的顺序为
时,图中含铬微粒按浓度由大到小的顺序为 的平衡浓度为
的平衡浓度为②在某电镀工艺中,
 的浓度需要在
的浓度需要在 以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
您最近一年使用:0次
解题方法
9 . 常温下,向 、
、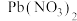 和
和 的混合液中滴加
的混合液中滴加 溶液,
溶液,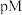 与
与 的关系如下图所示,已知:
的关系如下图所示,已知: ,
,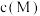 代表
代表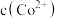 、
、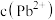 或
或 ;
; ;当被沉淀的离子的物质的量浓度小于
;当被沉淀的离子的物质的量浓度小于 时,认为该离子已沉淀完全。下列叙述正确的是
时,认为该离子已沉淀完全。下列叙述正确的是
 、
、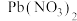 和
和 的混合液中滴加
的混合液中滴加 溶液,
溶液,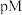 与
与 的关系如下图所示,已知:
的关系如下图所示,已知: ,
,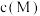 代表
代表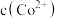 、
、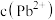 或
或 ;
; ;当被沉淀的离子的物质的量浓度小于
;当被沉淀的离子的物质的量浓度小于 时,认为该离子已沉淀完全。下列叙述正确的是
时,认为该离子已沉淀完全。下列叙述正确的是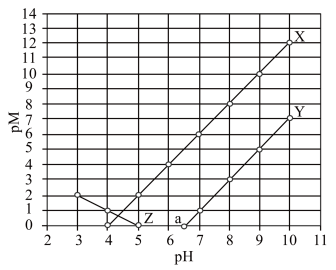
A.常温下,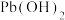 的 的 |
B. 、 、 分别代表 分别代表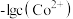 、 、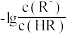 与 与 的关系 的关系 |
C.图中 点对应溶液的 点对应溶液的 为6.5,此时溶液中 为6.5,此时溶液中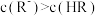 |
D.通过调节溶液 无法分离浓度均为 无法分离浓度均为 的 的 、 、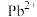 混合溶液 混合溶液 |
您最近一年使用:0次
名校
解题方法
10 . Ⅰ、按要求回答下列问题:
(1)常温下,有关下列四种溶液的说法正确的是___________。
(2)已知25℃,NH3·H2O的Kb=1.8×10-5,若氨水的浓度为2.0mol·L-1,溶液中的c(OH−)=___________ mol·L−1。
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
Ⅱ、氢气可以用于合成甲醇的反应为CO(g)+2H2(g) CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:
CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:___________ (填“>”“<”或“=”)0。
②写出一条可同时提高反应速率和H2平衡转化率的措施:___________ 。
③保证该压强不变,向T1温度下, =0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
=0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡___________ (填“正向”“逆向”或“不”)移动。
(1)常温下,有关下列四种溶液的说法正确的是___________。
| ① | ② | ③ | ④ |
| 0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
| A.由水电离出的c(H+):③>① |
| B.①稀释到原来的100倍,pH与②相同 |
C.①与③混合,若溶液pH=7,则溶液中c(NH )>c(Cl-) )>c(Cl-) |
| D.②与④等体积混合,混合溶液的pH>7 |
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=Ⅱ、氢气可以用于合成甲醇的反应为CO(g)+2H2(g)
 CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:
CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示: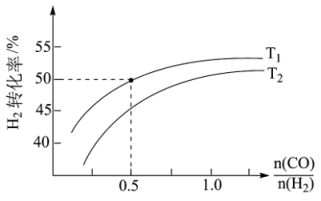
②写出一条可同时提高反应速率和H2平衡转化率的措施:
③保证该压强不变,向T1温度下,
 =0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
=0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
您最近一年使用:0次



