解题方法
1 . 我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和,而研发 的碳捕捉和碳利用技术则是关键。
的碳捕捉和碳利用技术则是关键。
(1)在一定温度下,向某恒容容器中充入 和
和 仅发生反应:
仅发生反应:
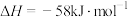 。下列情况表明该反应已达到平衡状态的是__________(填标号)。
。下列情况表明该反应已达到平衡状态的是__________(填标号)。
(2)常温下,以 溶液作
溶液作 捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品
捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品 。某浓度碳酸钠溶液的pH随温度变化的关系如下图所示:
。某浓度碳酸钠溶液的pH随温度变化的关系如下图所示:

① 溶液呈碱性的原因是
溶液呈碱性的原因是__________ (用离子方程式表示)。
②根据上图信息判断,溶液中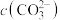 最大的是
最大的是______ (选填“a”、“b”、“c”)。
水的电离程度最大的是______ (选填“a”、“b”、“c”)。
b→c段pH降低的主要原因__________ 。
(3)用 溶液将
溶液将 固体全都转化为
固体全都转化为 ,再过滤,所用的
,再过滤,所用的 溶液的物质的量浓度至少为
溶液的物质的量浓度至少为__________  。[已知:常温下
。[已知:常温下 ,
, ;忽略溶液体积变化]
;忽略溶液体积变化]
(4)t℃时,由 与
与 或
或 配制一组总含碳微粒浓度为
配制一组总含碳微粒浓度为 的混合溶液,混合体系中部分物种的浓度的负对数
的混合溶液,混合体系中部分物种的浓度的负对数 与pH关系如图所示。
与pH关系如图所示。

①该条件下, 的
的
__________ 。
②图中 的溶液中,除
的溶液中,除 外的离子浓度从大到小的顺序为
外的离子浓度从大到小的顺序为__________ 。
③图中 时,混合体系中离子浓度最高的物种为
时,混合体系中离子浓度最高的物种为__________ 。
 的碳捕捉和碳利用技术则是关键。
的碳捕捉和碳利用技术则是关键。(1)在一定温度下,向某恒容容器中充入
 和
和 仅发生反应:
仅发生反应:
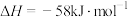 。下列情况表明该反应已达到平衡状态的是__________(填标号)。
。下列情况表明该反应已达到平衡状态的是__________(填标号)。A. |
| B.混合气体的密度保持不变 |
| C.混合气体的平均摩尔质量保持不变 |
D. |
(2)常温下,以
 溶液作
溶液作 捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品
捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品 。某浓度碳酸钠溶液的pH随温度变化的关系如下图所示:
。某浓度碳酸钠溶液的pH随温度变化的关系如下图所示:
①
 溶液呈碱性的原因是
溶液呈碱性的原因是②根据上图信息判断,溶液中
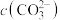 最大的是
最大的是水的电离程度最大的是
b→c段pH降低的主要原因
(3)用
 溶液将
溶液将 固体全都转化为
固体全都转化为 ,再过滤,所用的
,再过滤,所用的 溶液的物质的量浓度至少为
溶液的物质的量浓度至少为 。[已知:常温下
。[已知:常温下 ,
, ;忽略溶液体积变化]
;忽略溶液体积变化](4)t℃时,由
 与
与 或
或 配制一组总含碳微粒浓度为
配制一组总含碳微粒浓度为 的混合溶液,混合体系中部分物种的浓度的负对数
的混合溶液,混合体系中部分物种的浓度的负对数 与pH关系如图所示。
与pH关系如图所示。
①该条件下,
 的
的
②图中
 的溶液中,除
的溶液中,除 外的离子浓度从大到小的顺序为
外的离子浓度从大到小的顺序为③图中
 时,混合体系中离子浓度最高的物种为
时,混合体系中离子浓度最高的物种为
您最近一年使用:0次
名校
解题方法
2 . “吃饺子要蘸醋”是很多中国人传统的饮食习惯,我们对醋酸的使用有着悠久的历史。
(1) 的醋酸和盐酸各
的醋酸和盐酸各 分别稀释至
分别稀释至 ,所得醋酸的
,所得醋酸的
_______ (填“>”“<”或“=”)所得盐酸的 。
。
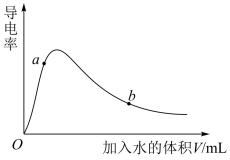
(2)取 冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。
冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。
①由水电离出的氢离子 :a
:a_______ b(填“>”“<”或“=”)。
②使图中b点对应的溶液中 增大、
增大、 减小,可采用的方法是
减小,可采用的方法是_______ (填标号)。
A.加入 B.加入
B.加入 固体 C.加入浓硫酸 D.加入
固体 C.加入浓硫酸 D.加入 固体
固体
(3)向面食中加入适量的醋可以中和其中过量的食用碱而改善口感,已知 时,三种弱酸的电离平衡常数如下表,写出过量醋酸与
时,三种弱酸的电离平衡常数如下表,写出过量醋酸与 溶液反应的离子方程式:
溶液反应的离子方程式:_______ ;判断 结合质子能力由大到小顺序为
结合质子能力由大到小顺序为_______ 。
(4)吃醋虽好但不宜过量,不然容易造成牙齿酸软,甚至引发龋齿,牙齿的主要成分是羟基磷灰石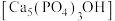 ,市面上含氟牙膏常添加了
,市面上含氟牙膏常添加了 来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因:
来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因:_______ [已知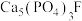 难溶于酸]。
难溶于酸]。
(5)常温下,某同学取 物质的量浓度为
物质的量浓度为 的醋酸,向其中滴入
的醋酸,向其中滴入
 溶液,当滴入的
溶液,当滴入的 溶液的体积为
溶液的体积为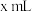 ,溶液呈中性,则醋酸的电离平衡常数
,溶液呈中性,则醋酸的电离平衡常数
_______ (用含x的代数式表示)。

(1)
 的醋酸和盐酸各
的醋酸和盐酸各 分别稀释至
分别稀释至 ,所得醋酸的
,所得醋酸的
 。
。(2)取
 冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。
冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。①由水电离出的氢离子
 :a
:a②使图中b点对应的溶液中
 增大、
增大、 减小,可采用的方法是
减小,可采用的方法是A.加入
 B.加入
B.加入 固体 C.加入浓硫酸 D.加入
固体 C.加入浓硫酸 D.加入 固体
固体(3)向面食中加入适量的醋可以中和其中过量的食用碱而改善口感,已知
 时,三种弱酸的电离平衡常数如下表,写出过量醋酸与
时,三种弱酸的电离平衡常数如下表,写出过量醋酸与 溶液反应的离子方程式:
溶液反应的离子方程式: 结合质子能力由大到小顺序为
结合质子能力由大到小顺序为| 弱酸 |  |  |  |
| 电离平衡常数 | 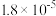 | 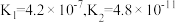 | 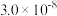 |
(4)吃醋虽好但不宜过量,不然容易造成牙齿酸软,甚至引发龋齿,牙齿的主要成分是羟基磷灰石
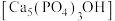 ,市面上含氟牙膏常添加了
,市面上含氟牙膏常添加了 来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因:
来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因: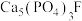 难溶于酸]。
难溶于酸]。(5)常温下,某同学取
 物质的量浓度为
物质的量浓度为 的醋酸,向其中滴入
的醋酸,向其中滴入
 溶液,当滴入的
溶液,当滴入的 溶液的体积为
溶液的体积为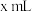 ,溶液呈中性,则醋酸的电离平衡常数
,溶液呈中性,则醋酸的电离平衡常数
您最近一年使用:0次
2024-02-26更新
|
118次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
3 . 下列实验事实不能用勒夏特列原理来解释的是
A.用 与稀硫酸制氢气时,为加快反应速率,将锌片换成锌粉 与稀硫酸制氢气时,为加快反应速率,将锌片换成锌粉 |
B.向 溶液中加入铁粉,溶液颜色变浅 溶液中加入铁粉,溶液颜色变浅 |
C.配制 溶液时将 溶液时将 晶体溶在浓盐酸中再加水稀释到所需浓度 晶体溶在浓盐酸中再加水稀释到所需浓度 |
D.用 溶液清洗油污时,加热可以增强去污效果 溶液清洗油污时,加热可以增强去污效果 |
您最近一年使用:0次
2024-02-26更新
|
111次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期期末考试化学试题
解题方法
4 . 硫化氢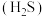 既是一种剧毒且高腐蚀性气体,又是蕴含丰富氢能和硫元素的宝贵资源。
既是一种剧毒且高腐蚀性气体,又是蕴含丰富氢能和硫元素的宝贵资源。
I. 的处理
的处理
(1)处理某种废气中含有的 ,是将废气与空气混合通入
,是将废气与空气混合通入 、
、 、
、 的混合液中,其部分转化过程如图所示。
的混合液中,其部分转化过程如图所示。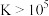 时反应进行的较完全。已知:
时反应进行的较完全。已知: 时
时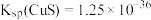 ,
, 的
的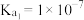 ,
,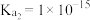 ,则
,则 时过程ii中的反应
时过程ii中的反应____________ (填“能”或“不能”)进行完全。
②过程iii中发生反应的离子方程式为________________________________________
Ⅱ. 的综合利用
的综合利用
(2)根据文献,将 和
和 的混合气体导入石英管反应器热解(一边进料,另一边出料),得到
的混合气体导入石英管反应器热解(一边进料,另一边出料),得到 和
和 ,反应为
,反应为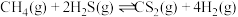 。在
。在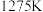 、
、 反应条件下,将物质的量分数之比为
反应条件下,将物质的量分数之比为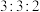 的
的 、
、 、
、 混合气体进行甲烷处理硫化氢反应,平衡时混合气体中
混合气体进行甲烷处理硫化氢反应,平衡时混合气体中 的分压与
的分压与 的分压相同,
的分压相同, 的平衡转化率为
的平衡转化率为_____________ (保留小数点后一位),平衡常数
________  (以分压表示,分压
(以分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。
(3)通过电化学循环法可将 转化为
转化为 和
和 ,如图所示,其中氧化过程发生两步反应:
,如图所示,其中氧化过程发生两步反应: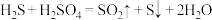 、
、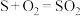 。
。____________________________________ ;
②理论上,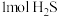 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为_____________ 。
(4)工业上可以通过硫化氢分解制得 和硫蒸气。在某密闭容器中充入
和硫蒸气。在某密闭容器中充入 气体,发生反应:
气体,发生反应: ,
, 气体的平衡转化率与温度、压强的关系如图所示。
气体的平衡转化率与温度、压强的关系如图所示。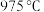 和压强为
和压强为 的条件下,其他条件不变,n点的
的条件下,其他条件不变,n点的 与
与 中较大的是
中较大的是_____________ ,图中m、n点对应温度下的平衡常数:
___________ (填“>”、“=”或“<”) 。
。
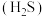 既是一种剧毒且高腐蚀性气体,又是蕴含丰富氢能和硫元素的宝贵资源。
既是一种剧毒且高腐蚀性气体,又是蕴含丰富氢能和硫元素的宝贵资源。I.
 的处理
的处理(1)处理某种废气中含有的
 ,是将废气与空气混合通入
,是将废气与空气混合通入 、
、 、
、 的混合液中,其部分转化过程如图所示。
的混合液中,其部分转化过程如图所示。
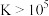 时反应进行的较完全。已知:
时反应进行的较完全。已知: 时
时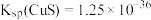 ,
, 的
的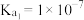 ,
,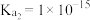 ,则
,则 时过程ii中的反应
时过程ii中的反应②过程iii中发生反应的离子方程式为
Ⅱ.
 的综合利用
的综合利用(2)根据文献,将
 和
和 的混合气体导入石英管反应器热解(一边进料,另一边出料),得到
的混合气体导入石英管反应器热解(一边进料,另一边出料),得到 和
和 ,反应为
,反应为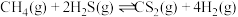 。在
。在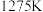 、
、 反应条件下,将物质的量分数之比为
反应条件下,将物质的量分数之比为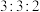 的
的 、
、 、
、 混合气体进行甲烷处理硫化氢反应,平衡时混合气体中
混合气体进行甲烷处理硫化氢反应,平衡时混合气体中 的分压与
的分压与 的分压相同,
的分压相同, 的平衡转化率为
的平衡转化率为
 (以分压表示,分压
(以分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。(3)通过电化学循环法可将
 转化为
转化为 和
和 ,如图所示,其中氧化过程发生两步反应:
,如图所示,其中氧化过程发生两步反应: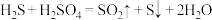 、
、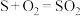 。
。
②理论上,
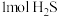 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为(4)工业上可以通过硫化氢分解制得
 和硫蒸气。在某密闭容器中充入
和硫蒸气。在某密闭容器中充入 气体,发生反应:
气体,发生反应: ,
, 气体的平衡转化率与温度、压强的关系如图所示。
气体的平衡转化率与温度、压强的关系如图所示。
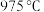 和压强为
和压强为 的条件下,其他条件不变,n点的
的条件下,其他条件不变,n点的 与
与 中较大的是
中较大的是
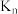 。
。
您最近一年使用:0次
名校
解题方法
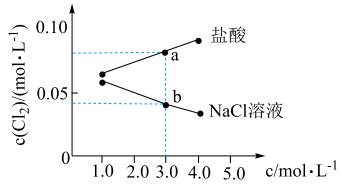
5 . 在相同温度和压强下,研究 分别在不同浓度的盐酸和
分别在不同浓度的盐酸和 溶液中的溶解度(用溶解
溶液中的溶解度(用溶解 的物质的量浓度表示)变化如下图所示。
的物质的量浓度表示)变化如下图所示。
已知 溶解存在下列过程:
溶解存在下列过程:
①
②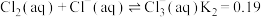
③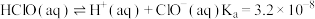
下列说法错误的是
 分别在不同浓度的盐酸和
分别在不同浓度的盐酸和 溶液中的溶解度(用溶解
溶液中的溶解度(用溶解 的物质的量浓度表示)变化如下图所示。
的物质的量浓度表示)变化如下图所示。
已知
 溶解存在下列过程:
溶解存在下列过程:①

②
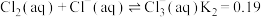
③
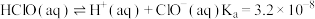
下列说法错误的是
A. 点时, 点时,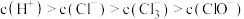 |
B.b点时,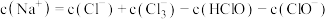 |
C.当 溶液浓度介于 溶液浓度介于 之间时,随 之间时,随 溶液浓度增大, 溶液浓度增大, 溶解度减小,溶液中 溶解度减小,溶液中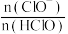 减小 减小 |
D.当盐酸浓度介于 之间时, 之间时, 溶解度随盐酸浓度增大而增大,可能的原因是反应①被抑制,反应②为主要反应从而促进 溶解度随盐酸浓度增大而增大,可能的原因是反应①被抑制,反应②为主要反应从而促进 溶解 溶解 |
您最近一年使用:0次
解题方法
6 . 二氧化碳的捕集和资源化利用是缓解温室效应的重要战略方向。回答下列问题:
Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。总反应可表示为:

该反应一般认为通过如下步骤来实现:
①

②
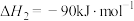
(1)若反应①为慢反应,请在图中接着完善画出反应②的能量变化曲线,标注出相应的物质(含聚集状态)以及总反应的 (含具体数值)
(含具体数值) _______ 。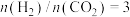 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为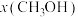 ,在
,在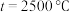 下的
下的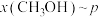 、在
、在 下的
下的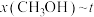 如图所示。
如图所示。_______ (填“a”或“b”),判断的理由_______ 。
(b)当 时,
时, 的平衡转化率
的平衡转化率
_______ 。
Ⅱ.催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。弱电解质的电离度是指弱电解质在溶液中达到电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的>的百分数,用a表示。而在实验测定中,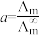 ,
,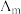 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,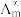 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,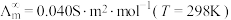 。某小组实验测得
。某小组实验测得 时,
时, 乙酸的
乙酸的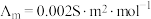 。
。
(3)在298K时,乙酸的电离平衡常数
_______ (列出计算式,不需化简)。
(4)在298K时,几种离子的摩尔电导率如下表所示。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择,最适宜的电解质为_______ (填化学式)。
Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。总反应可表示为:


该反应一般认为通过如下步骤来实现:
①


②

(1)若反应①为慢反应,请在图中接着完善画出反应②的能量变化曲线,标注出相应的物质(含聚集状态)以及总反应的
 (含具体数值)
(含具体数值) 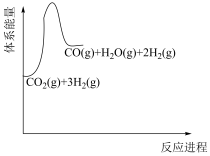
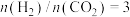 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为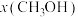 ,在
,在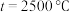 下的
下的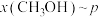 、在
、在 下的
下的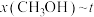 如图所示。
如图所示。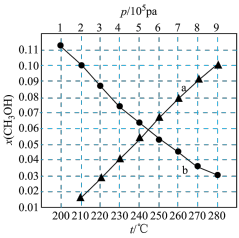
(b)当
 时,
时, 的平衡转化率
的平衡转化率
Ⅱ.催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。弱电解质的电离度是指弱电解质在溶液中达到电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的>的百分数,用a表示。而在实验测定中,
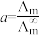 ,
,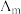 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,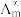 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,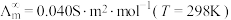 。某小组实验测得
。某小组实验测得 时,
时, 乙酸的
乙酸的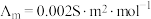 。
。(3)在298K时,乙酸的电离平衡常数

(4)在298K时,几种离子的摩尔电导率如下表所示。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择,最适宜的电解质为
| 离子种类 |  |  |  |  |  |  |
摩尔电导率/( ) ) | 349.82 | 79.80 | 76.34 | 50.18 | 73.52 | 50.11 |
您最近一年使用:0次
名校
解题方法
7 . Ⅰ.甲醇是重要的化工原料之一,也可用作燃料,利用合成气(主要成分为CO、 和
和 )可以合成甲醇,涉及的反应如下:
)可以合成甲醇,涉及的反应如下:
反应i:
反应ii:
(1)关于 叙述不正确的是___________
叙述不正确的是___________
(2)在温度T℃下,向一体积为1L的恒容密闭容器中充入4mol 和8mol
和8mol ,在某催化剂作用下发生反应i和ii,经5min达到平衡,测得
,在某催化剂作用下发生反应i和ii,经5min达到平衡,测得 的物质的量为3mol,起始及平衡时容器的总压强分别为1.5akPa、akPa,则从开始到平衡用
的物质的量为3mol,起始及平衡时容器的总压强分别为1.5akPa、akPa,则从开始到平衡用 的平均反应速率为
的平均反应速率为________  ;反应i的压强平衡常数
;反应i的压强平衡常数
________ 。
Ⅱ.基于新材料及3D打印技术,科学家研制出的微胶囊吸收剂,它能将排放的 以更加安全、廉价和高效的方式处理掉,球形微胶囊内部充入
以更加安全、廉价和高效的方式处理掉,球形微胶囊内部充入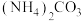 溶液,其原理如图所示。
溶液,其原理如图所示。
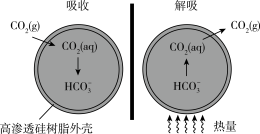
已知: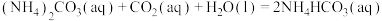
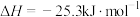
(3)吸收 时宜选用
时宜选用_________ (选填“低温”或“高温”)理由________ 、_________ (列举两点)。
(4)吸收 过程中,胶囊内部溶液的
过程中,胶囊内部溶液的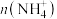
_________ (“增大、减小、或不变”),理由是___________ (不考虑其他副反应及溶液体积变化)。
(5)已知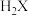 为二元弱酸,常温下用0.1mol/LNaOH溶液滴定20mL0.1mol/L
为二元弱酸,常温下用0.1mol/LNaOH溶液滴定20mL0.1mol/L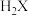 溶液的滴定曲线如下图。
溶液的滴定曲线如下图。
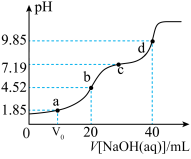
①d点溶液中离子的物质的量浓度由大到小的关系:___________ 。
②b点溶液中:
___________ 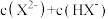 (填“>、<或=”)。
(填“>、<或=”)。
 和
和 )可以合成甲醇,涉及的反应如下:
)可以合成甲醇,涉及的反应如下:反应i:

反应ii:

(1)关于
 叙述不正确的是___________
叙述不正确的是___________A. 属于酸性氧化物 属于酸性氧化物 | B. 的水溶液能导电,故 的水溶液能导电,故 属于电解质 属于电解质 |
C. 的晶体结构属于分子密堆积 的晶体结构属于分子密堆积 | D. 分子中存在 分子中存在 离域大x键 离域大x键 |
(2)在温度T℃下,向一体积为1L的恒容密闭容器中充入4mol
 和8mol
和8mol ,在某催化剂作用下发生反应i和ii,经5min达到平衡,测得
,在某催化剂作用下发生反应i和ii,经5min达到平衡,测得 的物质的量为3mol,起始及平衡时容器的总压强分别为1.5akPa、akPa,则从开始到平衡用
的物质的量为3mol,起始及平衡时容器的总压强分别为1.5akPa、akPa,则从开始到平衡用 的平均反应速率为
的平均反应速率为 ;反应i的压强平衡常数
;反应i的压强平衡常数
Ⅱ.基于新材料及3D打印技术,科学家研制出的微胶囊吸收剂,它能将排放的
 以更加安全、廉价和高效的方式处理掉,球形微胶囊内部充入
以更加安全、廉价和高效的方式处理掉,球形微胶囊内部充入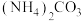 溶液,其原理如图所示。
溶液,其原理如图所示。
已知:
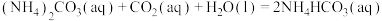
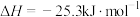
(3)吸收
 时宜选用
时宜选用(4)吸收
 过程中,胶囊内部溶液的
过程中,胶囊内部溶液的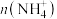
(5)已知
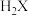 为二元弱酸,常温下用0.1mol/LNaOH溶液滴定20mL0.1mol/L
为二元弱酸,常温下用0.1mol/LNaOH溶液滴定20mL0.1mol/L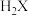 溶液的滴定曲线如下图。
溶液的滴定曲线如下图。
①d点溶液中离子的物质的量浓度由大到小的关系:
②b点溶液中:

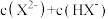 (填“>、<或=”)。
(填“>、<或=”)。
您最近一年使用:0次
解题方法
8 . 下列说法及解释均合理的是
| 选项 | 说法 | 解释 |
| A |  可作“钡餐” 可作“钡餐” |  不溶于水 不溶于水 |
| B | 合成氨工业采用 的高温条件 的高温条件 | 该温度有利于平衡正向移动 |
| C | 侯氏制碱法:饱和氨盐水中通 制 制 |  可溶于水 可溶于水 |
| D | 人体血液中 相对稳定 相对稳定 | 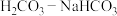 体系可稳定血液 体系可稳定血液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
9 . 实验室研究、日常生活和生产实践中常用到盐类的水解知识。下列事实与水解无关的是
A.实验室盛放 溶液的试剂瓶应使用橡胶塞 溶液的试剂瓶应使用橡胶塞 |
B.在 溶液中加入镁条会产生气泡 溶液中加入镁条会产生气泡 |
| C.处理锅炉水垢中的硫酸钙,可用饱和碳酸钠溶液浸泡,再用酸洗 |
D.将饱和 溶液滴入沸水中制备 溶液滴入沸水中制备 胶体 胶体 |
您最近一年使用:0次
名校
解题方法
10 . 化学反应原理在科研和生产中有广泛的应用:
(1)利用“化学蒸气转移法”制备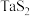 晶体,发生如下反应:
晶体,发生如下反应: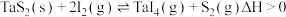 ,若反应(Ⅰ)的平衡常数
,若反应(Ⅰ)的平衡常数 ,向某恒容容器中加入
,向某恒容容器中加入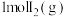 和足量
和足量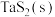 ,
, 的平衡转化率为
的平衡转化率为___________ 。
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为 的一段放入未提纯的
的一段放入未提纯的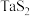 粉末和少量
粉末和少量 ,一段时间后,在温度为
,一段时间后,在温度为 一端得到了纯净
一端得到了纯净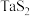 晶体,则温度
晶体,则温度
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。

(3)利用的 的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化为
的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化为 ,然后用一定浓度的
,然后用一定浓度的 溶液进行滴定,所用指示剂为
溶液进行滴定,所用指示剂为___________ ,滴定反应的离子方程式为___________ 。
(4) 时,
时, 的电离常数
的电离常数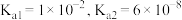 ,则该温度下
,则该温度下 水解反应的平衡常数
水解反应的平衡常数
___________ ,若向 溶液中加入少量
溶液中加入少量 ,则溶液中
,则溶液中 将
将___________ (填“增大”、“减小”或“不变”)。
(1)利用“化学蒸气转移法”制备
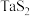 晶体,发生如下反应:
晶体,发生如下反应: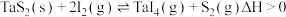 ,若反应(Ⅰ)的平衡常数
,若反应(Ⅰ)的平衡常数 ,向某恒容容器中加入
,向某恒容容器中加入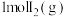 和足量
和足量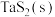 ,
, 的平衡转化率为
的平衡转化率为(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为
 的一段放入未提纯的
的一段放入未提纯的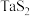 粉末和少量
粉末和少量 ,一段时间后,在温度为
,一段时间后,在温度为 一端得到了纯净
一端得到了纯净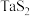 晶体,则温度
晶体,则温度
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)利用的
 的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化为
的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化为 ,然后用一定浓度的
,然后用一定浓度的 溶液进行滴定,所用指示剂为
溶液进行滴定,所用指示剂为(4)
 时,
时, 的电离常数
的电离常数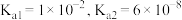 ,则该温度下
,则该温度下 水解反应的平衡常数
水解反应的平衡常数
 溶液中加入少量
溶液中加入少量 ,则溶液中
,则溶液中 将
将
您最近一年使用:0次



