1 . 从锌浸渣(主要含 、
、 ,少量ZnS和
,少量ZnS和 )中提取Ge的流程如下:
)中提取Ge的流程如下:
①锗在硫酸中的存在形式:pH≤2.0时主要为 ,pH为2~7时主要为
,pH为2~7时主要为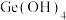 。
。
②常温下, ,
, 。
。
下列说法错误的是
 、
、 ,少量ZnS和
,少量ZnS和 )中提取Ge的流程如下:
)中提取Ge的流程如下:
①锗在硫酸中的存在形式:pH≤2.0时主要为
 ,pH为2~7时主要为
,pH为2~7时主要为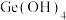 。
。②常温下,
 ,
, 。
。下列说法错误的是
A. 被双氧水氧化的离子方程式 被双氧水氧化的离子方程式 |
B.“中和沉淀”中,所加化合物A可为ZnO或 |
C.常温下,“中和沉淀”时调节溶液pH=4.4,锗元素和铁元素共沉淀,此时滤液中 |
D.从滤液回收 晶体用到的主要仪器有酒精灯、玻璃棒、坩埚、泥三角 晶体用到的主要仪器有酒精灯、玻璃棒、坩埚、泥三角 |
您最近一年使用:0次
解题方法
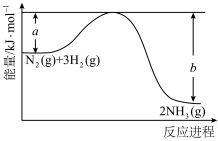
2 . 氨和氨水能与多种金属离子形成配合物,且在生产和生活中都发挥着重要作用。回答下列问题:
(1)合成氨反应的能量变化示意图如图所示,该反应的热化学方程式为_____ 。 显粉红色,
显粉红色, 显橙黄色,
显橙黄色, 显土黄色。
显土黄色。
①基态 的
的 电子轨道表示式为
电子轨道表示式为_____________ 。
②酸性条件下, 和
和 可与
可与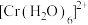 反应,补充完整反应的离子方程式:
反应,补充完整反应的离子方程式:
Ⅰ.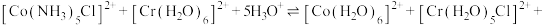
_____________ ;
Ⅱ.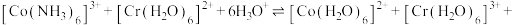
_____________ 。
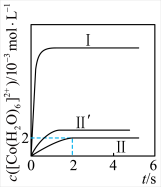
(3)某温度下,对(2)中的反应进行了研究。速率方程为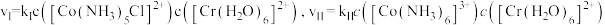 ;保持其他条件不变,分别用浓度相同的
;保持其他条件不变,分别用浓度相同的 和
和 与
与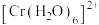 反应得到图中曲线Ⅰ和曲线Ⅱ;用不同浓度的
反应得到图中曲线Ⅰ和曲线Ⅱ;用不同浓度的 与
与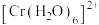 反应得到图中曲线Ⅱ和曲线
反应得到图中曲线Ⅱ和曲线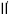 。
。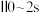 内,
内, 的平均生成速率为
的平均生成速率为_____________  。
。
②下列说法中正确的有_____________ (填选项字母)。
A.平衡后加入 ,反应Ⅰ和反应Ⅱ的
,反应Ⅰ和反应Ⅱ的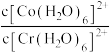 均减小
均减小
B.上述实验中,反应速率都随反应进程逐渐增加
C.上述实验中,体系颜色不再变化则达到平衡状态
(4)向还有未溶解 的
的 饱和溶液中滴加氨水,发生反应
饱和溶液中滴加氨水,发生反应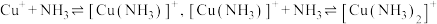 。平衡体系中
。平衡体系中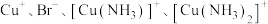 的浓度与
的浓度与 浓度的变化关系如图所示。
浓度的变化关系如图所示。_____________ {填“ ”“
”“ ”“
”“ ”或“
”或“ ”}浓度与
”}浓度与 浓度的变化曲线。
浓度的变化曲线。
② 的溶度积
的溶度积
_______________ 。
③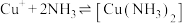 的平衡常数
的平衡常数
___________ 。
(1)合成氨反应的能量变化示意图如图所示,该反应的热化学方程式为
 显粉红色,
显粉红色, 显橙黄色,
显橙黄色, 显土黄色。
显土黄色。①基态
 的
的 电子轨道表示式为
电子轨道表示式为②酸性条件下,
 和
和 可与
可与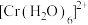 反应,补充完整反应的离子方程式:
反应,补充完整反应的离子方程式:Ⅰ.
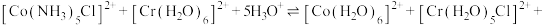
Ⅱ.
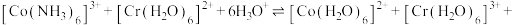
(3)某温度下,对(2)中的反应进行了研究。速率方程为
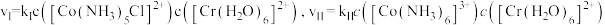 ;保持其他条件不变,分别用浓度相同的
;保持其他条件不变,分别用浓度相同的 和
和 与
与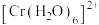 反应得到图中曲线Ⅰ和曲线Ⅱ;用不同浓度的
反应得到图中曲线Ⅰ和曲线Ⅱ;用不同浓度的 与
与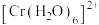 反应得到图中曲线Ⅱ和曲线
反应得到图中曲线Ⅱ和曲线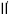 。
。
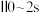 内,
内, 的平均生成速率为
的平均生成速率为 。
。②下列说法中正确的有
A.平衡后加入
 ,反应Ⅰ和反应Ⅱ的
,反应Ⅰ和反应Ⅱ的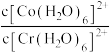 均减小
均减小B.上述实验中,反应速率都随反应进程逐渐增加
C.上述实验中,体系颜色不再变化则达到平衡状态
(4)向还有未溶解
 的
的 饱和溶液中滴加氨水,发生反应
饱和溶液中滴加氨水,发生反应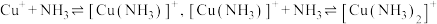 。平衡体系中
。平衡体系中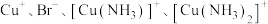 的浓度与
的浓度与 浓度的变化关系如图所示。
浓度的变化关系如图所示。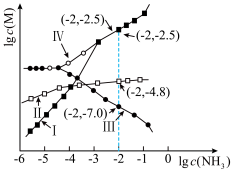
 ”“
”“ ”“
”“ ”或“
”或“ ”}浓度与
”}浓度与 浓度的变化曲线。
浓度的变化曲线。②
 的溶度积
的溶度积
③
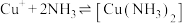 的平衡常数
的平衡常数
您最近一年使用:0次
名校
解题方法
3 . 下列物质属于非电解质的是
A.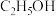 | B. | C. | D.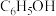 |
您最近一年使用:0次
名校
解题方法
4 . 氟化镁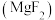 晶体广泛应用在光学、冶金、国防、医疗等领域。
晶体广泛应用在光学、冶金、国防、医疗等领域。
Ⅰ.氟化镁晶胞是长方体,其结构如下图所示:_______ 区。
(2) 晶胞示意图中:
晶胞示意图中:
a.○表示_______ (填离子符号)。
b.离子半径: ,结合离子结构示意图解释原因:
,结合离子结构示意图解释原因:_______ 。
(3)已知 晶胞体积为
晶胞体积为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则其晶体密度
,则其晶体密度
____  (用代数式表示)。
(用代数式表示)。
Ⅱ.一种由 制备
制备 的工艺流程如下:
的工艺流程如下:
已知:i. 易溶于甲醇。
易溶于甲醇。
ii. ,
,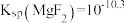 ,
, 。
。
(4)上述流程中,可循环利用的物质是_______ 。
(5)比较相同条件下化学反应速率的大小:① 与
与 ;②
;② 与
与 。
。
a.小组同学预测化学反应速率:①<②,理由是甲基为_____ 基团,导致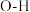 键极性:
键极性: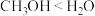 。
。
b.实验表明化学反应速率:①>②,分析其原因可能是_______ 。
(6)上述流程中 开始转化为
开始转化为 所需氟化物的浓度:
所需氟化物的浓度: 。结合沉淀溶解平衡分析原因:
。结合沉淀溶解平衡分析原因:_______ 。
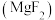 晶体广泛应用在光学、冶金、国防、医疗等领域。
晶体广泛应用在光学、冶金、国防、医疗等领域。Ⅰ.氟化镁晶胞是长方体,其结构如下图所示:

(2)
 晶胞示意图中:
晶胞示意图中:a.○表示
b.离子半径:
 ,结合离子结构示意图解释原因:
,结合离子结构示意图解释原因:(3)已知
 晶胞体积为
晶胞体积为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则其晶体密度
,则其晶体密度
 (用代数式表示)。
(用代数式表示)。Ⅱ.一种由
 制备
制备 的工艺流程如下:
的工艺流程如下:
已知:i.
 易溶于甲醇。
易溶于甲醇。ii.
 ,
,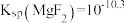 ,
, 。
。(4)上述流程中,可循环利用的物质是
(5)比较相同条件下化学反应速率的大小:①
 与
与 ;②
;② 与
与 。
。a.小组同学预测化学反应速率:①<②,理由是甲基为
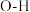 键极性:
键极性: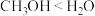 。
。b.实验表明化学反应速率:①>②,分析其原因可能是
(6)上述流程中
 开始转化为
开始转化为 所需氟化物的浓度:
所需氟化物的浓度: 。结合沉淀溶解平衡分析原因:
。结合沉淀溶解平衡分析原因:
您最近一年使用:0次
名校
解题方法
5 . 为实现碳中和目标, 的捕集和转化并实现资源再利用意义重大。
的捕集和转化并实现资源再利用意义重大。
Ⅰ. 的捕集
的捕集
用乙醇胺(简写为 )溶液能有效吸收
)溶液能有效吸收 ,相关反应有:
,相关反应有:
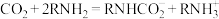

请回答:
(1)可以用测定溶液pH变化测定 吸收速率,其原理(忽略电离速率,结合相关反应解释)是
吸收速率,其原理(忽略电离速率,结合相关反应解释)是___________ 。
(2)常温下用 乙醇胺溶液吸收标准状况下
乙醇胺溶液吸收标准状况下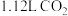 后,测得溶液中
后,测得溶液中 ,则
,则
___________ 。
Ⅱ. 的转化
的转化
二氧化碳可通过催化加氢制甲醇,
反应可表示为: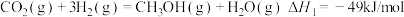 ①
①
同时发生反应: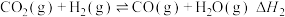 ②
②
(3)已知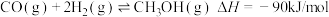 ;则
;则
___________ kJ/mol
(4)恒压密闭容器中,加入2mol 和4mol
和4mol ,发生反应①和②,下列说法正确的是___________。
,发生反应①和②,下列说法正确的是___________。
(5)恒压下, 和
和 以物质的量比
以物质的量比 投料合成甲醇(假设只发生反应①),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出
投料合成甲醇(假设只发生反应①),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出 。请在图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线
。请在图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线___________ 。 通过电化学转化可用于生产其他有机物。
通过电化学转化可用于生产其他有机物。 能在酸性水溶液中通过电催化发生电解,生成
能在酸性水溶液中通过电催化发生电解,生成 。其阴极反应式为
。其阴极反应式为___________ 。
 的捕集和转化并实现资源再利用意义重大。
的捕集和转化并实现资源再利用意义重大。Ⅰ.
 的捕集
的捕集用乙醇胺(简写为
 )溶液能有效吸收
)溶液能有效吸收 ,相关反应有:
,相关反应有: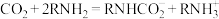

请回答:
(1)可以用测定溶液pH变化测定
 吸收速率,其原理(忽略电离速率,结合相关反应解释)是
吸收速率,其原理(忽略电离速率,结合相关反应解释)是(2)常温下用
 乙醇胺溶液吸收标准状况下
乙醇胺溶液吸收标准状况下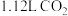 后,测得溶液中
后,测得溶液中 ,则
,则
Ⅱ.
 的转化
的转化二氧化碳可通过催化加氢制甲醇,
反应可表示为:
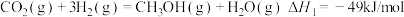 ①
①同时发生反应:
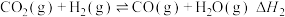 ②
②(3)已知
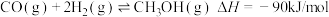 ;则
;则
(4)恒压密闭容器中,加入2mol
 和4mol
和4mol ,发生反应①和②,下列说法正确的是___________。
,发生反应①和②,下列说法正确的是___________。| A.容器内气体的平均摩尔质量不再变化,说明体系内反应达到平衡 |
B.温度升高, 的平衡转化率不一定下降 的平衡转化率不一定下降 |
C.及时将 与反应混合物分离,可提高反应①的速率和甲醇的产率 与反应混合物分离,可提高反应①的速率和甲醇的产率 |
D.平衡后将容器的容积压缩至一半,新平衡的 变小 变小 |
(5)恒压下,
 和
和 以物质的量比
以物质的量比 投料合成甲醇(假设只发生反应①),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出
投料合成甲醇(假设只发生反应①),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出 。请在图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线
。请在图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线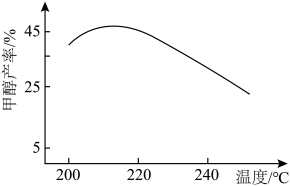
 通过电化学转化可用于生产其他有机物。
通过电化学转化可用于生产其他有机物。 能在酸性水溶液中通过电催化发生电解,生成
能在酸性水溶液中通过电催化发生电解,生成 。其阴极反应式为
。其阴极反应式为
您最近一年使用:0次
解题方法
6 . 下列实验操作和现象,得出的相应结论正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向盛有Fe(OH)3和NiO(OH)的试管中分别滴加浓盐酸 | 盛NiO(OH)的试管中产生黄绿色气体 | 氧化性:NiO(OH)>Fe(OH)3>Cl2 |
| B | 向CuSO4溶液中通入H2S气体 | 出现黑色沉淀(CuS) | Cu2+能使H2S的电离平衡正向移动 |
| C | 乙醇和浓硫酸共热至170℃,将产生的气体通入溴水中 | 溴水褪色 | 产生的气体中只有乙烯和SO2 |
| D | 向Na2HPO4溶液中滴加AgNO3溶液 | 出现黄色沉淀(Ag3PO4) | Na2HPO4的水解程度大于其电离程度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . H₂S是生命体系信号分子,它参与调节神经信号传递,具有舒张血管的功能。已知H₂S的沸点是-60.4℃。
(1)某兴趣小组用CaS与MgCl₂反应制备高纯H₂S,实验装置如图所示(装置A内产生的H₂S气体中含有酸性气体杂质)。_______ 。
②装置B的作用是_______ 。装置C中的Ba(OH)₂可不可以换成NaHS? _______ (填“可以”或“不可以”),若填“可以”,则发生反应的离子方程式是_______ (若填不可以,则忽略此空)。
③玻璃装置骤冷骤热的温差不可超过40℃,否则容易破裂。此实验为防止玻璃装置炸裂而采取的设计是_______ 。
④装置G的作用是_______ 。
(2)NO与H₂S之间的反应及产物非常复杂,研究发现,HNO、HSNO、HSSNO、HS 等均是生理过程的关键物种。已知SSNO⁻参与多个生理过程。其中涉及SSNO⁻形成及变化的可能反应如下:
等均是生理过程的关键物种。已知SSNO⁻参与多个生理过程。其中涉及SSNO⁻形成及变化的可能反应如下:
HSNO+HS →SSNO⁻+HS⁻+H⁺ K1=5.0×10²
→SSNO⁻+HS⁻+H⁺ K1=5.0×10²
HSNO+HS →HSSNO+HS⁻ K2=25.2
→HSSNO+HS⁻ K2=25.2
计算此温度下HSSNO的电离常数Ka=_______ (保留小数点后1位数字)。
(3)H₂S的水溶液是一种重要氮量分析试剂,已知25 ℃时,在0.10 mol⋅L⁻¹ H₂S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S²⁻)关系如图所示(忽略溶液体稠的变化、H₂S的挥发)。pH=13时,溶液中的c(H₂S)+c(HS⁻)=_______ mol⋅L⁻¹。
(1)某兴趣小组用CaS与MgCl₂反应制备高纯H₂S,实验装置如图所示(装置A内产生的H₂S气体中含有酸性气体杂质)。

②装置B的作用是
③玻璃装置骤冷骤热的温差不可超过40℃,否则容易破裂。此实验为防止玻璃装置炸裂而采取的设计是
④装置G的作用是
(2)NO与H₂S之间的反应及产物非常复杂,研究发现,HNO、HSNO、HSSNO、HS
 等均是生理过程的关键物种。已知SSNO⁻参与多个生理过程。其中涉及SSNO⁻形成及变化的可能反应如下:
等均是生理过程的关键物种。已知SSNO⁻参与多个生理过程。其中涉及SSNO⁻形成及变化的可能反应如下:HSNO+HS
 →SSNO⁻+HS⁻+H⁺ K1=5.0×10²
→SSNO⁻+HS⁻+H⁺ K1=5.0×10²HSNO+HS
 →HSSNO+HS⁻ K2=25.2
→HSSNO+HS⁻ K2=25.2计算此温度下HSSNO的电离常数Ka=
(3)H₂S的水溶液是一种重要氮量分析试剂,已知25 ℃时,在0.10 mol⋅L⁻¹ H₂S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S²⁻)关系如图所示(忽略溶液体稠的变化、H₂S的挥发)。pH=13时,溶液中的c(H₂S)+c(HS⁻)=

您最近一年使用:0次
名校
解题方法
8 .  和
和 都是有毒气体,其中
都是有毒气体,其中 通过催化处理可获得氢能,
通过催化处理可获得氢能, 通过回收处理可制备化工原料(如
通过回收处理可制备化工原料(如 )。
)。
请回答下列问题:
(1)工业上一种处理 的反应为
的反应为 。已知部分物质的相对能量如图所示:
。已知部分物质的相对能量如图所示:
_________________  。
。
②在恒容密闭容器中以投料比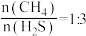 充入反应物发生该反应,下列不能说明该反应达到平衡状态的是
充入反应物发生该反应,下列不能说明该反应达到平衡状态的是_________________ (填字母)。
A.单位时间内断裂 键的数目与断裂
键的数目与断裂 键的数目相等
键的数目相等
B.混合气体的平均相对分子质量不变
C. 与
与 的体积比不变
的体积比不变
D.
(2) 也可通过高温热分解反应获得氢气和单质硫:
也可通过高温热分解反应获得氢气和单质硫: ,不同压强下,在密闭容器中进行该反应,测得平衡时
,不同压强下,在密闭容器中进行该反应,测得平衡时 的体积分数与温度、压强的关系如图所示:
的体积分数与温度、压强的关系如图所示: 由小到大的顺序为
由小到大的顺序为_____________________ 。若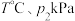 条件下,反应经过
条件下,反应经过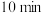 达到平衡,则
达到平衡,则 分压的平均变化速率为
分压的平均变化速率为_________________  (用含
(用含 的代数式表示,下同),该温度下反应的压强平衡常数
的代数式表示,下同),该温度下反应的压强平衡常数
_________________  (
( 用平衡时各物质的分压代替浓度计算,分压
用平衡时各物质的分压代替浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。
(3)燃煤烟气中的 可用于制备
可用于制备 ,
, 在空气中极易被氧化,某课题小组在常温下测得
在空气中极易被氧化,某课题小组在常温下测得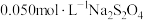 溶液的
溶液的 随时间变化的曲线如图所示。
随时间变化的曲线如图所示。 的第二步电离方程式为
的第二步电离方程式为__________________________ 。
②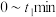 内主要生成
内主要生成 ,常温下,
,常温下, 的
的
_________________  (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
③ 时得到的溶液中所含溶质为
时得到的溶液中所含溶质为_________________ (填化学式)。
 和
和 都是有毒气体,其中
都是有毒气体,其中 通过催化处理可获得氢能,
通过催化处理可获得氢能, 通过回收处理可制备化工原料(如
通过回收处理可制备化工原料(如 )。
)。请回答下列问题:
(1)工业上一种处理
 的反应为
的反应为 。已知部分物质的相对能量如图所示:
。已知部分物质的相对能量如图所示: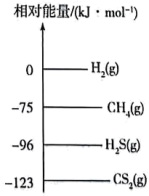

 。
。②在恒容密闭容器中以投料比
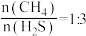 充入反应物发生该反应,下列不能说明该反应达到平衡状态的是
充入反应物发生该反应,下列不能说明该反应达到平衡状态的是A.单位时间内断裂
 键的数目与断裂
键的数目与断裂 键的数目相等
键的数目相等B.混合气体的平均相对分子质量不变
C.
 与
与 的体积比不变
的体积比不变D.

(2)
 也可通过高温热分解反应获得氢气和单质硫:
也可通过高温热分解反应获得氢气和单质硫: ,不同压强下,在密闭容器中进行该反应,测得平衡时
,不同压强下,在密闭容器中进行该反应,测得平衡时 的体积分数与温度、压强的关系如图所示:
的体积分数与温度、压强的关系如图所示: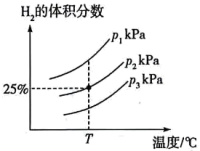
 由小到大的顺序为
由小到大的顺序为 条件下,反应经过
条件下,反应经过 达到平衡,则
达到平衡,则 分压的平均变化速率为
分压的平均变化速率为 (用含
(用含 的代数式表示,下同),该温度下反应的压强平衡常数
的代数式表示,下同),该温度下反应的压强平衡常数
 (
( 用平衡时各物质的分压代替浓度计算,分压
用平衡时各物质的分压代替浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。(3)燃煤烟气中的
 可用于制备
可用于制备 ,
, 在空气中极易被氧化,某课题小组在常温下测得
在空气中极易被氧化,某课题小组在常温下测得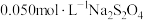 溶液的
溶液的 随时间变化的曲线如图所示。
随时间变化的曲线如图所示。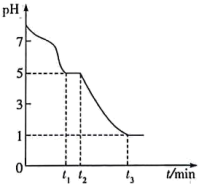
 的第二步电离方程式为
的第二步电离方程式为②
 内主要生成
内主要生成 ,常温下,
,常温下, 的
的
 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。③
 时得到的溶液中所含溶质为
时得到的溶液中所含溶质为
您最近一年使用:0次
解题方法
9 . 酯化反应可用通式表示为 。在酸性条件下,
。在酸性条件下, ,
, 。假设整个过程中无环酯生成,不出现分层现象。
。假设整个过程中无环酯生成,不出现分层现象。
将 投入反应容器中,发生如下反应:
投入反应容器中,发生如下反应:
二聚: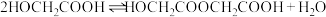
n聚: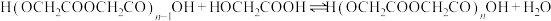
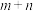 聚:
聚: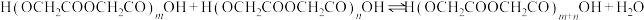 以上反应中每一步的速率常数近似认为相同,记平衡常数
以上反应中每一步的速率常数近似认为相同,记平衡常数 。
。
Ⅰ.反应平衡体系分析
(1) 按系统命名法命名为
按系统命名法命名为______ 。
(2)定义反应程度 ,其中
,其中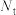 为时刻t时反应体系中-OH或者-COOH的数目,
为时刻t时反应体系中-OH或者-COOH的数目,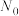 为初始反应体系中-OH或-COOH的数目。若
为初始反应体系中-OH或-COOH的数目。若 ,则
,则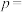
______ 。
(3)最终产物中存在多种聚合度的缩聚产物,平均聚合度 与平衡常数K的关系
与平衡常数K的关系
______ 。
(4)为了使平均聚合度增大,下列方法可行的是______ (填标号)。
A.及时移去 B.升高温度(
B.升高温度( )
)
C.提高 浓度 D.提高
浓度 D.提高 浓度
浓度
E.先将单体预聚合成低聚物,然后将低聚物进一步聚合
Ⅱ.在实际生产过程中,通常会将反应生成的水及时移去。
(5)加入少量 催化与不加入
催化与不加入 催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为
催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为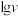 与
与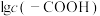 的关系]。
的关系]。
a、b两条曲线的理论斜率之比更接近______ 。 B.
B. C.
C.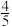 D.
D.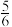
当温度升高时,b线斜率将______ (填“变大”、“变小”或“不变”)。
(6)加入少量 催化时,实验测得反应过程中平均聚合度
催化时,实验测得反应过程中平均聚合度 与反应时间t的关系为:
与反应时间t的关系为: ,其中
,其中 为反应初始时
为反应初始时 浓度,k为常数。0~t时,酯基生成的平均速率
浓度,k为常数。0~t时,酯基生成的平均速率
______ (用k、 、t表示,忽略移去水对溶液体积的影响)。
、t表示,忽略移去水对溶液体积的影响)。
 。在酸性条件下,
。在酸性条件下, ,
, 。假设整个过程中无环酯生成,不出现分层现象。
。假设整个过程中无环酯生成,不出现分层现象。将
 投入反应容器中,发生如下反应:
投入反应容器中,发生如下反应:二聚:
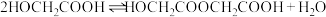
n聚:
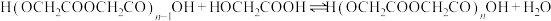
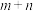 聚:
聚: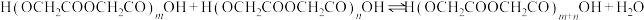 以上反应中每一步的速率常数近似认为相同,记平衡常数
以上反应中每一步的速率常数近似认为相同,记平衡常数 。
。Ⅰ.反应平衡体系分析
(1)
 按系统命名法命名为
按系统命名法命名为(2)定义反应程度
 ,其中
,其中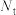 为时刻t时反应体系中-OH或者-COOH的数目,
为时刻t时反应体系中-OH或者-COOH的数目,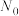 为初始反应体系中-OH或-COOH的数目。若
为初始反应体系中-OH或-COOH的数目。若 ,则
,则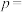
(3)最终产物中存在多种聚合度的缩聚产物,平均聚合度
 与平衡常数K的关系
与平衡常数K的关系
(4)为了使平均聚合度增大,下列方法可行的是
A.及时移去
 B.升高温度(
B.升高温度( )
)C.提高
 浓度 D.提高
浓度 D.提高 浓度
浓度E.先将单体预聚合成低聚物,然后将低聚物进一步聚合
Ⅱ.在实际生产过程中,通常会将反应生成的水及时移去。
(5)加入少量
 催化与不加入
催化与不加入 催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为
催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为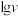 与
与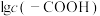 的关系]。
的关系]。a、b两条曲线的理论斜率之比更接近
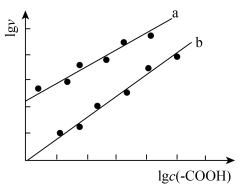
 B.
B. C.
C.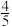 D.
D.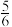
当温度升高时,b线斜率将
(6)加入少量
 催化时,实验测得反应过程中平均聚合度
催化时,实验测得反应过程中平均聚合度 与反应时间t的关系为:
与反应时间t的关系为: ,其中
,其中 为反应初始时
为反应初始时 浓度,k为常数。0~t时,酯基生成的平均速率
浓度,k为常数。0~t时,酯基生成的平均速率
 、t表示,忽略移去水对溶液体积的影响)。
、t表示,忽略移去水对溶液体积的影响)。
您最近一年使用:0次
解题方法
10 . 铁及其化合物在催化、生产中具有重要作用。
(1)以 和
和 为原料,熔融
为原料,熔融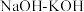 为电解质,纳米
为电解质,纳米 作催化剂,在
作催化剂,在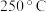 和常压下可实现电化学合成氨。
和常压下可实现电化学合成氨。
①基态 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为___________ 。
②阴极区发生的变化可视为按两步进行,请补充完整。
电极反应式:___________ 和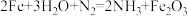 。
。
(2)在 催化作用下,合成氨反应
催化作用下,合成氨反应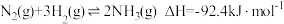 的反应历程为(*表示吸附态):
的反应历程为(*表示吸附态):
化学吸附: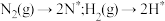 ;
;
表面反应: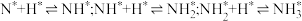 ;
;
脱附:
其中, 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
实际生产中,常用工艺条件, 作催化剂,控制温度
作催化剂,控制温度 ,压强
,压强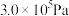 ,原料中
,原料中 和
和 物质的量之比为
物质的量之比为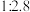 。
。
①分析说明原料气中 过量的理由
过量的理由___________ 。
②关于合成氨工艺的下列理解,正确的是___________ 。
A.控制温度( )远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
B.当温度、压强一定时,在原料气( 和
和 的比例不变)中添加少量惰性气体,有利于提高平衡转化率
的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.基于 有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
D.分离空气可得 ,通过天然气和水蒸气转化可得
,通过天然气和水蒸气转化可得 ,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
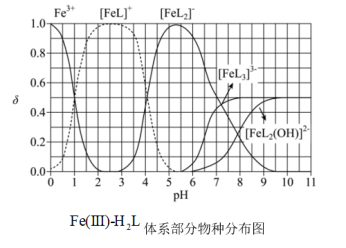
(3)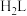 为某邻苯二酚类配体,其
为某邻苯二酚类配体,其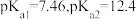 。常温下构建
。常温下构建 溶液体系,其中
溶液体系,其中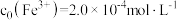 ,
,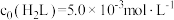 。体系中含
。体系中含 物种的组分分布系数
物种的组分分布系数 与
与 的关系如图所示,分布系数
的关系如图所示,分布系数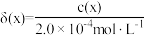 。
。 时,
时,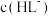
___________ 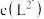 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
②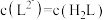 时,
时,
___________ ;
③当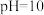 时,参与配位的
时,参与配位的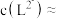
___________  (写出计算过程)。
(写出计算过程)。
(1)以
 和
和 为原料,熔融
为原料,熔融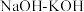 为电解质,纳米
为电解质,纳米 作催化剂,在
作催化剂,在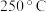 和常压下可实现电化学合成氨。
和常压下可实现电化学合成氨。①基态
 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为②阴极区发生的变化可视为按两步进行,请补充完整。
电极反应式:
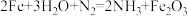 。
。(2)在
 催化作用下,合成氨反应
催化作用下,合成氨反应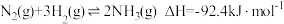 的反应历程为(*表示吸附态):
的反应历程为(*表示吸附态):化学吸附:
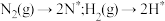 ;
;表面反应:
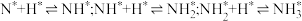 ;
;脱附:

其中,
 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中,常用工艺条件,
 作催化剂,控制温度
作催化剂,控制温度 ,压强
,压强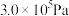 ,原料中
,原料中 和
和 物质的量之比为
物质的量之比为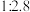 。
。①分析说明原料气中
 过量的理由
过量的理由②关于合成氨工艺的下列理解,正确的是
A.控制温度(
 )远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率B.当温度、压强一定时,在原料气(
 和
和 的比例不变)中添加少量惰性气体,有利于提高平衡转化率
的比例不变)中添加少量惰性气体,有利于提高平衡转化率C.基于
 有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行D.分离空气可得
 ,通过天然气和水蒸气转化可得
,通过天然气和水蒸气转化可得 ,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。(3)
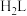 为某邻苯二酚类配体,其
为某邻苯二酚类配体,其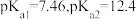 。常温下构建
。常温下构建 溶液体系,其中
溶液体系,其中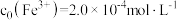 ,
,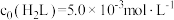 。体系中含
。体系中含 物种的组分分布系数
物种的组分分布系数 与
与 的关系如图所示,分布系数
的关系如图所示,分布系数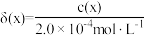 。
。
 时,
时,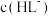
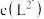 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)②
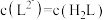 时,
时,
③当
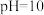 时,参与配位的
时,参与配位的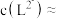
 (写出计算过程)。
(写出计算过程)。
您最近一年使用:0次



