名校
解题方法
1 . 湿法提银工艺中,浸出的Ag+需加入Cl-进行沉淀。25℃时,平衡体系中含Ag微粒的分布系数δ[如δ(AgCl )=
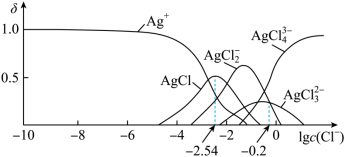
)=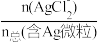 ]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgCl)]=-9.75。下列叙述错误的是
]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgCl)]=-9.75。下列叙述错误的是
 )=
)=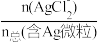 ]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgCl)]=-9.75。下列叙述错误的是
]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgCl)]=-9.75。下列叙述错误的是
| A.AgCl溶解度随c(Cl-)增大而不断减小 |
| B.沉淀最彻底时,溶液中c(Ag+)=10-7.21mol•L-1 |
C.当c(Cl-)=10-2mol•L-1时,溶液中c(AgCl )>c(Ag+)>c(AgCl )>c(Ag+)>c(AgCl ) ) |
D.25℃时,AgCl +Cl- +Cl- AgCl AgCl 的平衡常数K=100.2 的平衡常数K=100.2 |
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题
(1)工业合成氨是人类科学技术的一项重大突破。迄今为止,人类仍然在追求低成本、高产率的合成氨技术。 ,
,
 ,那么常温下,合成氨反应
,那么常温下,合成氨反应_______ (填“能”或“不能”)自发进行
(2)若将1.0molN2(g)和3.0molH2(g)通入体积为2L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2温度下n(H2)的变化,曲线B表示T1温度下n(NH3)的变化,T2温度下反应到a点恰好达到平衡。_______ (填“>”、“<”或“=”,下同)T2.T1温度下恰好平衡时,曲线B上的点为b(m,n),则m_______ 14,n_______ 1。
②T2温度下,若某时刻容器内气体的压强为起始时的70%,则此时v(正)_______ (填“>”、“<”或“=”)v(逆)。计算T2温度下,Kc=_______ 。
(3)常温下,Hg2+与Cl-的配合物存在如下平衡: ,含Hg微粒的分布系数δ与lgc(Cl-)的关系如下图所示:
,含Hg微粒的分布系数δ与lgc(Cl-)的关系如下图所示:
图中能代表HgCl 和HgCl+曲线分别是
和HgCl+曲线分别是_______ 和_______ (填字母),曲线A和曲线C交点的横坐标为_______ 。
(4)羟基自由基(·OH)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种将苯酚氧化为CO2和H2O的原电池-电解池组合装置,以实现发电、环保二位一体。_______ 。
(1)工业合成氨是人类科学技术的一项重大突破。迄今为止,人类仍然在追求低成本、高产率的合成氨技术。
 ,
,
 ,那么常温下,合成氨反应
,那么常温下,合成氨反应(2)若将1.0molN2(g)和3.0molH2(g)通入体积为2L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2温度下n(H2)的变化,曲线B表示T1温度下n(NH3)的变化,T2温度下反应到a点恰好达到平衡。

②T2温度下,若某时刻容器内气体的压强为起始时的70%,则此时v(正)
(3)常温下,Hg2+与Cl-的配合物存在如下平衡:
 ,含Hg微粒的分布系数δ与lgc(Cl-)的关系如下图所示:
,含Hg微粒的分布系数δ与lgc(Cl-)的关系如下图所示:

图中能代表HgCl
 和HgCl+曲线分别是
和HgCl+曲线分别是(4)羟基自由基(·OH)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种将苯酚氧化为CO2和H2O的原电池-电解池组合装置,以实现发电、环保二位一体。

您最近一年使用:0次
解题方法
3 . 一定条件下,水气变换反应CO+H2O CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
Ⅰ.HCOOH CO+ H2O (快)
CO+ H2O (快)
Ⅱ.HCOOH CO2+H2 (慢)
CO2+H2 (慢)
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
回答下列问题:
(1)反应Ⅰ正反应速率方程为:v =kc(H+)c(HCOOH),k为反应速率常数。T1温度下,HCOOH电离平衡常数为Ka。当HCOOH平衡浓度为x mol/L时,H+浓度为___________ mol/L,此时反应Ⅰ正反反应速率v=___________ mol/(L·h)(用含 Ka、x和k的代数式表示)。
(2)T2温度下,在密封石英管内完全充满1.0 mol/LHCOOH水溶液,使HCOOH分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。t1时刻测得CO、CO2的浓度分别为0.70mol/L、0.16 mol/L,反应Ⅱ达平衡时,测得H2的浓度为ymol/L。体系达平衡后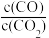 =
=___________ (用含y的代数式表示,下同),反应Ⅱ的平衡常数为___________ 。

相同条件下,若反应起始时溶液中同时还含有0.10 mol/L盐酸,则图示点a、b、c、d中,CO新的浓度峰值点可能是___________ (填标号)。与不含盐酸相比,CO达浓度峰值时,CO2浓度___________ (填“增大”“减小”或“不变”)。 的值
的值___________ (填“增大”“减小”或“不变”)。
 CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:Ⅰ.HCOOH
 CO+ H2O (快)
CO+ H2O (快)Ⅱ.HCOOH
 CO2+H2 (慢)
CO2+H2 (慢)研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
回答下列问题:
(1)反应Ⅰ正反应速率方程为:v =kc(H+)c(HCOOH),k为反应速率常数。T1温度下,HCOOH电离平衡常数为Ka。当HCOOH平衡浓度为x mol/L时,H+浓度为
(2)T2温度下,在密封石英管内完全充满1.0 mol/LHCOOH水溶液,使HCOOH分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。t1时刻测得CO、CO2的浓度分别为0.70mol/L、0.16 mol/L,反应Ⅱ达平衡时,测得H2的浓度为ymol/L。体系达平衡后
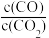 =
=
相同条件下,若反应起始时溶液中同时还含有0.10 mol/L盐酸,则图示点a、b、c、d中,CO新的浓度峰值点可能是
 的值
的值
您最近一年使用:0次
23-24高二上·广东深圳·期末
名校
解题方法
4 . 回答下列问题
(1)某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。
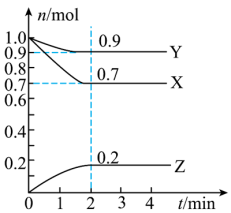
①反应从开始至2min,用Z的浓度变化表示的平均反应速率为v(Z)=___________ 。
②由图中所给数据进行分析,该反应的化学方程式为___________ 。
③下列措施能加快反应速率的有___________ 。
A.恒压时充入He B.恒容时充入He C.恒容时充入X D.升高温度
(2)已知25℃时H3PO4的各级电离平衡常数如表所示:
①NaH2PO4水解反应的离子方程式为___________ ;其水解常数Kh=___________ (保留3位有效数字),NaH2PO4溶液呈___________ 性。(填“酸”、“碱”或“中”)
②计算H2PO +PO
+PO
 2HPO
2HPO 的平衡常数K=
的平衡常数K=___________ (保留2位有效数字)。
(1)某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。

①反应从开始至2min,用Z的浓度变化表示的平均反应速率为v(Z)=
②由图中所给数据进行分析,该反应的化学方程式为
③下列措施能加快反应速率的有
A.恒压时充入He B.恒容时充入He C.恒容时充入X D.升高温度
(2)已知25℃时H3PO4的各级电离平衡常数如表所示:
| 平衡常数 | H3PO4 |
| Ka1 | 8×10-3 |
| Ka2 | 6×10-8 |
| Ka3 | 4×10-13 |
②计算H2PO
 +PO
+PO
 2HPO
2HPO 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
名校
解题方法
5 . 请回答下列问题:
(1)下列事实可以用勒夏特列原理来解释的是______(填标号)。
(2)常温时,向 水溶液中逐滴滴加
水溶液中逐滴滴加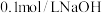 溶液,混合溶液中
溶液,混合溶液中 和
和 的物质的量分数(
的物质的量分数( )随
)随 变化的关系如图所示。
变化的关系如图所示。
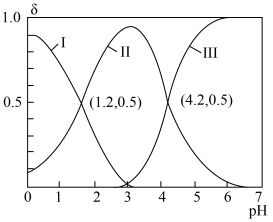
则 溶液中,
溶液中,
______  (填“<”“=”或“>”)。
(填“<”“=”或“>”)。
(3)在25℃时, 的①
的① ②
② ③
③ ④
④ 溶液中,
溶液中, 由小到大的顺序是
由小到大的顺序是______ (填序号)。
(4)某温度时,纯水的 ,将
,将 的硫酸与
的硫酸与 的
的 溶液混合后溶液
溶液混合后溶液 ,需
,需 溶液和硫酸的体积比为
溶液和硫酸的体积比为______ 。
(5)重铬酸钾( ,摩尔质量为
,摩尔质量为 )是重要的氧化剂,称取重铬酸钾试样
)是重要的氧化剂,称取重铬酸钾试样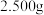 配成
配成 溶液,取出
溶液,取出 于锥形瓶中,向其中加入
于锥形瓶中,向其中加入 和足量碘化钾(铬的还原产物为
和足量碘化钾(铬的还原产物为 ),放于暗处
),放于暗处 。然后加入
。然后加入 水,加入少量淀粉溶液指示剂,用
水,加入少量淀粉溶液指示剂,用 标准溶液滴定(
标准溶液滴定( )。
)。
①滴入标准液之前,锥形瓶中发生反应的离子方程式为____________ 。
②滴定终点的现象是____________ 。
③若实验中共用去 标准液
标准液 ,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参加反应)
,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参加反应)______ (保留两位有效数字)。
(1)下列事实可以用勒夏特列原理来解释的是______(填标号)。
A.工业上生产硫酸时,充入过量的空气以提高 的转化率 的转化率 |
B. ,压缩体积,气体颜色变深 ,压缩体积,气体颜色变深 |
| C.500℃左右比常温下更有利于工业合成氨 |
| D.开启啤酒盖后,瓶中马上泛起大量泡沫 |
(2)常温时,向
 水溶液中逐滴滴加
水溶液中逐滴滴加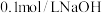 溶液,混合溶液中
溶液,混合溶液中 和
和 的物质的量分数(
的物质的量分数( )随
)随 变化的关系如图所示。
变化的关系如图所示。
则
 溶液中,
溶液中,
 (填“<”“=”或“>”)。
(填“<”“=”或“>”)。(3)在25℃时,
 的①
的① ②
② ③
③ ④
④ 溶液中,
溶液中, 由小到大的顺序是
由小到大的顺序是(4)某温度时,纯水的
 ,将
,将 的硫酸与
的硫酸与 的
的 溶液混合后溶液
溶液混合后溶液 ,需
,需 溶液和硫酸的体积比为
溶液和硫酸的体积比为(5)重铬酸钾(
 ,摩尔质量为
,摩尔质量为 )是重要的氧化剂,称取重铬酸钾试样
)是重要的氧化剂,称取重铬酸钾试样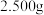 配成
配成 溶液,取出
溶液,取出 于锥形瓶中,向其中加入
于锥形瓶中,向其中加入 和足量碘化钾(铬的还原产物为
和足量碘化钾(铬的还原产物为 ),放于暗处
),放于暗处 。然后加入
。然后加入 水,加入少量淀粉溶液指示剂,用
水,加入少量淀粉溶液指示剂,用 标准溶液滴定(
标准溶液滴定( )。
)。①滴入标准液之前,锥形瓶中发生反应的离子方程式为
②滴定终点的现象是
③若实验中共用去
 标准液
标准液 ,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参加反应)
,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参加反应)
您最近一年使用:0次
解题方法
6 . 丙烯酸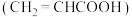 和硫氰酸
和硫氰酸 都是一元酸,已知:
都是一元酸,已知: ,常温下,等体积、
,常温下,等体积、 的两种酸溶液加水稀释,溶液
的两种酸溶液加水稀释,溶液 的变化如图所示,下列叙述正确的是
的变化如图所示,下列叙述正确的是

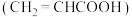 和硫氰酸
和硫氰酸 都是一元酸,已知:
都是一元酸,已知: ,常温下,等体积、
,常温下,等体积、 的两种酸溶液加水稀释,溶液
的两种酸溶液加水稀释,溶液 的变化如图所示,下列叙述正确的是
的变化如图所示,下列叙述正确的是
A. 为 为 稀释的曲线 稀释的曲线 |
| B.加水稀释过程中溶液中的离子浓度都减小 |
C.常温下,a、b两点的两种酸溶液分别与足量金属锌反应,放出 的量: 的量: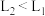 |
| D.加水无限稀释可以使a点移至c点 |
您最近一年使用:0次
解题方法
7 . 下列说法正确的是
A.用碳酸钠溶液浸泡锅炉水垢的原理: |
B. 溶液水解方程式: 溶液水解方程式: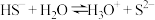 |
C.甲烷的燃烧热可以表示为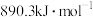 ,则甲烷燃烧的热化学方程式为 ,则甲烷燃烧的热化学方程式为 |
D.氢氧燃料电池(电解质为 溶液)的负极反应式: 溶液)的负极反应式: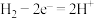 |
您最近一年使用:0次
名校
解题方法
8 . 汞及其化合物广泛应用于医药、冶金及其他精密高新科技领域。
(1)干燥的 固体上通入
固体上通入 可反应制得
可反应制得 和
和 ,反应的化学方程式为
,反应的化学方程式为___________ 。该反应中氧化产物是___________ 。
(2)富氧燃烧烟气中 的脱除主要是通过与
的脱除主要是通过与 反应实现,反应的化学方程式为
反应实现,反应的化学方程式为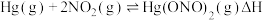
根据实验结果,有研究组提出了 与
与 的可能反应机理:
的可能反应机理:

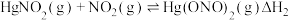

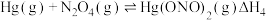
①根据盖斯定律,
___________ (写出一个代数式即可)。
②上述反应体系在一定条件下建立平衡后,下列说法正确的是___________ 。
A.增大 的浓度,可提高
的浓度,可提高 的平衡脱除率
的平衡脱除率
B.升高温度,正反应速率增大,逆反应速率减小
C.恒温恒压下充入 ,可提高原料的平衡转化率
,可提高原料的平衡转化率
D.加入催化剂,可降低反应活化能,提高脱除速率
③在常压、温度范围为15~60℃条件下,将浓度为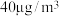 汞蒸气和
汞蒸气和 的
的 气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。 的平均脱除反应速率为
的平均脱除反应速率为___________ 
ⅱ)
___________ 0(填“>”或“<”)
④富氧燃烧烟气中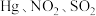 等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于
等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于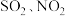 转化为
转化为 而脱除,但随着循环水量的增大,
而脱除,但随着循环水量的增大, 的去除率下降,其原因可能是
的去除率下降,其原因可能是___________ 。 溶液可用于手术刀消毒。
溶液可用于手术刀消毒。 与
与 的混合溶液中主要存在平衡:
的混合溶液中主要存在平衡:

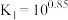
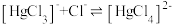
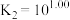
 的
的 溶液中加入
溶液中加入 固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数
固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数 随
随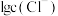 的变化如图所示
的变化如图所示 ]。
]。
①熔融状态的 不能导电,
不能导电, 是
是___________ (填“共价”或“离子”)化合物。
②A点溶液中
___________  。
。
③A点溶液中 的转化率为
的转化率为___________ (列出计算式)。
(1)干燥的
 固体上通入
固体上通入 可反应制得
可反应制得 和
和 ,反应的化学方程式为
,反应的化学方程式为(2)富氧燃烧烟气中
 的脱除主要是通过与
的脱除主要是通过与 反应实现,反应的化学方程式为
反应实现,反应的化学方程式为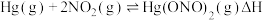
根据实验结果,有研究组提出了
 与
与 的可能反应机理:
的可能反应机理:
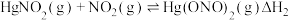

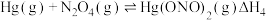
①根据盖斯定律,

②上述反应体系在一定条件下建立平衡后,下列说法正确的是
A.增大
 的浓度,可提高
的浓度,可提高 的平衡脱除率
的平衡脱除率B.升高温度,正反应速率增大,逆反应速率减小
C.恒温恒压下充入
 ,可提高原料的平衡转化率
,可提高原料的平衡转化率D.加入催化剂,可降低反应活化能,提高脱除速率
③在常压、温度范围为15~60℃条件下,将浓度为
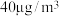 汞蒸气和
汞蒸气和 的
的 气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
 的平均脱除反应速率为
的平均脱除反应速率为
ⅱ)

④富氧燃烧烟气中
 等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于
等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于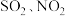 转化为
转化为 而脱除,但随着循环水量的增大,
而脱除,但随着循环水量的增大, 的去除率下降,其原因可能是
的去除率下降,其原因可能是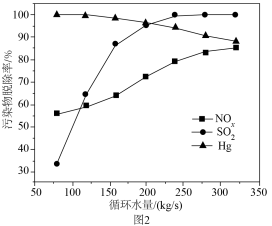
 溶液可用于手术刀消毒。
溶液可用于手术刀消毒。 与
与 的混合溶液中主要存在平衡:
的混合溶液中主要存在平衡:
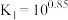
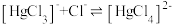
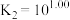
 的
的 溶液中加入
溶液中加入 固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数
固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数 随
随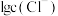 的变化如图所示
的变化如图所示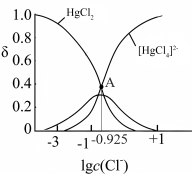
 ]。
]。①熔融状态的
 不能导电,
不能导电, 是
是②A点溶液中

 。
。③A点溶液中
 的转化率为
的转化率为
您最近一年使用:0次
2024-03-01更新
|
443次组卷
|
3卷引用:广东省广州市第二中学2023-2024学年高三上学期期末化学试卷
广东省广州市第二中学2023-2024学年高三上学期期末化学试卷(已下线)大题04 化学反应原理综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)广东省东莞市东华高级中学 东华松山湖高级中学 2024届高三下学期第三次模拟考试 化学试题
解题方法
9 . 在一定温度下,冰醋酸稀释过程中溶液的导电能力变化如图所示,下列判断正确的是


| A.加水前导电能力约为零 |
B.A、B、C三点对应的溶液中, 由小到大的顺序是A>B>C 由小到大的顺序是A>B>C |
C.A、B、C三点对应的溶液中, 电离程度最大的B 电离程度最大的B |
D.若使B点对应的溶液中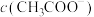 增大、 增大、 增大,可行的方法是加热溶液 增大,可行的方法是加热溶液 |
您最近一年使用:0次
名校
解题方法
10 . 硫酰氯(SO2Cl2)和亚硫酰氯(SOCl2)均是重要的化工试剂,遇水发生剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出,常用作脱水剂。
已知: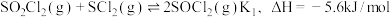 (Ⅰ)
(Ⅰ)
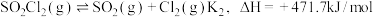 (Ⅱ)
(Ⅱ)
(1)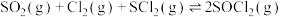 的平衡常数
的平衡常数
___________ (用 表示),
表示),
___________ kJ/mol。
(2)若在绝热、恒容的密闭容器中投入一定量的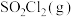 和
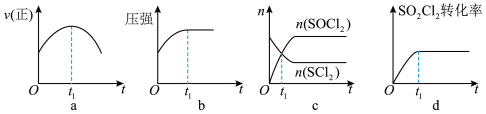
和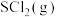 发生反应(Ⅰ),下列示意图能说明
发生反应(Ⅰ),下列示意图能说明 时刻反应达到平衡状态的是
时刻反应达到平衡状态的是___________ 。(填序号)
(3)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向 恒容密闭容器中加入
恒容密闭容器中加入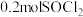 ,后反应(Ⅱ)达到平衡。测得
,后反应(Ⅱ)达到平衡。测得 内
内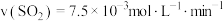 。则平衡时
。则平衡时 的转化率
的转化率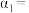
___________ 。若其它条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时 的转化率
的转化率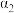
___________ 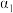 (填“>”、“<”或“=”)。若要增大
(填“>”、“<”或“=”)。若要增大 的转化率,可以采取的措施有
的转化率,可以采取的措施有___________ 。(列举一种)
(4)将 与
与 混合并加热,可得到无水
混合并加热,可得到无水 ,结合
,结合 与
与 反应的化学方程式解释原因:
反应的化学方程式解释原因:___________ 。
已知:
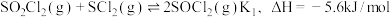 (Ⅰ)
(Ⅰ)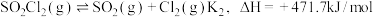 (Ⅱ)
(Ⅱ)(1)
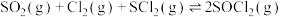 的平衡常数
的平衡常数
 表示),
表示),
(2)若在绝热、恒容的密闭容器中投入一定量的
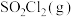 和
和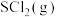 发生反应(Ⅰ),下列示意图能说明
发生反应(Ⅰ),下列示意图能说明 时刻反应达到平衡状态的是
时刻反应达到平衡状态的是
(3)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向
 恒容密闭容器中加入
恒容密闭容器中加入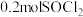 ,后反应(Ⅱ)达到平衡。测得
,后反应(Ⅱ)达到平衡。测得 内
内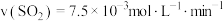 。则平衡时
。则平衡时 的转化率
的转化率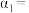
 的转化率
的转化率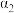
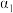 (填“>”、“<”或“=”)。若要增大
(填“>”、“<”或“=”)。若要增大 的转化率,可以采取的措施有
的转化率,可以采取的措施有(4)将
 与
与 混合并加热,可得到无水
混合并加热,可得到无水 ,结合
,结合 与
与 反应的化学方程式解释原因:
反应的化学方程式解释原因:
您最近一年使用:0次



