1 .  催化剂能催化
催化剂能催化 脱除烟气中的NO,反应为
脱除烟气中的NO,反应为
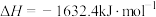 。
。
(1)催化剂的制备。将预先制备的一定量的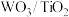 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发、焙烧等工序得到颗粒状
溶液,经蒸发、焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为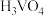 沉淀的离子方程式为
沉淀的离子方程式为___________ ;反应选用 溶液而不选用
溶液而不选用 溶液的原因是
溶液的原因是___________ 。
(2)催化剂的应用。将一定物质的量浓度的NO、 、
、 (其余为
(其余为 )气体匀速通过装有
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是
催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是___________ ;反应温度高于380℃,NO转化率下降,除因为进入反应器的NO被还原的量减少外,还有___________ (用化学方程式表示)。 废催化剂并制备
废催化剂并制备 的过程可表示为
的过程可表示为___________ 。
②通过萃取可分离钒和钨,在得到的钒酸中含有 。已知
。已知 具有八元环结构,其结构式可表示为
具有八元环结构,其结构式可表示为___________ 。
③向pH=8的 溶液中加入过量的
溶液中加入过量的 溶液,生成
溶液,生成 沉淀。已知:
沉淀。已知: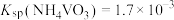 ,加过量
,加过量 溶液的目的是
溶液的目的是___________ 。
 催化剂能催化
催化剂能催化 脱除烟气中的NO,反应为
脱除烟气中的NO,反应为
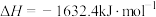 。
。(1)催化剂的制备。将预先制备的一定量的
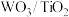 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发、焙烧等工序得到颗粒状
溶液,经蒸发、焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为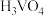 沉淀的离子方程式为
沉淀的离子方程式为 溶液而不选用
溶液而不选用 溶液的原因是
溶液的原因是(2)催化剂的应用。将一定物质的量浓度的NO、
 、
、 (其余为
(其余为 )气体匀速通过装有
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是
催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是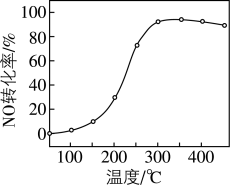
 废催化剂并制备
废催化剂并制备 的过程可表示为
的过程可表示为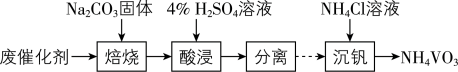
②通过萃取可分离钒和钨,在得到的钒酸中含有
 。已知
。已知 具有八元环结构,其结构式可表示为
具有八元环结构,其结构式可表示为③向pH=8的
 溶液中加入过量的
溶液中加入过量的 溶液,生成
溶液,生成 沉淀。已知:
沉淀。已知: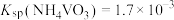 ,加过量
,加过量 溶液的目的是
溶液的目的是
您最近一年使用:0次
2 . BiOCl是一种具有珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
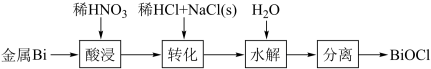
下列说法错误的是

下列说法错误的是
| A.酸浸工序中分次加入稀HNO3可降低反应剧烈程度 |
| B.转化工序中加入稀HCl可抑制生成BiONO3 |
| C.水解工序中加入少量CH3COONa(s)可提高Bi3+水解程度 |
| D.水解工序中加入少量NH4NO3(s)有利于BiOCl的生成 |
您最近一年使用:0次
2021-06-09更新
|
8566次组卷
|
33卷引用:2021年新高考河北化学高考真题
2021年新高考河北化学高考真题(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点31 化学实验与工艺流程-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)河北省衡水中学2021-2022学年高二上学期8月份线上调研化学试题湖南省邵阳邵东市第一中学2022届高三上学期第一次月考化学试题江西省乐平三中2021-2022高二上学期9月月考化学试题辽宁省东北育才学校2021-2022学年高二上学期期中考试化学试题2021年河北省高考化学试卷变式题1-9题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)山西省怀仁市2021-2022学年高二上学期期末调研化学试题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题14 无机综合运用(选择题)-2022年高考化学二轮复习重点专题常考点突破练福建省龙岩第一中学2021-2022学年高二上学期第二次月考化学试题(实验班)(已下线)卷05 工艺流程型选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)卷04 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押新高考卷03题 元素化合物的性质-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题14 物质的反应和转化-三年(2020-2022)高考真题分项汇编(已下线)考点15 铝及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)河南省洛阳市新安县第一高级中学2022-2023学年高三上学期入学测试(实验小班)化学试题浙江省杭州高级中学2022-2023学年高三上学期模拟考试化学试题(已下线)专题14 工艺流程选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题14 溶液中的三大平衡及应用第四章 非金属及其化合物 第25讲 非金属及其化合物知识落实与拓展(已下线)素养卷08 微型化学工艺流程分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题10 物质的反应及转化(已下线)专题10 物质的反应及转化(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)河北省石家庄二中实验学校2023-2024学年高三上学期10月第二次调研考试化学试题(已下线)第4讲 盐类的水解湖北省恩施高中2023-2024学年高一下学期入学考试化学试题湖南省长沙市湖南师范大学附属中学2023-2024学年高三下学期第七次月考化学试题湖南省师范大学附属中学2023-2024学年高三下学期 月考化学试卷
名校
3 . 向一定浓度的 与NaOH的混合液中滴加稀醋酸,溶液导电能力随加入
与NaOH的混合液中滴加稀醋酸,溶液导电能力随加入 溶液的体积变化如图所示,下列说法正确的是
溶液的体积变化如图所示,下列说法正确的是

 与NaOH的混合液中滴加稀醋酸,溶液导电能力随加入
与NaOH的混合液中滴加稀醋酸,溶液导电能力随加入 溶液的体积变化如图所示,下列说法正确的是
溶液的体积变化如图所示,下列说法正确的是
| A.ab段,溶液导电能力减弱是由于溶液体积增大,离子浓度减小 |
B.bc段,发生反应的离子方程式为 |
| C.cd段,溶液导电能力下降是由于溶液中离子个数减少 |
D.d点以后,随着 溶液的滴加,溶液导电能力可能增强 溶液的滴加,溶液导电能力可能增强 |
您最近一年使用:0次
2022-09-04更新
|
1598次组卷
|
3卷引用:第三章水溶液中的离子反应与平衡
4 . 利用太阳能光解水,制备的H2用于还原CO2合成有机物,可实现资源的再利用。回答下列问题:
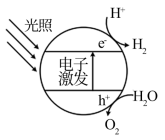
Ⅰ.半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物
(1)下图为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为___________ 。
(2)若将该催化剂置于Na2SO3溶液中,产物之一为 ,另一产物为
,另一产物为__________ 。若将该催化剂置于AgNO3溶液中,产物之一为O2,写出生成另一产物的离子反应式__________ 。
Ⅱ.用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应):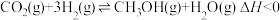
(3)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为___________ 。
(4)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。
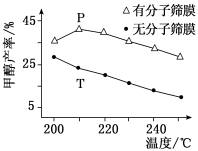
①甲醇平衡产率随温度升高而降低的原因为____________ 。
②P点甲醇产率高于T点的原因为___________ 。
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为___________ °C。
Ⅲ.调节溶液pH可实现工业废气CO2的捕获和释放
(5) 的空间构型为
的空间构型为__________ 。已知25℃碳酸电离常数为Ka1、Ka2,当溶液pH=12时, =1:
=1:_______ :__________ 。
Ⅰ.半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物
(1)下图为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为

(2)若将该催化剂置于Na2SO3溶液中,产物之一为
 ,另一产物为
,另一产物为Ⅱ.用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应):
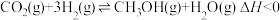
(3)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为
(4)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。

①甲醇平衡产率随温度升高而降低的原因为
②P点甲醇产率高于T点的原因为
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为
Ⅲ.调节溶液pH可实现工业废气CO2的捕获和释放
(5)
 的空间构型为
的空间构型为 =1:
=1:
您最近一年使用:0次
2020-07-11更新
|
5212次组卷
|
7卷引用:2020年天津卷化学高考试题
2020年天津卷化学高考试题(已下线)专题14 化学反应原理综合-2020年高考真题和模拟题化学分项汇编山东省济南市山东省实验中学西校2021届高三上学期10月份月考化学试题(已下线)难点6 化学反应原理的综合应用-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)2020年天津卷化学高考真题变式题13-16(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)专题17 原理综合题
名校
解题方法
5 . 已知室温下,
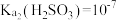
 ,用氨水吸收
,用氨水吸收 并探究吸收后溶液的性质,吸收过程中所引起的溶液体积变化和挥发可忽略。下列说法正确的是
并探究吸收后溶液的性质,吸收过程中所引起的溶液体积变化和挥发可忽略。下列说法正确的是

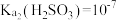
 ,用氨水吸收
,用氨水吸收 并探究吸收后溶液的性质,吸收过程中所引起的溶液体积变化和挥发可忽略。下列说法正确的是
并探究吸收后溶液的性质,吸收过程中所引起的溶液体积变化和挥发可忽略。下列说法正确的是| 序号 | 实验操作和现象 |
| 实验1 | 向10 mL 0.1 mol·L 氨水中通入0.0005 mol 氨水中通入0.0005 mol  ,测得反应后溶液 ,测得反应后溶液 |
| 实验2 | 向“实验1”所得溶液中继续通入0.0005 mol  ,测得反应后溶液 ,测得反应后溶液 |
| 实验3 | 取“实验2”所得溶液,向其中加入过量 溶液,产生白色沉淀 溶液,产生白色沉淀 |
| 实验4 | 取“实验2”所得溶液,向其中加入 至溶液 至溶液 |
A.“实验1”得到的溶液中: |
B.实验2”得到的溶液中: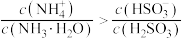 |
C.“实验3”发生反应的离子方程式: |
D.“实验4”得到的溶液中: |
您最近一年使用:0次
2023-05-27更新
|
1155次组卷
|
6卷引用:江苏省南通市2023届高三下学期第四次模拟考试化学试题
名校
解题方法
6 . 绿水青山就是金山银山。燃烧煤的烟气含有SO2和NOx,直接排放会造成环境污染,排放前需要进行处理。试回答下列问题:
(1)某实验小组设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0kJ·mol-l、283.0kJ·mol-l,试写出CO还原SO2生成CO2和S(s)的热化学方程式_________ 。
(2)采用Na2SO3溶液吸收法处理SO2,25℃时用1mol·L-1的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为_________ 。(已知25℃时:H2SO3的电离常数Kal=l.3×l0-2,Ka2=6.2×l0-8)
(3)采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在脱硫、脱硝过程中,反应器中一直维持下列条件:温度为298K,pH=12,NaClO2溶液浓度为5×l0-3mol·L-1。通入含有SO2和NO的烟气,则反应一段时间后溶液中离子浓度的分析结果如下表。
在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
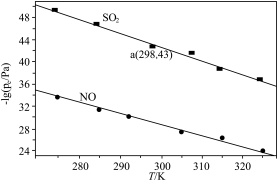
①写出NaClO2溶液脱硫过程中主要反应的离子方程式_________ 。脱硫、脱硝反应的△H_________ 0(填“<”“>”或“=”)。
②已知脱硝主要反应为;4NO+3 +4OH-=4
+4OH-=4 +3C1-+2H2O。由实验结果可知,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是
+3C1-+2H2O。由实验结果可知,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是________ (写出其中一个原因)。欲提高烟气中NO的脱硝反应速率,可以采用的措施是________ (写出其中一条措施)。
③脱硝主要反应的平衡表达式为: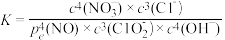 ,其中pe(NO)为平衡分压。结合题目信息,计算298K时脱硫过程主要反应的化学平衡常数:K=
,其中pe(NO)为平衡分压。结合题目信息,计算298K时脱硫过程主要反应的化学平衡常数:K=________ (只列算式代入数据,不作运算)
(4)如果采用Ca(ClO)2替代NaClO2,能得到更好的烟气脱硫效果,其原因是________ 。
(1)某实验小组设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0kJ·mol-l、283.0kJ·mol-l,试写出CO还原SO2生成CO2和S(s)的热化学方程式
(2)采用Na2SO3溶液吸收法处理SO2,25℃时用1mol·L-1的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为
(3)采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在脱硫、脱硝过程中,反应器中一直维持下列条件:温度为298K,pH=12,NaClO2溶液浓度为5×l0-3mol·L-1。通入含有SO2和NO的烟气,则反应一段时间后溶液中离子浓度的分析结果如下表。
| 离子 |  |  |  |  | Cl- |
| c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×l0-4 | l.2×10-5 | 3.4×10-3 |

①写出NaClO2溶液脱硫过程中主要反应的离子方程式
②已知脱硝主要反应为;4NO+3
 +4OH-=4
+4OH-=4 +3C1-+2H2O。由实验结果可知,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是
+3C1-+2H2O。由实验结果可知,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是③脱硝主要反应的平衡表达式为:
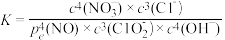 ,其中pe(NO)为平衡分压。结合题目信息,计算298K时脱硫过程主要反应的化学平衡常数:K=
,其中pe(NO)为平衡分压。结合题目信息,计算298K时脱硫过程主要反应的化学平衡常数:K=(4)如果采用Ca(ClO)2替代NaClO2,能得到更好的烟气脱硫效果,其原因是
您最近一年使用:0次
2023-04-17更新
|
801次组卷
|
3卷引用:广东省江门市2023届高三下学期第一次模拟考试化学试题
名校
解题方法
7 . 以一定浓度NaOH溶液吸收H2S可制备Na2S或NaHS。若通入H2S所引起的溶液体积变化和H2O挥发可忽略,溶液中含硫物种的浓度c总=c(H2S)+c(HS-)+c(S2-)。室温下,H2S的电离常数分别为Ka1=1.1×10-7、Ka2=1.3×10-13。下列说法正确的是
A.Na2S溶液显碱性的原因:S2-+2H2O H2S+2OH- H2S+2OH- |
| B.NaOH恰好转化为Na2S的溶液中:c(OH-)=c(H+)+c(HS-)+c(S2-) |
| C.吸收所得c总=c(Na+)的溶液中:c(H2S)>c(S2-) |
| D.NaOH溶液吸收H2S过程中,溶液的温度下降 |
您最近一年使用:0次
2023-03-24更新
|
788次组卷
|
4卷引用:江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题
江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题 (已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(选择题11-13)江苏省无锡市第一中学2023-2024学年高二下学期月度质量检测化学试卷江苏省南京市部分学校2024届高三下学期化学模拟测试
解题方法
8 . 醋酸的电离方程式为CH3COOH(aq) H+(aq)+CH3COO-(aq) ΔH>0.25 ℃时,0.1 mol/L醋酸溶液中存在下述关系:
H+(aq)+CH3COO-(aq) ΔH>0.25 ℃时,0.1 mol/L醋酸溶液中存在下述关系: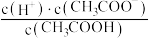 =1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
 H+(aq)+CH3COO-(aq) ΔH>0.25 ℃时,0.1 mol/L醋酸溶液中存在下述关系:
H+(aq)+CH3COO-(aq) ΔH>0.25 ℃时,0.1 mol/L醋酸溶液中存在下述关系: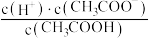 =1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是| A.向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小 |
| B.向该溶液中加少量CH3COONa固体,平衡正向移动 |
| C.该温度下0.01 mol/L的醋酸溶液Ka<1.75×10-5 |
| D.升高温度,c(H+)增大,Ka变大 |
您最近一年使用:0次
2023·全国·模拟预测
解题方法
9 . 甲酸是基本有机化工原料之一,广泛应用于农药、皮革、染料、医药和橡胶等工业。在较高温度或有催化剂存在下,它会分解成CO和 或
或 和
和 。
。
反应Ⅰ: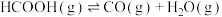

反应Ⅱ: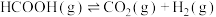
(1)已知工业上甲酸的能量关系转换会涉及以下反应:




则反应Ⅱ的 =
=___________  。
。
(2)一定温度下,甲酸在某催化剂作用下分解的能量变化过程如图所示。
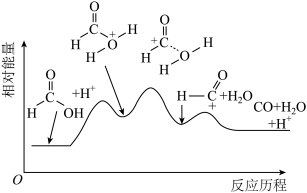
该反应的催化剂为___________ ,该反应历程中速率最慢步骤的化学方程式为___________ 。
(3)恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体, 分解成CO和
分解成CO和 或
或 和
和 。平衡体系中CO或
。平衡体系中CO或 的选择性和HCOOH的转化率随温度变化曲线如图所示。
的选择性和HCOOH的转化率随温度变化曲线如图所示。
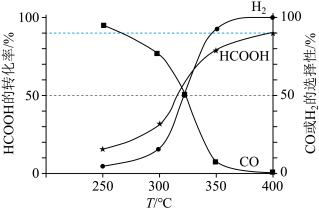
①400℃时,反应Ⅱ的平衡常数 =
=___________ kPa(用平衡分压代替平衡浓度计算,分压=总压×体积分数;结果保留小数点后1位)。
②图中随着温度升高,HCOOH的转化率增大,请解释CO的选择性下降的可能原因:___________ 。
(4)已知:25℃时, 的电离平衡常数
的电离平衡常数 ,
, ,HCOOH的电离平衡常数
,HCOOH的电离平衡常数 。
。
①将100mL 的HCOOH溶液加入50mL
的HCOOH溶液加入50mL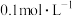 的碳酸钠溶液中,写出相应反应的离子方程式:
的碳酸钠溶液中,写出相应反应的离子方程式:___________ 。
②25℃时,当溶液中 时,溶液中
时,溶液中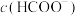 =
=___________  。
。
 或
或 和
和 。
。反应Ⅰ:
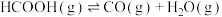

反应Ⅱ:
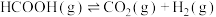
(1)已知工业上甲酸的能量关系转换会涉及以下反应:




则反应Ⅱ的
 =
= 。
。(2)一定温度下,甲酸在某催化剂作用下分解的能量变化过程如图所示。

该反应的催化剂为
(3)恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体,
 分解成CO和
分解成CO和 或
或 和
和 。平衡体系中CO或
。平衡体系中CO或 的选择性和HCOOH的转化率随温度变化曲线如图所示。
的选择性和HCOOH的转化率随温度变化曲线如图所示。
①400℃时,反应Ⅱ的平衡常数
 =
=②图中随着温度升高,HCOOH的转化率增大,请解释CO的选择性下降的可能原因:
(4)已知:25℃时,
 的电离平衡常数
的电离平衡常数 ,
, ,HCOOH的电离平衡常数
,HCOOH的电离平衡常数 。
。①将100mL
 的HCOOH溶液加入50mL
的HCOOH溶液加入50mL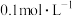 的碳酸钠溶液中,写出相应反应的离子方程式:
的碳酸钠溶液中,写出相应反应的离子方程式:②25℃时,当溶液中
 时,溶液中
时,溶液中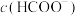 =
= 。
。
您最近一年使用:0次
10 . 含硫化合物在能源、材料及环境等工业领域均有广泛的应用。
Ⅰ.工业废气 分解可制取
分解可制取 。
。
(1)已知热化学方程式:
ⅰ.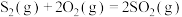

ⅱ.

ⅲ.

 热分解反应
热分解反应 的
的
___________ (用含 、
、 、
、 的式子表示)。
的式子表示)。
(2)一定温度下,2mol 在体积为VL的恒容密闭容器中发生上述分解反应,ts时
在体积为VL的恒容密闭容器中发生上述分解反应,ts时 的产率为40%,则0~ts内
的产率为40%,则0~ts内 的平均分解速率为
的平均分解速率为___________  ;
; 充分分解达到平衡时,容器中
充分分解达到平衡时,容器中 和
和 的分压相等,则该温度下的平衡常数
的分压相等,则该温度下的平衡常数
___________ 。
Ⅱ.KSCN可用于镀铬工业。常温下,用KSCN配制电镀液,溶液中 与
与 发生第一、二步络合的反应如下:
发生第一、二步络合的反应如下:
ⅳ.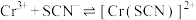
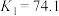
ⅴ.

(3)根据以上络合反应,下列说法正确的有___________(填字母)。
(4)常温下,某研究小组配制了起始浓度 、
、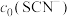 不同的系列溶液,测得平衡时
不同的系列溶液,测得平衡时 、
、 、
、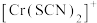 的浓度
的浓度 (含铬微粒)随
(含铬微粒)随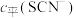 的变化曲线如图所示,平衡后其他含铬微粒
的变化曲线如图所示,平衡后其他含铬微粒 (3≤x≤6,图中未画出)总浓度为amol/L。
(3≤x≤6,图中未画出)总浓度为amol/L。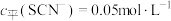 时,图中含铬微粒按浓度由大到小的顺序为
时,图中含铬微粒按浓度由大到小的顺序为___________ ;A点时,溶液中 的平衡浓度为
的平衡浓度为___________ (列出计算式即可)。
②在某电镀工艺中, 的浓度需要在
的浓度需要在 以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺________ (写出计算过程)。
Ⅰ.工业废气
 分解可制取
分解可制取 。
。(1)已知热化学方程式:
ⅰ.
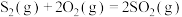

ⅱ.


ⅲ.


 热分解反应
热分解反应 的
的
 、
、 、
、 的式子表示)。
的式子表示)。(2)一定温度下,2mol
 在体积为VL的恒容密闭容器中发生上述分解反应,ts时
在体积为VL的恒容密闭容器中发生上述分解反应,ts时 的产率为40%,则0~ts内
的产率为40%,则0~ts内 的平均分解速率为
的平均分解速率为 ;
; 充分分解达到平衡时,容器中
充分分解达到平衡时,容器中 和
和 的分压相等,则该温度下的平衡常数
的分压相等,则该温度下的平衡常数
Ⅱ.KSCN可用于镀铬工业。常温下,用KSCN配制电镀液,溶液中
 与
与 发生第一、二步络合的反应如下:
发生第一、二步络合的反应如下:ⅳ.
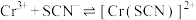
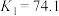
ⅴ.


(3)根据以上络合反应,下列说法正确的有___________(填字母)。
| A.加水稀释后,溶液中离子的总数减少 |
B.加入少量 固体,溶液中含铬微粒总数不变 固体,溶液中含铬微粒总数不变 |
C.反应 的平衡常数 的平衡常数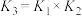 |
D.溶液中 减小, 减小, 与 与 浓度的比值减小 浓度的比值减小 |
(4)常温下,某研究小组配制了起始浓度
 、
、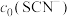 不同的系列溶液,测得平衡时
不同的系列溶液,测得平衡时 、
、 、
、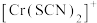 的浓度
的浓度 (含铬微粒)随
(含铬微粒)随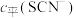 的变化曲线如图所示,平衡后其他含铬微粒
的变化曲线如图所示,平衡后其他含铬微粒 (3≤x≤6,图中未画出)总浓度为amol/L。
(3≤x≤6,图中未画出)总浓度为amol/L。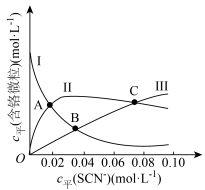
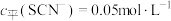 时,图中含铬微粒按浓度由大到小的顺序为
时,图中含铬微粒按浓度由大到小的顺序为 的平衡浓度为
的平衡浓度为②在某电镀工艺中,
 的浓度需要在
的浓度需要在 以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
您最近一年使用:0次



