名校
解题方法
1 . 100mL 甲溶液可能含有H+、K+、NH 、Ba2+、CO
、Ba2+、CO 、SO
、SO 、Cl-中的若干种。取该溶液进行连续实验,过程如图(所加试剂均过量,气体全部逸出)。下列说法中不正确的是
、Cl-中的若干种。取该溶液进行连续实验,过程如图(所加试剂均过量,气体全部逸出)。下列说法中不正确的是

 、Ba2+、CO
、Ba2+、CO 、SO
、SO 、Cl-中的若干种。取该溶液进行连续实验,过程如图(所加试剂均过量,气体全部逸出)。下列说法中不正确的是
、Cl-中的若干种。取该溶液进行连续实验,过程如图(所加试剂均过量,气体全部逸出)。下列说法中不正确的是
| A.原溶液一定不存在 H+、Ba2+,可能存在K+,可通过焰色试验来检验 |
| B.原溶液一定存在Cl-, 且c(Cl-)≤0.1mol/L |
| C.沉淀1转化为沉淀2时,放出的气体标况下的体积为224mL |
D.若甲溶液中先加 BaCl2溶液,产生白色沉淀,再加足量稀盐酸沉淀不溶解,不能证明此溶液中含有SO |
您最近一年使用:0次
2023-11-08更新
|
518次组卷
|
2卷引用: 四川省成都市树德中学2023-2024学年高一上学期11月期中考试化学试题
2 . 针对表中10种元素及由这些元素形成的单质和化合物,完成以下问题。
(1)最活泼的金属元素是___________ (填元素符号),最高价氧化物对应水化物酸性最强的是___________ (填氧化物对应水化物的化学式)。
(2)用电子式表示⑤和⑨两种元素组成的化合物的形成过程___________ 。
(3)①②⑦的原子半径由大到小的顺序为___________ (填元素符号)。
(4)①和⑧非金属性比较①___________ ⑧(填>、<或=),请设计实验证明___________ (用一个化学方程式表示)。
(5)写出元素⑥的单质与元素④最高价氧化物对应水化物反应的化学方程式___________ 。
(6)为证明某溶液中不含Fe3+而可能含有Fe2+,选用下列试剂进行实验,可行的操作顺序___________。
①加入少量的氯水 ②加入少量酸性KMnO4溶液 ③加入KSCN溶液
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
(2)用电子式表示⑤和⑨两种元素组成的化合物的形成过程
(3)①②⑦的原子半径由大到小的顺序为
(4)①和⑧非金属性比较①
(5)写出元素⑥的单质与元素④最高价氧化物对应水化物反应的化学方程式
(6)为证明某溶液中不含Fe3+而可能含有Fe2+,选用下列试剂进行实验,可行的操作顺序___________。
①加入少量的氯水 ②加入少量酸性KMnO4溶液 ③加入KSCN溶液
| A.①③ | B.③② | C.③① | D.①② |
您最近一年使用:0次
解题方法
3 . 某小组为测定氯化铝样品(只含少量氯化铜杂质)的纯度,设计了以下实验方案:
步骤1:称取15.06g样品,用适量蒸馏水溶解;
步骤2:加入足量稀NaOH溶液,充分反应后过滤;
步聚5:洗涤所得沉淀并60℃水浴烘干至恒重,记录干燥的沉淀质量为0.98g;
步骤4:计算样品纯度。
已知:氢氧化铜难溶于稀氢氧化钠溶液且在80℃时会分解。回答下列问题:
(1)步骤1中需使用的仪器如下:
A.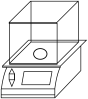 B.
B. 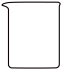 C.
C.  D.
D. 
仪器C的作用是___________ ,仪器D的名称是___________ 。
(2)写出步骤2中AlCl3发生反应的离子方程式___________ 。
(3)①如图洗涤沉淀的操作有何错误___________ ;
②证明沉淀已洗净的实验操作是___________ ;
③采用60℃水浴洪干沉淀的目的是___________ 。

(4)该氯化铝样品的纯度为___________ (保留两位有效数字)。
(5)步骤2中若用足量的浓氨水代替氢氧化钠溶液也可以测定样品中氯化铝的含量,理由是___________ 。
步骤1:称取15.06g样品,用适量蒸馏水溶解;
步骤2:加入足量稀NaOH溶液,充分反应后过滤;
步聚5:洗涤所得沉淀并60℃水浴烘干至恒重,记录干燥的沉淀质量为0.98g;
步骤4:计算样品纯度。
已知:氢氧化铜难溶于稀氢氧化钠溶液且在80℃时会分解。回答下列问题:
(1)步骤1中需使用的仪器如下:
A.
 B.
B.  C.
C.  D.
D. 
仪器C的作用是
(2)写出步骤2中AlCl3发生反应的离子方程式
(3)①如图洗涤沉淀的操作有何错误
②证明沉淀已洗净的实验操作是
③采用60℃水浴洪干沉淀的目的是

(4)该氯化铝样品的纯度为
(5)步骤2中若用足量的浓氨水代替氢氧化钠溶液也可以测定样品中氯化铝的含量,理由是
您最近一年使用:0次
名校
解题方法
4 . 某化学兴趣小组在实验室中以烧杯为容器,用饱和 溶液制备
溶液制备 胶体,并对其性质做了如下探究:
胶体,并对其性质做了如下探究:
(1)将饱和 溶液加到
溶液加到___________ 中,可制得 胶体。制备过程中,发生化学反应的方程式为
胶体。制备过程中,发生化学反应的方程式为___________ 。
(2)小米同学在制备时,加热时间过久,结果未能得到胶体。那么小米同学得到的物质应该是:_______ (填化学式),该物质属于_______ (请从下面选择)。
A.酸 B.碱 C.盐
(3)小庄同学想证明 胶体已经制备成功,她可以利用
胶体已经制备成功,她可以利用___________ (最简单的方法,请写出方法的名称)进行鉴别。
(4)小静同学利用___________ (填方法名称)方法对 胶体提纯。
胶体提纯。
(5)小邱同学将提纯后的 胶体置于U型管中,通入直流电一段时间后,观察到与电源负极相连的那个电极附近的颜色变深,说明可知
胶体置于U型管中,通入直流电一段时间后,观察到与电源负极相连的那个电极附近的颜色变深,说明可知 胶粒带
胶粒带___________ 电荷(填“正”、“负”或者“不带”)。化学上把这种现象称为___________ 。
 溶液制备
溶液制备 胶体,并对其性质做了如下探究:
胶体,并对其性质做了如下探究:(1)将饱和
 溶液加到
溶液加到 胶体。制备过程中,发生化学反应的方程式为
胶体。制备过程中,发生化学反应的方程式为(2)小米同学在制备时,加热时间过久,结果未能得到胶体。那么小米同学得到的物质应该是:
A.酸 B.碱 C.盐
(3)小庄同学想证明
 胶体已经制备成功,她可以利用
胶体已经制备成功,她可以利用(4)小静同学利用
 胶体提纯。
胶体提纯。(5)小邱同学将提纯后的
 胶体置于U型管中,通入直流电一段时间后,观察到与电源负极相连的那个电极附近的颜色变深,说明可知
胶体置于U型管中,通入直流电一段时间后,观察到与电源负极相连的那个电极附近的颜色变深,说明可知 胶粒带
胶粒带
您最近一年使用:0次
2023-11-02更新
|
18次组卷
|
2卷引用:四川省宜宾市兴文第二中学校2023-2024学年高一上学期12月月考化学试题
名校
解题方法
5 . 某同学设计实验探究碳、硅元素的非金属性强弱,实验装置如图所示,已知酸性:H2SO3>H2CO3,回答下列问题:
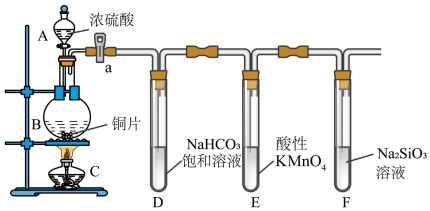
(1)仪器B的名称为_______ 。
(2)实验步骤:①连接仪器,②_______ ,③加入药品,④打开a,滴入浓硫酸,⑤加热观察。
(3)铜与浓硫酸反应的化学方程式为_______ ,装置E中酸性高锰酸钾溶液的作用为_______ 。
(4)能说明碳元素的非金属性比硅元素的非金属性强的实验现象是_______ 。
(5)该实验是否能证明S的非金属性强于C的非金属性_______ (填“能”或“不能”)。

(1)仪器B的名称为
(2)实验步骤:①连接仪器,②
(3)铜与浓硫酸反应的化学方程式为
(4)能说明碳元素的非金属性比硅元素的非金属性强的实验现象是
(5)该实验是否能证明S的非金属性强于C的非金属性
您最近一年使用:0次
2022-09-05更新
|
318次组卷
|
2卷引用:四川省遂宁市射洪中学2022-2023学年高二上学期入学考试化学试题
解题方法
6 . 明矾石的主要成分是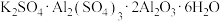 ,还含有少量
,还含有少量 杂质。利用明矾石制备
杂质。利用明矾石制备 和
和 晶体的流程如图:
晶体的流程如图:
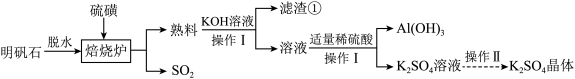
已知:焙烧炉中发生反应的化学方程式为 ,回答下列问题:
,回答下列问题:
(1)“滤渣①”的主要成分为_______ ,“操作Ⅰ”的名称为_______ ,实验室进行“操作Ⅱ”时,需要使用下列仪器中的_______ 。
a.坩埚 b.蒸发皿 c.铁架台(带铁圈) d.玻璃棒 e.烧杯
(2)“熟料”与 溶液反应的离子方程式为
溶液反应的离子方程式为_______ 。
(3)生成的 需进一步洗涤干燥,证明
需进一步洗涤干燥,证明 沉淀已洗涤干净的实验操作和现象是
沉淀已洗涤干净的实验操作和现象是_______ 。
(4)若“焙烧”过程中恰好消耗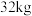 硫黄,则理论上最终可得到
硫黄,则理论上最终可得到_______  氢氧化铝。
氢氧化铝。
 ,还含有少量
,还含有少量 杂质。利用明矾石制备
杂质。利用明矾石制备 和
和 晶体的流程如图:
晶体的流程如图:
已知:焙烧炉中发生反应的化学方程式为
 ,回答下列问题:
,回答下列问题:(1)“滤渣①”的主要成分为
a.坩埚 b.蒸发皿 c.铁架台(带铁圈) d.玻璃棒 e.烧杯
(2)“熟料”与
 溶液反应的离子方程式为
溶液反应的离子方程式为(3)生成的
 需进一步洗涤干燥,证明
需进一步洗涤干燥,证明 沉淀已洗涤干净的实验操作和现象是
沉淀已洗涤干净的实验操作和现象是(4)若“焙烧”过程中恰好消耗
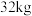 硫黄,则理论上最终可得到
硫黄,则理论上最终可得到 氢氧化铝。
氢氧化铝。
您最近一年使用:0次
名校
解题方法
7 . 元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R分别代表一种元素。请依据这7种元素回答下列问题:

(1)以上7种元素中原子半径最大的元素是___________ 。(填元素符号)
(2)元素的金属性:G___________ Q(填“>”或“<”)。
(3)Q的原子结构示意图为___________ 。A和F能组成原子个数比为1:1的化合物,该化合物的电子式为___________ ; D和F能组成原子个数比为1:2的化合物,该化合物的结构式为___________ 。
(4)A、G、F三种元素组成的化合物中有哪些化学键___________ 。
(5)为了验证D和M二种元素非金属性的强弱,设计下图装置进行实验,请回答:

①仪器A的名称是___________ 。
②现有试剂:稀硫酸、碳酸钠溶液、碳酸钙、硫酸钠溶液、澄清石灰水。从所给试剂中选择合适的试剂,用如图装置证明D和M两种元素非金属性:M>D,A中装试剂___________ ,C中的实验现象___________ 。
(6) F、M的简单氢化物的沸点由高到低的顺序为___________ (用化学式表示),原因是___________

(1)以上7种元素中原子半径最大的元素是
(2)元素的金属性:G
(3)Q的原子结构示意图为
(4)A、G、F三种元素组成的化合物中有哪些化学键
(5)为了验证D和M二种元素非金属性的强弱,设计下图装置进行实验,请回答:

①仪器A的名称是
②现有试剂:稀硫酸、碳酸钠溶液、碳酸钙、硫酸钠溶液、澄清石灰水。从所给试剂中选择合适的试剂,用如图装置证明D和M两种元素非金属性:M>D,A中装试剂
(6) F、M的简单氢化物的沸点由高到低的顺序为
您最近一年使用:0次
2021-05-23更新
|
179次组卷
|
2卷引用:四川省资阳市雁江区中和中学2020-2021学年高一下学期期中考试化学试题
名校
解题方法
8 . 根据元素周期表中短周期的下列内容,用对应的化学符号回答问题:
(1)元素①~⑨形成的单质中,化学性质最稳定的是___________ 。④在元素周期表中的位置是___________ ,⑥的简单离子的结构示意图为___________ 。
(2)③、⑨和H元素可形成一种常见的盐,其电子式为___________ ,其中存在的化学键类型为___________ 。⑤和⑧元素形成化合物的电子式为___________ 。
(3)⑧的一种核素原子的中子数与其核外电子数相同,则该原子是___________ 。⑧、⑨元素最高价氧化物对应的水化物中,酸性最强的是___________ 。
(4)写出一个可证明②和⑦非金属性强弱的离子方程式:___________ 。
(5)单质②与⑧对应的最高价氧化物的水化物的浓溶液反应的化学方程式:___________ 。
| H | ① | |||||
| ② | ③ | O | ④ | |||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
(2)③、⑨和H元素可形成一种常见的盐,其电子式为
(3)⑧的一种核素原子的中子数与其核外电子数相同,则该原子是
(4)写出一个可证明②和⑦非金属性强弱的离子方程式:
(5)单质②与⑧对应的最高价氧化物的水化物的浓溶液反应的化学方程式:
您最近一年使用:0次
名校
9 . 某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
Ⅰ.(1)将等质量的钾、钠、镁、铝分别投入到足量的同浓度的盐酸中,试预测实验结果:上述金属中_____ 与盐酸反应最剧烈,_____ 与盐酸反应生成的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_____________________________________ 。
Ⅱ.利用图装置来验证同主族元素非金属性的变化规律:
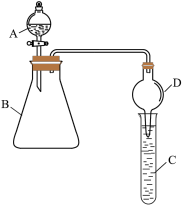
(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_____________ 的现象,即可证明。干燥管D的作用是_________________ 。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用_____ 溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,应在B、D之间增加一个盛有足量_____ (选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置。改进后C中发生反应的化学方程式是__________________________________ 。
Ⅰ.(1)将等质量的钾、钠、镁、铝分别投入到足量的同浓度的盐酸中,试预测实验结果:上述金属中
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为
Ⅱ.利用图装置来验证同主族元素非金属性的变化规律:

(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,应在B、D之间增加一个盛有足量
您最近一年使用:0次
10 . 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_______ 与盐酸反应最剧烈;_______ 与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S 强,反应的离子方程式为_______ 。
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律

(3)仪器B的名称为_______ ,干燥管D的作用为_______ 。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C_______ 的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气。
(5)若要证明非金属性:N>C>Si,则在A中加、B中加碳酸钙、C中加溶液观察到C中溶液________ 的现象,即可证明。但有的同学认为该装置有缺陷应怎样改进。_______
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S 强,反应的离子方程式为
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律

(3)仪器B的名称为
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C
(5)若要证明非金属性:N>C>Si,则在A中加、B中加碳酸钙、C中加溶液观察到C中溶液
您最近一年使用:0次



