名校
1 . 二氧化氯(ClO2)具有强氧化性,是优良的饮用水消毒剂。ClO2常温下为黄绿色气体,熔点-59℃,沸点11℃,极易溶于水且不与水反应,浓的ClO2受热时易爆炸。我国广泛使用的方法是用干燥的Cl2与NaClO2固体反应制取ClO2,实验室模拟制备ClO2装置如图所示:
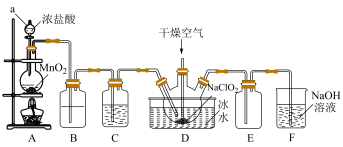
(1)仪器a的名称是:___________ ,装置A中反应的离子方程式为:___________ 。
(2)装置B中盛装的试剂是___________ ,装置C中试剂的作用是:___________ 。
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②___________ 。
(4)装置E为ClO2的收集装置,应将其置于___________ 水浴中(填“热”或“冰”)。
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:___________ 。
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若___________ (填“实验现象”),则假设1成立。

(1)仪器a的名称是:
(2)装置B中盛装的试剂是
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②
(4)装置E为ClO2的收集装置,应将其置于
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若
您最近一年使用:0次
2023-11-06更新
|
632次组卷
|
2卷引用:江西省广信中学2023-2024学年高一上学期11月月考化学试题
2 . 现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
I.甲同学向稀氯化铁溶液中加入少量的NaOH溶液;
II.乙同学直接加热饱和FeCl3溶液;
III.丙同学向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。 试回答下列问题:
(1)其中操作正确的同学是_______ ,写出此过程中的化学方程式:_______ ;
(2)证明有Fe(OH)3胶体生成的最简单实验操作是_______ ;
(3)Fe(OH)3胶体能不能透过滤纸:_______ (填“能”或“不能”)。
(4)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带_______ 电荷。
②向其中加入饱和Na2SO4溶液,产生的现象是_______ ;
③向所得Fe(OH)3胶体中逐滴滴加硫酸溶液,开始产生红褐色沉淀,这是因为______ ;继续滴加,沉淀最终消失且得棕黄色溶液,写出化学方程式_______ ;
④欲除去Fe(OH)3胶体中混有的NaCl,所用仪器物品是______ ;操作名称是______ 。
I.甲同学向稀氯化铁溶液中加入少量的NaOH溶液;
II.乙同学直接加热饱和FeCl3溶液;
III.丙同学向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。 试回答下列问题:
(1)其中操作正确的同学是
(2)证明有Fe(OH)3胶体生成的最简单实验操作是
(3)Fe(OH)3胶体能不能透过滤纸:
(4)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带
②向其中加入饱和Na2SO4溶液,产生的现象是
③向所得Fe(OH)3胶体中逐滴滴加硫酸溶液,开始产生红褐色沉淀,这是因为
④欲除去Fe(OH)3胶体中混有的NaCl,所用仪器物品是
您最近一年使用:0次
2022-12-15更新
|
285次组卷
|
2卷引用:江西省抚州市黎川县第二中学2023-2024学年高一上学期11月期中化学试题
名校
3 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在0℃—5℃、碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
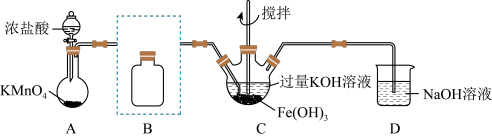
①装浓盐酸的仪器名称___________ 。
②将除杂装置B补充完整并标明所用试剂___________ 。
③C中得到紫色固体和溶液。C中Cl2发生的化学反应有: ,另外还有
,另外还有______ (写离子方程式):在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是___________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明是否K2FeO4氧化了 而产生Cl2,设计以下方案:
而产生Cl2,设计以下方案:
i.由方案I中溶液变红可知a中含有___________ 离子,但该离子的产生不能判断一定是K2FeO4将 氧化,还可能的原因
氧化,还可能的原因___________ 。
ii.方案II可证明K2FeO4氧化了 ,用KOH溶液洗涤的目的是
,用KOH溶液洗涤的目的是___________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2___________  (填“>”或“<”),而方案II实验表明,Cl2和
(填“>”或“<”),而方案II实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在0℃—5℃、碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①装浓盐酸的仪器名称
②将除杂装置B补充完整并标明所用试剂
③C中得到紫色固体和溶液。C中Cl2发生的化学反应有:
 ,另外还有
,另外还有(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明是否K2FeO4氧化了
 而产生Cl2,设计以下方案:
而产生Cl2,设计以下方案:| 方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
 氧化,还可能的原因
氧化,还可能的原因ii.方案II可证明K2FeO4氧化了
 ,用KOH溶液洗涤的目的是
,用KOH溶液洗涤的目的是②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案II实验表明,Cl2和
(填“>”或“<”),而方案II实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
2021-10-27更新
|
598次组卷
|
2卷引用:江西省萍乡市芦溪中学2022-2023学年高一上学期1月期末考试化学试题
4 . 某班同学用如下实验探究 与
与 的转化,回答下列问题,
的转化,回答下列问题,
(1)实验I: 转化为
转化为
实验步骤及现象;甲组同学将少量铜粉加入1mL 0.1mol/L 溶液中,观察到铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象:乙组同学将过量铜粉加入1mL 0.1mol/L
溶液中,观察到铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象:乙组同学将过量铜粉加入1mL 0.1mol/L  溶液中,观察到铜粉有剩余,溶液黄色褪去,加入蒸馏水后出现白色沉淀;丙组同学将过量铜粉加入1mL 0.05mol/L
溶液中,观察到铜粉有剩余,溶液黄色褪去,加入蒸馏水后出现白色沉淀;丙组同学将过量铜粉加入1mL 0.05mol/L  溶液中,观察到铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀,
溶液中,观察到铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀,
①分别取三组实验反应后的溶液于三支试管中_______ (填操作步骤以及现象),证明生成了 ;分析三组实验结果,实验中均发生的反应离子方程式为
;分析三组实验结果,实验中均发生的反应离子方程式为_________
②对比三组实验,说明加入蒸馏水后沉淀的产生与_________ 有关。
③向丙组实验后的溶液中加入饱和NaCl溶液可能出现的现象为_________ 。
④丙组在检验反应后的溶液中是否存在 时,取反应后上层清液于试管中,滴加3滴KSCN溶液,结果出现白色沉淀,查阅资料:i.
时,取反应后上层清液于试管中,滴加3滴KSCN溶液,结果出现白色沉淀,查阅资料:i. 的化学性质与
的化学性质与 相似,CuSCN为白色固体;ii.
相似,CuSCN为白色固体;ii. ,写出该实验中出现白色沉淀的离子方程式为
,写出该实验中出现白色沉淀的离子方程式为________ 。
(2)实验II: 转化为
转化为
实验步骤及现象:向3mL 0.1mol/L 溶液中加入稍过量稀硝酸,溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色,已知
溶液中加入稍过量稀硝酸,溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色,已知 (棕色)
(棕色)
⑤使用的 溶液中存在少量铁屑,其目的是
溶液中存在少量铁屑,其目的是___________ 。
⑥实验中产生NO的原因为___________ (用离子方程式表示)。
(3)实验III: 与
与 互转化
互转化
实验步骤及现象:将 通入足量
通入足量 溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入
溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入 溶液,则会产生白色沉淀。将产生的白色沉淀经过滤、洗涤、干燥后称量其质量为6.99g,则整个实验中产生的气体(假设只生成一种气体,该气体遇空气变为红棕色)在标准状况下体积为
溶液,则会产生白色沉淀。将产生的白色沉淀经过滤、洗涤、干燥后称量其质量为6.99g,则整个实验中产生的气体(假设只生成一种气体,该气体遇空气变为红棕色)在标准状况下体积为___________ 。
 与
与 的转化,回答下列问题,
的转化,回答下列问题,(1)实验I:
 转化为
转化为
实验步骤及现象;甲组同学将少量铜粉加入1mL 0.1mol/L
 溶液中,观察到铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象:乙组同学将过量铜粉加入1mL 0.1mol/L
溶液中,观察到铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象:乙组同学将过量铜粉加入1mL 0.1mol/L  溶液中,观察到铜粉有剩余,溶液黄色褪去,加入蒸馏水后出现白色沉淀;丙组同学将过量铜粉加入1mL 0.05mol/L
溶液中,观察到铜粉有剩余,溶液黄色褪去,加入蒸馏水后出现白色沉淀;丙组同学将过量铜粉加入1mL 0.05mol/L  溶液中,观察到铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀,
溶液中,观察到铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀,①分别取三组实验反应后的溶液于三支试管中
 ;分析三组实验结果,实验中均发生的反应离子方程式为
;分析三组实验结果,实验中均发生的反应离子方程式为②对比三组实验,说明加入蒸馏水后沉淀的产生与
③向丙组实验后的溶液中加入饱和NaCl溶液可能出现的现象为
④丙组在检验反应后的溶液中是否存在
 时,取反应后上层清液于试管中,滴加3滴KSCN溶液,结果出现白色沉淀,查阅资料:i.
时,取反应后上层清液于试管中,滴加3滴KSCN溶液,结果出现白色沉淀,查阅资料:i. 的化学性质与
的化学性质与 相似,CuSCN为白色固体;ii.
相似,CuSCN为白色固体;ii. ,写出该实验中出现白色沉淀的离子方程式为
,写出该实验中出现白色沉淀的离子方程式为(2)实验II:
 转化为
转化为
实验步骤及现象:向3mL 0.1mol/L
 溶液中加入稍过量稀硝酸,溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色,已知
溶液中加入稍过量稀硝酸,溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色,已知 (棕色)
(棕色)⑤使用的
 溶液中存在少量铁屑,其目的是
溶液中存在少量铁屑,其目的是⑥实验中产生NO的原因为
(3)实验III:
 与
与 互转化
互转化实验步骤及现象:将
 通入足量
通入足量 溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入
溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入 溶液,则会产生白色沉淀。将产生的白色沉淀经过滤、洗涤、干燥后称量其质量为6.99g,则整个实验中产生的气体(假设只生成一种气体,该气体遇空气变为红棕色)在标准状况下体积为
溶液,则会产生白色沉淀。将产生的白色沉淀经过滤、洗涤、干燥后称量其质量为6.99g,则整个实验中产生的气体(假设只生成一种气体,该气体遇空气变为红棕色)在标准状况下体积为
您最近一年使用:0次
2021-10-17更新
|
355次组卷
|
2卷引用:江西省抚州市临川区第十中学2022届高三月考化学试卷
5 . 研究小组进行如图所示实验,试剂A为0.2mol·L-1CuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验4,并记录实验现象:
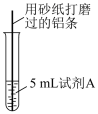
(1)实验1中,铝条表面析出红色固体的反应的离子方程式为___________ 。
(2)实验2的目的是证明铜盐中的阴离子Cl—是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为___________ g(NaCl的相对分子质量58.5)。
(3)实验3的目的是___________ 。
(4)经检验知,实验4中白色固体为CuCl,甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl。
查阅资料知:CuCl难溶于水,能溶解在Cl—浓度较大的溶液中,生成[CuCl2]—络离子,用水稀释含[CuCl2]—的溶液时会重新析出CuCl白色沉淀。
为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
①由上述实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]—与Al3+、___________ 作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]—,应补充的实验是:取适量实验4的棕褐色溶液,___________ 。
(5)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与______ 、______ 有关。

| 实验序号 | 试剂A | 实验现象 |
| 1 | 0.2mol·L-1CuCl2溶液 | 铝条表面有气泡产生,并有红色固体析出 |
| 2 | 0.2mol·L-1CuSO4溶液,再加入一定质量的NaCl固体 | 开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出 |
| 3 | 2mol·L-1CuSO4溶液 | 铝条表面有少量气泡产生,并有少量红色固体 |
| 4 | 2mol·L-1CuCl2溶液 | 反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成 |
(2)实验2的目的是证明铜盐中的阴离子Cl—是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为
(3)实验3的目的是
(4)经检验知,实验4中白色固体为CuCl,甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl。
查阅资料知:CuCl难溶于水,能溶解在Cl—浓度较大的溶液中,生成[CuCl2]—络离子,用水稀释含[CuCl2]—的溶液时会重新析出CuCl白色沉淀。
为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
| 实验序号 | 实验操作 | 实验现象 |
| i | 加入浓NaCl溶液 | 沉淀溶解,形成无色溶液 |
| ii | 加入饱和AlCl3溶液 | 沉淀溶解,形成褐色溶液 |
| iii | 向i所得溶液中加入2mol·L-1CuCl2溶液 | 溶液由无色变为褐色 |
②为确证实验4所得的棕褐色溶液中含有[CuCl2]—,应补充的实验是:取适量实验4的棕褐色溶液,
(5)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与
您最近一年使用:0次
2021-12-21更新
|
337次组卷
|
2卷引用:江西省宜春市上高中学2022-2023学年高一下学期5月期中考试化学试题
名校
解题方法
6 . 如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。下列说法正确的是
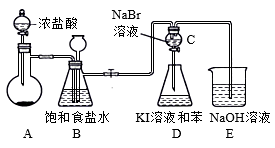

| A.装置A中烧瓶内的试剂是MnO2 |
| B.装置B具有除杂和贮存气体的作用 |
| C.实验结束后,振荡D会观察到液体分层且下层呈紫红色 |
| D.该装置一定能证明Cl2、Br2、I2的氧化性逐渐减弱 |
您最近一年使用:0次
2020-12-03更新
|
337次组卷
|
2卷引用:江西省上高二中2021届高三上学期第四次月考理综化学试题
7 . 某学习小组开展下列实验探究活动证明亚硫酸的酸性强于次氯酸:
(1)图一装置A中反应的化学方程式为_____________________ 。
(2)如果利用图一装置A中产生的气体去证明+4价硫具有氧化性,可将气体通入________ (填序号)来证明。
M.H2S溶液 N.Na2S溶液 O.NaOH溶液 P.品红溶液
(3)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
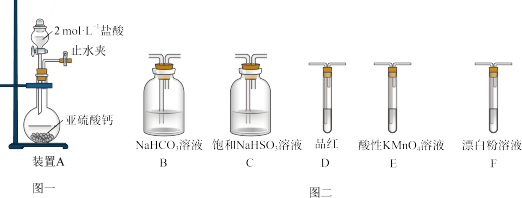
装置连接顺序为A、C、___________ 、__________ 、D、F,其中装置 C的作用是_______ ,通过_________________ 现象即可证明亚硫酸的酸性强于次氯酸。
(1)图一装置A中反应的化学方程式为
(2)如果利用图一装置A中产生的气体去证明+4价硫具有氧化性,可将气体通入
M.H2S溶液 N.Na2S溶液 O.NaOH溶液 P.品红溶液
(3)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:

装置连接顺序为A、C、
您最近一年使用:0次
19-20高三·江西南昌·阶段练习
解题方法
8 . 三氯化硼的熔点-107.3℃,沸点为12.5℃,易水解生成硼酸(H3BO3),可用于制造高纯硼、有机合成催化剂等。实验室制取三氯化硼的原理为:B2O3+3C+3Cl2 2BCl3+3CO。
2BCl3+3CO。
(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。
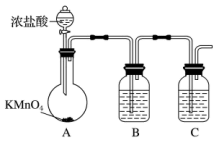
①装置B的作用是___________ ,装置C中盛放的试剂是___________ 。
②装宜A中发生反应的离子方程式为_______________ 。
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。
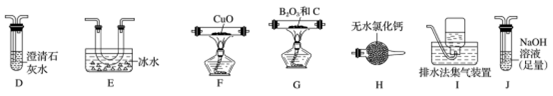
①乙组同学的实验装置中依次连接的合理顺序为:
A→B→C→G→___→____→____→____→F→____→____→_____。____________
②能证明反应中有CO生成的现象是_____________ 。
③开始反应时,先后(选填下列序号)______________ 。
a.点燃G处酒精灯b.打开A处分液漏斗活塞
④BCl3易水解,写出BCl3水解的化学方程式_____________ 。
⑤硼酸是一元弱酸,Ka=-5.8×10-10,碳酸的Ka1=4.4×10-7,现提供饱和的硼酸溶液和0.1mol/LNa2CO3溶液,设计实验证明硼酸酸性比碳酸弱。简述操作和现象____________ 。
 2BCl3+3CO。
2BCl3+3CO。(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。

①装置B的作用是
②装宜A中发生反应的离子方程式为
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。

①乙组同学的实验装置中依次连接的合理顺序为:
A→B→C→G→___→____→____→____→F→____→____→_____。
②能证明反应中有CO生成的现象是
③开始反应时,先后(选填下列序号)
a.点燃G处酒精灯b.打开A处分液漏斗活塞
④BCl3易水解,写出BCl3水解的化学方程式
⑤硼酸是一元弱酸,Ka=-5.8×10-10,碳酸的Ka1=4.4×10-7,现提供饱和的硼酸溶液和0.1mol/LNa2CO3溶液,设计实验证明硼酸酸性比碳酸弱。简述操作和现象
您最近一年使用:0次
名校
解题方法
9 . 亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。、
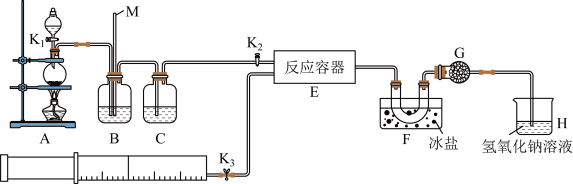
试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式___ 。
(2)装置B的作用是①__ ,②___ 。
(3)若用A装置制取NO气体,B中应该盛放__ 。
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为__ 。
(5)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与__ 同时通入NaOH溶液中。
(6)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:__ 。(仅提供的试剂:1mol•L-1HCl、1mol•L-1HNO2溶液、NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0g溶于水,配制成250mL溶液;取出25.00mL样品溶液置于锥形瓶中,用0.20mol•L-1AgNO3标准溶液滴定至终点,根据表中所给信息,应选用___ 做指示剂。
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为__ 。

试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式
(2)装置B的作用是①
(3)若用A装置制取NO气体,B中应该盛放
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为
(5)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与
(6)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0g溶于水,配制成250mL溶液;取出25.00mL样品溶液置于锥形瓶中,用0.20mol•L-1AgNO3标准溶液滴定至终点,根据表中所给信息,应选用
| 物质 | Ag2CrO4 | AgCl | AgI | Ag2S |
| 颜色 | 砖红色 | 白色 | 黄色 | 黑色 |
| Ksp | 1×10-12 | 1.56×10-10 | 8.3×10-17 | 6.3×10-50 |
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为
您最近一年使用:0次
名校
10 . A~F六种元素中,除F外其他均为短周期元素,它们的原子结构或性质如下表所示。
请回答下列问题:
(1)A在元素周期表中的位置是_____________ ;A与C形成的化合物AC2的电子式是___________ 。
(2)下列事实能证明C和E的非金属性强弱的是_____________ 。(填序号)
①常温下,C的单质呈气态,E的单质呈固态
②C的气态氢化物的稳定性强于E的气态氢化物的稳定性
③C与E形成的化合物中,E呈正价
④E的氢化物的沸点高于C的氢化物的沸点
(3) 由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是_________ (填化学式),它与足量NaOH溶液在加热时反应的离子方程为:_______________ 。
(4) FC与足量B的最高价氧化物的水化物的稀溶液反应的离子方程式_________________ 。若有标准状况下5.6L的BC生成,则转移的电子数为_______________ 。
(5) A的氢化物有多种,1 mol A的某种氢化物分子中含有14 mol电子,已知在25℃、101kPa下,1g该氢化物在足量氧气中完全燃烧生成液态水时放出的热量为40 kJ,写出表示该氢化物燃烧热的热化学方程式:_____________________ 。
| 元素 | 原子结构或性质 |
| A | 其形成的一种同位素原子在考古中可推测化石的年代 |
| B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
| C | 地壳中含量最多的元素 |
| D | D原子的内层电子数是最外层电子数的5倍 |
| E | 其单质主要存在于火山口附近 |
| F | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
(1)A在元素周期表中的位置是
(2)下列事实能证明C和E的非金属性强弱的是
①常温下,C的单质呈气态,E的单质呈固态
②C的气态氢化物的稳定性强于E的气态氢化物的稳定性
③C与E形成的化合物中,E呈正价
④E的氢化物的沸点高于C的氢化物的沸点
(3) 由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是
(4) FC与足量B的最高价氧化物的水化物的稀溶液反应的离子方程式
(5) A的氢化物有多种,1 mol A的某种氢化物分子中含有14 mol电子,已知在25℃、101kPa下,1g该氢化物在足量氧气中完全燃烧生成液态水时放出的热量为40 kJ,写出表示该氢化物燃烧热的热化学方程式:
您最近一年使用:0次
2016-12-09更新
|
350次组卷
|
3卷引用:2017届江西省赣州市十四校高三上期中联考化学试卷



