解题方法
1 . M为三种短周期元素组成的化合物,某实验小组按如图流程进行相关实验:

已知:气体A是由两种常见单质组成的混合物,一种为无色气体,另一种为黄绿色气体。
(1)组成M的三种元素____ (填元素符号);M分解的化学方程式____ 。
(2)气体A中黄绿色成分与硫单质反应,生成结构与H2O2相似的产物G,G的电子式____ ,G遇水反应生成沉淀、气体,写出反应的化学方程式____ 。
(3)写出E→F的离子方程式____ 。
(4)设计实验证明B→C过程中,加入的BaCl2溶液已经过量____ 。

已知:气体A是由两种常见单质组成的混合物,一种为无色气体,另一种为黄绿色气体。
(1)组成M的三种元素
(2)气体A中黄绿色成分与硫单质反应,生成结构与H2O2相似的产物G,G的电子式
(3)写出E→F的离子方程式
(4)设计实验证明B→C过程中,加入的BaCl2溶液已经过量
您最近一年使用:0次
解题方法
2 . 化合物X由三种短周期元素组成,可用作氧化剂和气体干燥剂。某兴趣小组对化合物X开展探究实验。

其中:混合气体B中含有两种单质气体,其中一种呈黄绿色。
(1)组成X的三种元素为___ 。
(2)写出X隔绝空气加热分解的化学方程式___ 。
(3)将溶液C蒸发结晶可得晶体的化学式为___ ,直接加热并灼烧该晶体得不到该晶体的无水盐,请说明理由___ 。
(4)将黄绿色气体B缓慢通入含有酚酞的NaOH稀溶液中,当通到一定量时,红色突然褪去。产生上述现象可能的原因有两种①___ ,②___ ;请设计相关实验证明红色褪去的原因___ 。

其中:混合气体B中含有两种单质气体,其中一种呈黄绿色。
(1)组成X的三种元素为
(2)写出X隔绝空气加热分解的化学方程式
(3)将溶液C蒸发结晶可得晶体的化学式为
(4)将黄绿色气体B缓慢通入含有酚酞的NaOH稀溶液中,当通到一定量时,红色突然褪去。产生上述现象可能的原因有两种①
您最近一年使用:0次
名校
解题方法
3 . 某小组在验证H2O2氧化Fe2+时发现异常现象,并对其进行深入探究。
实验I:
(1)实验I中溶液变红是因为Fe3+与SCN-发生了反应,其离子方程式是__ 。
(2)探究实验I中红色褪去的原因:取反应后溶液,___ (填实验操作和现象),证明溶液中有Fe3+,而几乎无SCN-。
(3)研究发现,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测Fe3+能加快H2O2与SCN-的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III:__ 。
实验II:
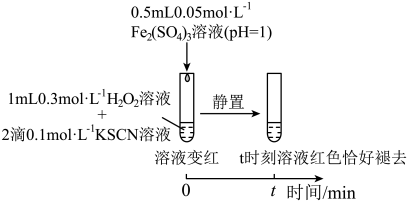
实验III:
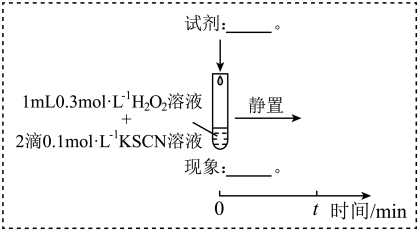
(4)查阅资料:Fe3+加快H2O2与SCN-反应的主要机理有
i.Fe3++H2O2=Fe2++HO2·+H+
ii.Fe2++H2O2=Fe3++·OH+OH-
iii.OH(羟基自由基)具有强氧化性,能直接氧化SCN-
为探究Fe2+对H2O2与SCN-反应速率的影响,设计实验如图:
实验IV:

①t′<t,对比实验IV和II可得出结论:在本实验条件下,___ 。
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:____ 。
③实验I~IV中均有O2生成,小组同学推测可能是HO2·与溶液中其他微粒相互作用生成的,这些微粒有___ 。
实验I:
| 装置与操作 | 现象 |
 | 溶液立即变红,继续滴加H2O2溶液,红色变浅并逐渐褪去 |
(2)探究实验I中红色褪去的原因:取反应后溶液,
(3)研究发现,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测Fe3+能加快H2O2与SCN-的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III:
实验II:

实验III:

(4)查阅资料:Fe3+加快H2O2与SCN-反应的主要机理有
i.Fe3++H2O2=Fe2++HO2·+H+
ii.Fe2++H2O2=Fe3++·OH+OH-
iii.OH(羟基自由基)具有强氧化性,能直接氧化SCN-
为探究Fe2+对H2O2与SCN-反应速率的影响,设计实验如图:
实验IV:

①t′<t,对比实验IV和II可得出结论:在本实验条件下,
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:
③实验I~IV中均有O2生成,小组同学推测可能是HO2·与溶液中其他微粒相互作用生成的,这些微粒有
您最近一年使用:0次
2021-08-13更新
|
633次组卷
|
7卷引用:考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)
4 . 某兴趣小组对化合物X开展探究实验。

其中:X、A、B均由三种相同的常见短周期元素组成, 。
。
请回答:
(1)组成X的3种元素是C、___________ (填元素符号),X的化学式是___________ 。
(2)写出C的浓溶液与MnO2加热条件下反应的离子方程式___________ 。
(3)氯仿(CHCl3)在空气中发生缓慢氧化也会生成气体B,写出反应的化学方程式___________ 。
(4)气体B与氨气作用生成尿素[CO(NH2)2和一种盐,写出反应的化学方程式___________ 。
(5)钠在气体D中燃烧,可能生成C、Na2CO3、Na2O三种残留固体,设计实验证明三种残留固体中含有C和Na2CO3:___________ 。

其中:X、A、B均由三种相同的常见短周期元素组成,
 。
。请回答:
(1)组成X的3种元素是C、
(2)写出C的浓溶液与MnO2加热条件下反应的离子方程式
(3)氯仿(CHCl3)在空气中发生缓慢氧化也会生成气体B,写出反应的化学方程式
(4)气体B与氨气作用生成尿素[CO(NH2)2和一种盐,写出反应的化学方程式
(5)钠在气体D中燃烧,可能生成C、Na2CO3、Na2O三种残留固体,设计实验证明三种残留固体中含有C和Na2CO3:
您最近一年使用:0次
名校
解题方法
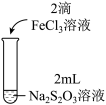
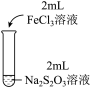
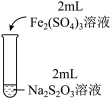
5 . 某实验小组对Na2S2O3分别与FeCl3、Fe2(SO4)3的反应进行实验探究。
实验药品:0.1mol/LNa2S2O3溶液(pH=7);0.1mol/LFeCl3溶液(pH=1);0.05mol/LFe2(SO4)3溶液(pH=1)。
实验过程
资料:ⅰ.Na2S2O3在酸性条件下不稳定,发生自身氧化还原反应;
ⅱ.Fe3++ ⇌Fe(S2O3)+(暗紫色),Fe2+遇
⇌Fe(S2O3)+(暗紫色),Fe2+遇 无明显现象
无明显现象
(1)配制FeCl3溶液时,需要用盐酸酸化,结合离子方程式解释原因:_______ 。
(2)对实验Ⅰ中现象产生的原因探究如下:
①证明有Fe2+生成:取实验Ⅰ中褪色后溶液,加入1~2滴K3[Fe(CN)6]溶液,观察到_______ 。
②实验I中紫色褪去时 被氧化成
被氧化成 ,相关反应的离子方程式是
,相关反应的离子方程式是_______ 。
③实验I和Ⅱ对比,Ⅰ中出现淡黄色浑浊,而Ⅱ中不出现淡黄色浑浊的原因是_______ 。
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
①试剂X是_______ 。
②由实验Ⅳ和实验Ⅴ得出的结论是_______ 。
实验药品:0.1mol/LNa2S2O3溶液(pH=7);0.1mol/LFeCl3溶液(pH=1);0.05mol/LFe2(SO4)3溶液(pH=1)。
实验过程
| 实验编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验操作 |
|
|
|
| 实验现象 | 溶液呈紫色, 静置后紫色迅速褪去, 久置后出现淡黄色浑浊 | 溶液呈紫色, 静置后紫色褪去, 久置后不出现淡黄色浑浊 | 溶液呈紫色, 静置后紫色缓慢褪去, 久置后不出现淡黄色浑浊 |
ⅱ.Fe3++
 ⇌Fe(S2O3)+(暗紫色),Fe2+遇
⇌Fe(S2O3)+(暗紫色),Fe2+遇 无明显现象
无明显现象(1)配制FeCl3溶液时,需要用盐酸酸化,结合离子方程式解释原因:
(2)对实验Ⅰ中现象产生的原因探究如下:
①证明有Fe2+生成:取实验Ⅰ中褪色后溶液,加入1~2滴K3[Fe(CN)6]溶液,观察到
②实验I中紫色褪去时
 被氧化成
被氧化成 ,相关反应的离子方程式是
,相关反应的离子方程式是③实验I和Ⅱ对比,Ⅰ中出现淡黄色浑浊,而Ⅱ中不出现淡黄色浑浊的原因是
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
| 实验编号 | Ⅳ | Ⅴ |
| 实验操作 | 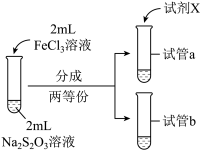 |  |
| 实验现象 | 紫色褪去时间a>b | 紫色褪去时间c<d |
②由实验Ⅳ和实验Ⅴ得出的结论是
您最近一年使用:0次
2021-01-20更新
|
1042次组卷
|
7卷引用:解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)北京市东城区2021届高三上学期期末教学统一检测化学试题(已下线)大题04 无机定量与探究实验-【考前抓大题】备战2021年高考化学(全国通用)(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练辽宁省葫芦岛市2021届高考第一次模拟考试化学试题北京市清华大学附属中学2022-2023学年高二上学期期末化学试题北京理工大学附属中学2023-2024学年高三上学期10月月考化学试题
6 .  是一种优良的饮用水处理剂,可用
是一种优良的饮用水处理剂,可用 、
、 、
、 混合共熔反应制得:
混合共熔反应制得: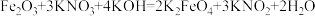 。下列关于该反应的说法
。下列关于该反应的说法不正确 的是
 是一种优良的饮用水处理剂,可用
是一种优良的饮用水处理剂,可用 、
、 、
、 混合共熔反应制得:
混合共熔反应制得: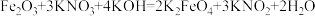 。下列关于该反应的说法
。下列关于该反应的说法A. 是还原剂, 是还原剂,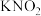 为还原产物 为还原产物 |
B.在熔融条件下氧化性: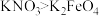 |
C.每生成 ,转移 ,转移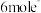 |
D. 在处理饮用水过程中起氧化、杀菌、脱色、除味、净水等作用 在处理饮用水过程中起氧化、杀菌、脱色、除味、净水等作用 |
您最近一年使用:0次
2023-01-02更新
|
527次组卷
|
3卷引用:浙江省杭州学军中学2022-2023学年高三上学期模拟考试化学试题
名校
7 . Z、Y、X、W、Q为五种原子序数依次增大的短周期主族元素。其中Z、Y、W分别位于三个不同周期,Y、Q位于同一主族,Y原子的最外层电子数是W原子的最外层电子数的2倍,Y、X、W三种简单离子的核外电子排布相同。由Z、Y、X、W形成的某种化合物的结构如图所示。下列说法不正确 的是
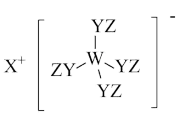
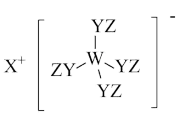
A.简单氢化物的稳定性: |
B.该物质中所有原子均满足最外层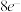 的稳定结构 的稳定结构 |
| C.X与Y、Y与Z均可形成含非极性共价键的化合物 |
| D.W与X两者的最高价氧化物对应的水化物之间可发生反应 |
您最近一年使用:0次
2022-01-25更新
|
911次组卷
|
8卷引用:浙江省宁波市九校2021-2022学年高一上学期期末联考化学试题
名校
解题方法
8 . 取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol·L-1的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液体积之间的关系如图所示。下列有关说法正确的是


| A.A溶液中溶质为Na2CO3和NaHCO3 |
| B.BC段对应离子方程式为OH-+H+=H2O |
| C.通入CO2气体在标况下的体积为56mL |
| D.原NaOH溶液物质的量浓度为0.065mol·L-1 |
您最近一年使用:0次
2022-01-14更新
|
653次组卷
|
3卷引用:浙江省东阳市横店高级中学2022-2023学年高三上学期10月份检测化学试题
9 . 某1 L待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一 种或多种:
现进行如下实验操作(每次实验所加试剂均过量) :
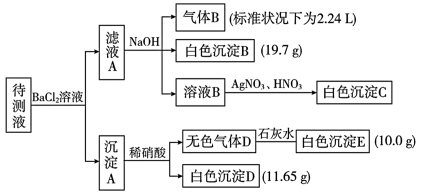
下列说法错误的是
| 阳离子 | K+、NH 、Fe3+、Ba2+ 、Fe3+、Ba2+ |
| 阴离子 | C1-、Br-、CO 、HCO 、HCO 、SO 、SO 、SO 、SO |

下列说法错误的是
A.向溶液B中加AgNO3与HNO3的操作是多余的,待测液中一定含有的离子是K+、NH 、CO 、CO 、HCO 、HCO ,且c(K+)≥0.1mol·L-1 ,且c(K+)≥0.1mol·L-1 |
B.生成白色沉淀B的离子方程式为: Ba2+ +HCO +OH-=BaCO3↓+H2O +OH-=BaCO3↓+H2O |
C.若无色气体D是单个气体,则原溶液中c(SO )=0.05mol·L-1 )=0.05mol·L-1 |
| D.若无色气体D是混合气体,则沉淀A的成分是BaCO3、 BaSO3、 BaSO4 |
您最近一年使用:0次
名校
10 . 钠在液氨中溶剂化速度极快,生成蓝色的溶剂合电子,如图为钠投入液氨中的溶剂化图。钠沉入液氨中,快速得到深蓝色溶液,并慢慢产生气泡。下列说法错误的是
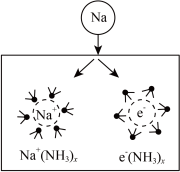

| A.钠的密度比液氨大 |
| B.溶液的导电性增强 |
| C.钠和液氨可发生以下反应:2NH3+2Na=2NaNH2+H2↑ |
| D.0.1mol钠投入液氨生成0.01molH2时,Na共失去0.02mol电子 |
您最近一年使用:0次
2021-05-07更新
|
1591次组卷
|
15卷引用:考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)浙江省湖州市三贤联盟2021-2022学年高一上学期期中考试化学试题山东省临沂市部分县区2020-2021学年高一下学期期中考试化学试题广东省广州市广州大学附属中学2020-2021学年高一下学期4月月考试题(已下线)课时14 钠及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)重庆市第一中学校 2021-2022学年高二上学期入学摸底考试化学试题黑龙江省实验中学2021-2022高三上学期第三次月考(开学考)化学试题天津市耀华中学2021-2022学年高三上学期第一次月考化学试题吉林省吉林市普通中学2022-2023学年高三第一次调研测试化学试题吉林省吉林市普通中学2022-2023学年高三上学期10月调研化学试题天津市耀华中学2022-2023学年高一上学期期中考试化学试题吉林省延边第二中学2022-2023学年高三上学期10月月考化学试题河南省许昌市禹州市高级中学2023-2024学年高三上学期9月月考化学试题福建省莆田第一中学2023-2024学年高一上学期期末考试化学试题