名校
解题方法
1 . 100mL 甲溶液可能含有H+、K+、NH 、Ba2+、CO
、Ba2+、CO 、SO
、SO 、Cl-中的若干种。取该溶液进行连续实验,过程如图(所加试剂均过量,气体全部逸出)。下列说法中不正确的是
、Cl-中的若干种。取该溶液进行连续实验,过程如图(所加试剂均过量,气体全部逸出)。下列说法中不正确的是

 、Ba2+、CO
、Ba2+、CO 、SO
、SO 、Cl-中的若干种。取该溶液进行连续实验,过程如图(所加试剂均过量,气体全部逸出)。下列说法中不正确的是
、Cl-中的若干种。取该溶液进行连续实验,过程如图(所加试剂均过量,气体全部逸出)。下列说法中不正确的是
| A.原溶液一定不存在 H+、Ba2+,可能存在K+,可通过焰色试验来检验 |
| B.原溶液一定存在Cl-, 且c(Cl-)≤0.1mol/L |
| C.沉淀1转化为沉淀2时,放出的气体标况下的体积为224mL |
D.若甲溶液中先加 BaCl2溶液,产生白色沉淀,再加足量稀盐酸沉淀不溶解,不能证明此溶液中含有SO |
您最近一年使用:0次
2023-11-08更新
|
518次组卷
|
2卷引用:黑龙江省实验中学2023-2024学年高一上学期第二次阶段测试化学试题
名校
解题方法
2 . 室温下,1体积的水能溶解约2体积的Cl2。用盛满Cl2的量筒进行如图实验。对实验现象的分析正确的是
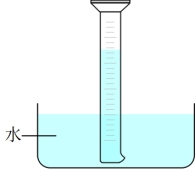

| A.量筒内液面上升,证明Cl2与H2O发生了反应 |
| B.量筒中还剩余气体,是因为Cl2的溶解已达饱和 |
| C.取出量筒中的溶液,在空气中放置一段时间后pH下降,是由于Cl2挥发 |
| D.向大理石中滴加量筒中的溶液,产生气泡,是因为Cl2与H2O反应生成盐酸 |
您最近一年使用:0次
2022-01-20更新
|
272次组卷
|
5卷引用:黑龙江省大庆市肇州县第二中学2022-2023学年高一上学期期中考试化学试题
黑龙江省大庆市肇州县第二中学2022-2023学年高一上学期期中考试化学试题上海市徐汇区2022届高三一模化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)上海市吴淞中学2021-2022学年高一下学期期末考试化学试题上海市虹口区复兴高级中学2022-2023学年高三上学期期中考试化学试题
3 . 某无色溶液,其中可能存在的离子有:Na+、Ag+、Ba2+、Fe3+、Al3+、AlO2-、S2-、SO32-、CO32-、SO42-,现取该溶液进行实验,实验结果如下:
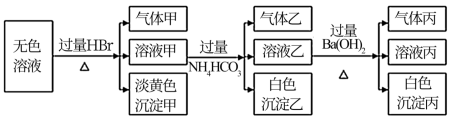
试回答下列问题:
(1)生成沉淀甲的离子方程式为:____________ 。
(2)生成气体丙和沉淀丙的离子方程式为_________ 。
(3)已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表
(4)综上所述,该溶液肯定存在的离子有:_________ 。
(5)针对溶液中可能存在的离子,用实验证明是否存在的方法是_________ 。

试回答下列问题:
(1)生成沉淀甲的离子方程式为:
(2)生成气体丙和沉淀丙的离子方程式为
(3)已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | |||
| 2 | |||
| 3 | 检验CO2 | 澄清石灰水 | 溶液变浑浊 |
(4)综上所述,该溶液肯定存在的离子有:
(5)针对溶液中可能存在的离子,用实验证明是否存在的方法是
您最近一年使用:0次
4 . 一定量的某磁黄铁矿(主要成分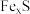 ,S为-2价)与
,S为-2价)与 盐酸恰好完全反应(杂质不与盐酸反应),生成
盐酸恰好完全反应(杂质不与盐酸反应),生成 硫单质、
硫单质、 和一定量的某种气体,且反应后溶液中无
和一定量的某种气体,且反应后溶液中无 。有关说法正确的是
。有关说法正确的是
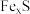 ,S为-2价)与
,S为-2价)与 盐酸恰好完全反应(杂质不与盐酸反应),生成
盐酸恰好完全反应(杂质不与盐酸反应),生成 硫单质、
硫单质、 和一定量的某种气体,且反应后溶液中无
和一定量的某种气体,且反应后溶液中无 。有关说法正确的是
。有关说法正确的是A. | B.生成了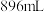 气体 气体 |
C. | D.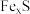 中, 中, |
您最近一年使用:0次
2022-12-16更新
|
433次组卷
|
2卷引用:黑龙江省哈尔滨市第三中学校2023-2024学年高三上学期第一次验收(开学测试)化学试题
名校
5 . 钠在液氨中溶剂化速度极快,生成蓝色的溶剂合电子,如图为钠投入液氨中的溶剂化图。钠沉入液氨中,快速得到深蓝色溶液,并慢慢产生气泡。下列说法错误的是
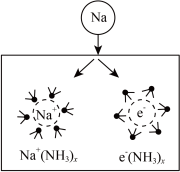

| A.钠的密度比液氨大 |
| B.溶液的导电性增强 |
| C.钠和液氨可发生以下反应:2NH3+2Na=2NaNH2+H2↑ |
| D.0.1mol钠投入液氨生成0.01molH2时,Na共失去0.02mol电子 |
您最近一年使用:0次
2021-05-07更新
|
1591次组卷
|
15卷引用:黑龙江省实验中学2021-2022高三上学期第三次月考(开学考)化学试题
黑龙江省实验中学2021-2022高三上学期第三次月考(开学考)化学试题山东省临沂市部分县区2020-2021学年高一下学期期中考试化学试题广东省广州市广州大学附属中学2020-2021学年高一下学期4月月考试题(已下线)课时14 钠及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)重庆市第一中学校 2021-2022学年高二上学期入学摸底考试化学试题天津市耀华中学2021-2022学年高三上学期第一次月考化学试题浙江省湖州市三贤联盟2021-2022学年高一上学期期中考试化学试题吉林省吉林市普通中学2022-2023学年高三第一次调研测试化学试题吉林省吉林市普通中学2022-2023学年高三上学期10月调研化学试题天津市耀华中学2022-2023学年高一上学期期中考试化学试题吉林省延边第二中学2022-2023学年高三上学期10月月考化学试题河南省许昌市禹州市高级中学2023-2024学年高三上学期9月月考化学试题福建省莆田第一中学2023-2024学年高一上学期期末考试化学试题
名校
6 . 现有下列短周期元素的数据(已知Be的原子半径为0.089nm):
(1)⑧号元素在元素周期表中的位置是___________ 。
(2)①④⑦元素的简单气态氢化物中,稳性定由高到低排序___________ (写化学式)。
(3)写出⑦组成的10电子微粒阳离子的电子式___________ ,并用电子式表示由②⑤组成的盐的形成过程___________ 。
(4)结合原子结构解释③⑥元素的最高价氧化物对应的水化物的碱性强弱___________ 。
(5)含锂材料在社会中应用广泛,如各种储氢材料(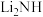 等)、便携式电源材料(
等)、便携式电源材料( 等),根据下列要求回答问题:
等),根据下列要求回答问题:
① 和
和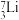 可作核反应堆最佳热载体,
可作核反应堆最佳热载体,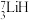 和
和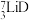 用作高温堆减速剂。下列说法正确的是
用作高温堆减速剂。下列说法正确的是___________ (填字母,下同)。
A. 和
和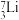 互为同位素 B.
互为同位素 B. 和
和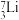 属于同种核素
属于同种核素
C.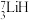 和
和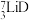 中电子总数相同 D.
中电子总数相同 D.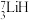 和
和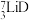 是同种物质
是同种物质
②实验室中锂为避免接触空气保存在___________ 中;锂电池使用时需要注意防水,其原因用离子反应方程式表示为___________ 。
③下列说法不正确的是___________ 。
A.金属性:
B.碱性:
C.半径: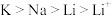
D.氧化性:
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径/nm | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低负化合价 | -2 | -3 | -1 | -3 |
(2)①④⑦元素的简单气态氢化物中,稳性定由高到低排序
(3)写出⑦组成的10电子微粒阳离子的电子式
(4)结合原子结构解释③⑥元素的最高价氧化物对应的水化物的碱性强弱
(5)含锂材料在社会中应用广泛,如各种储氢材料(
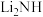 等)、便携式电源材料(
等)、便携式电源材料( 等),根据下列要求回答问题:
等),根据下列要求回答问题:①
 和
和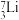 可作核反应堆最佳热载体,
可作核反应堆最佳热载体,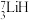 和
和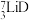 用作高温堆减速剂。下列说法正确的是
用作高温堆减速剂。下列说法正确的是A.
 和
和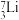 互为同位素 B.
互为同位素 B. 和
和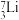 属于同种核素
属于同种核素C.
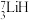 和
和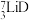 中电子总数相同 D.
中电子总数相同 D.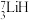 和
和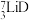 是同种物质
是同种物质②实验室中锂为避免接触空气保存在
③下列说法不正确的是
A.金属性:

B.碱性:

C.半径:
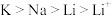
D.氧化性:

您最近一年使用:0次
名校
解题方法
7 . 下图是以太阳能为能源分解水制H2过程示意图。下列说法中,错误的是
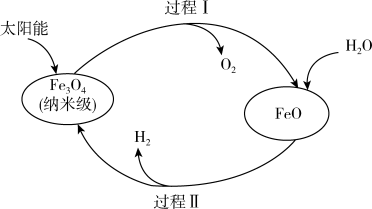

A.过程Ⅰ的反应: |
B.过程Ⅱ的反应: |
| C.两个转化过程都发生了氧化还原反应 |
D.纳米级 在整个过程中起催化作用 在整个过程中起催化作用 |
您最近一年使用:0次
2022-01-25更新
|
294次组卷
|
21卷引用:黑龙江省哈尔滨师范大学附属中学2020-2021学年高一10月月考化学试题
黑龙江省哈尔滨师范大学附属中学2020-2021学年高一10月月考化学试题黑龙江省哈尔滨师范大学附属中学2020—2021学年高一上学期第一次月考化学试题黑龙江省鸡西实验中学2020-2021学年高一上学期第一次月考化学试题湖北省随州市第一中学2020-2021学年高一9月月考化学试题广东省深圳市第七高级中学2020-2021学年高一上学期第一学段考试化学试题(已下线)第10单元 化学反应速率与化学平衡(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷陕西省宝鸡市金台区2020-2021学年高一上学期期中考试化学试题1四川省成都外国语学校2020-2021学年高一上学期期中考试化学试题陕西省宝鸡市金台区2020-2021学年高一上学期期中考试化学试题2广东省中山市迪茵公学2020-2021学年高一上学期10月月考化学试题(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00137】(已下线)【苏州新东方】08 苏高河北省石家庄市第二中学2021-2022学年高一上学期10月月考化学试题广东省广州市三校2021-2022学年高一上学期期中联考化学试题青海省西宁市2021-2022学年高一上学期期末考试化学试题广东省珠海市实验中学与河源高级中学2021-2022学年高一上学期12月考试化学试题广东省深圳市观澜中学2021-2022学年高一上学期12月月考质量检测化学试题广东省深圳市光明区高级中学2022-2023学年高一 上学期月考化学试题安徽省马鞍山市第二中学2022-2023学年高一上学期期中考试化学试题广东省韶关市武江区北江实验中学2022-2023学年高一上学期第一次月考化学试题江西省南昌第二中学2023-2024学年高一上学期第一次月考化学试题
8 . 氯化铁在现代生产和生活中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水氯化铁并对产物做了如下探究实验。

已知:Ⅰ.无水氯化铁在空气中易潮解,加热易升华;
Ⅱ.工业上,向 的铁屑中通入氯气可生产无水氯化铁;
的铁屑中通入氯气可生产无水氯化铁;
Ⅲ.向炽热铁屑中通入氯化氢,可以生产无水氯化亚铁和氢气。
请回答下列问题:
(1)装置的连接顺序为______ (按气流从左向右的方向,填仪器接口字母)。
(2)装置D的作用是_____________________________ ;若缺少装置E对本实验造成的影响是_____________________________ 。
(3)反应结束后,生成的烟状 大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端。要使沉积得
大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端。要使沉积得 进入收集器,需进行的操作是
进入收集器,需进行的操作是_____________________________ ;
(4) 溶液常用于吸收有毒气体
溶液常用于吸收有毒气体 ,反应的离子方程式为
,反应的离子方程式为_____________________________ ;
(5)实验结束并冷却后,将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

淡红色浴液中加入过量 后溶液红色加深的原因是
后溶液红色加深的原因是_________________________ (用离子方程式表示)。
根据实验现象判断,以下说法不正确的是______ (填选项字母)。
A.实验甲说是 发生了反应而不是
发生了反应而不是 发生反应
发生反应
B.实验甲说明是 发生了反应而不是
发生了反应而不是 发生反应
发生反应
C.实验甲中第3份溶液中生成的白色沉淀为
D.实验乙排除 分解产生的
分解产生的 氧化,
氧化, 的可能
的可能
由实验甲和乙得出的结论为____________________________________ 。

已知:Ⅰ.无水氯化铁在空气中易潮解,加热易升华;
Ⅱ.工业上,向
 的铁屑中通入氯气可生产无水氯化铁;
的铁屑中通入氯气可生产无水氯化铁;Ⅲ.向炽热铁屑中通入氯化氢,可以生产无水氯化亚铁和氢气。
请回答下列问题:
(1)装置的连接顺序为
(2)装置D的作用是
(3)反应结束后,生成的烟状
 大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端。要使沉积得
大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端。要使沉积得 进入收集器,需进行的操作是
进入收集器,需进行的操作是(4)
 溶液常用于吸收有毒气体
溶液常用于吸收有毒气体 ,反应的离子方程式为
,反应的离子方程式为(5)实验结束并冷却后,将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

淡红色浴液中加入过量
 后溶液红色加深的原因是
后溶液红色加深的原因是| 实验 | 操作 | 现象 | |
| 实验甲:取褪色后溶液3等份 | 第1份 | 滴加 溶液 溶液 | 无明显变化 |
| 第2份 | 滴加 溶液 溶液 | 溶液变为红色 | |
| 第3份 | 滴加稀盐酸和 | 产生白色沉淀 | |
实验乙:取与褪色后溶液同浓度的 溶液 溶液 | 滴加2湾 溶液,溶液变红,再通入 溶液,溶液变红,再通入 | 无明显变化 | |
A.实验甲说是
 发生了反应而不是
发生了反应而不是 发生反应
发生反应B.实验甲说明是
 发生了反应而不是
发生了反应而不是 发生反应
发生反应C.实验甲中第3份溶液中生成的白色沉淀为

D.实验乙排除
 分解产生的
分解产生的 氧化,
氧化, 的可能
的可能由实验甲和乙得出的结论为
您最近一年使用:0次
2020-09-10更新
|
256次组卷
|
2卷引用:黑龙江省哈尔滨市三中2020届高三第二次月考化学试题
名校
解题方法
9 . 氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属Cu和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuC12•2H2O制备CuCl,并进行相关探究。下列说法不正确的是
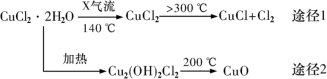
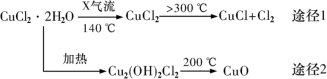
| A.途径1中产生的Cl2可以回收循环利用 |
B.途径2中200℃时反应的化学方程式为:Cu2(OH)2Cl2 2CuO+2HCl↑ 2CuO+2HCl↑ |
C.CuCl与稀硫酸反应的离子方程式为:2CuCl+4H++SO =2Cu2++2Cl-+SO2↑+2H2O =2Cu2++2Cl-+SO2↑+2H2O |
| D.X气体是HCl,目的是抑制CuCl2•2H2O加热过程可能的水解 |
您最近一年使用:0次
2021-03-17更新
|
484次组卷
|
14卷引用:黑龙江省哈尔滨师范大学附属中学2020-2021学年高三上学期开学考试化学试题
黑龙江省哈尔滨师范大学附属中学2020-2021学年高三上学期开学考试化学试题江西省南昌市第二中学2020届高三第四次月考化学试题江西省顶级名校2020届高三第四次联考化学试题浙江省宁波市效实中学2020届高三上学期第一次模拟考试化学试题江西省南昌市新建县第一中学2020届高三上学期第二次月考化学试题山西省晋中市平遥县和诚中学2020届高三上学期12月月考化学试题江西省南昌市进贤一中2019-2020学年高一上学期第二次月考化学试题2020届高三《新题速递·化学》12月第02期(考点01-06)江西省南昌市第二中学2021届高三上学期第三次考试化学试题(已下线)【南昌新东方】2. 南昌二中 左佳鑫浙江省宁波市慈溪市2021届高三适应性测试化学试题北京市昌平区新学道临川学校2021届高三上学期期末考试化学试题浙江省淳安县汾口中学2020-2021学年高二3月月考化学试题江西省宜春市丰城市第九中学2021-2022学年高三上学期第三次月考化学试题
名校
解题方法
10 . 某工厂用饱和NaCl溶液为原料制备高氯酸,其工艺流程如图所示:

已知:NaClO4与盐酸相互反应,并精馏可制得HClO4
下列说法不正确的是

已知:NaClO4与盐酸相互反应,并精馏可制得HClO4
下列说法不正确的是
| A.电解Ⅰ的装置中要用到阳离子交换膜,阳极上有黄绿色气体生成 |
B.“60℃歧化”的反应为:3Cl2+3CO =5Cl-+ClO =5Cl-+ClO +3CO2 +3CO2 |
C.电解Ⅱ中阴极反应式为:ClO +2OH--2 e-=ClO +2OH--2 e-=ClO +H2O +H2O |
| D.循环利用物质A的成分是NaCl |
您最近一年使用:0次
2021-01-15更新
|
741次组卷
|
3卷引用:黑龙江省哈尔滨市第六中学2021-2022学年高二上学期期末考试化学试题



