1 . 三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O(M=491g/mol)是一种感光剂和高效的污水处理剂。
I.某研究小组同学查阅资料发现K3[Fe(C2O4)3]·3H2O加热后会分解产生CO和CO2,于是设计了如下实验进行验证。请回答:
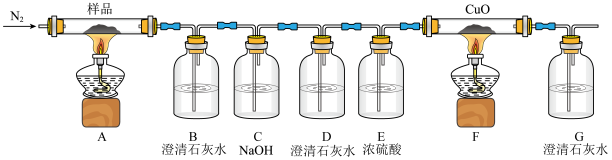
(1)C中NaOH溶液的作用为___________ ;D中澄清石灰水作用为___________ 。
(2)证明有CO产生的现象为___________ 。
(3)该装置还存在的缺陷是___________ 。
II.制备K3[Fe(C2O4)3]·3H2O的途径如下,请回答下列问题:
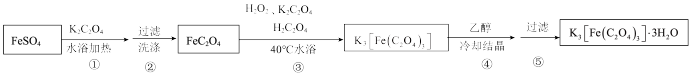
研究小组通过查阅资料得知:
a.K3[Fe(C2O4)3]·3H2O对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如CaC2O4、BaC2O4)难溶于水,但能溶解于稀硝酸。
(4)步骤③中,控制水浴温度不能超过40℃的原因为___________ 。
(5)研究小组的同学对K3[Fe(C2O4)3]组成有两种看法,分别为:
甲同学:K3[Fe(C2O4)3]由K+、Fe3+、 构成;
构成;
乙同学:K3[Fe(C2O4)3]由K+、[Fe(C2O4)3]3-构成。
请设计实验,验证哪位同学的说法是正确的:___________ 。
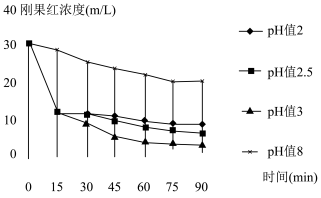
(6)K3[Fe(C2O4)3]联合H2O2体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=___________ 。
(7)关于制备流程,下列说法正确的是___________。
(8)制得的K3[Fe(C2O4)3]·3H2O含少量FeC2O4·2H2O,为测定其纯度,进行如下实验:
步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤II:取20.00mL溶液,与0.1000molL-酸性KMnO4溶液反应,消耗2.46mL。
步骤III:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤IV:将合并液与0.1000mol/L酸性KMnO4溶液反应,消耗2.86mL。
已知 与
与 的反应为(未配平):
的反应为(未配平): +
+ +H+→CO2↑+Mn2++H2O
+H+→CO2↑+Mn2++H2O
①写出Fe2+与酸性KMnO4溶液反应的离子方程式:___________ 。
②研究小组制得的K3[Fe(C2O4)3]·3H2O纯度为___________ 。
I.某研究小组同学查阅资料发现K3[Fe(C2O4)3]·3H2O加热后会分解产生CO和CO2,于是设计了如下实验进行验证。请回答:

(1)C中NaOH溶液的作用为
(2)证明有CO产生的现象为
(3)该装置还存在的缺陷是
II.制备K3[Fe(C2O4)3]·3H2O的途径如下,请回答下列问题:

研究小组通过查阅资料得知:
a.K3[Fe(C2O4)3]·3H2O对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如CaC2O4、BaC2O4)难溶于水,但能溶解于稀硝酸。
(4)步骤③中,控制水浴温度不能超过40℃的原因为
(5)研究小组的同学对K3[Fe(C2O4)3]组成有两种看法,分别为:
甲同学:K3[Fe(C2O4)3]由K+、Fe3+、
 构成;
构成;乙同学:K3[Fe(C2O4)3]由K+、[Fe(C2O4)3]3-构成。
请设计实验,验证哪位同学的说法是正确的:
(6)K3[Fe(C2O4)3]联合H2O2体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=

(7)关于制备流程,下列说法正确的是___________。
| A.步骤①为复分解反应,步骤③为氧化还原反应 |
| B.步骤②判断沉淀是否洗涤干净,可以取少量最后一次洗涤液,加入氯化钡溶液,观察是否有白色沉淀产生 |
| C.步骤④,加入乙醇目的在于降低K3[Fe(C2O4)3]的溶解度,使其结晶析出 |
| D.步骤④⑤可以在日光下进行 |
(8)制得的K3[Fe(C2O4)3]·3H2O含少量FeC2O4·2H2O,为测定其纯度,进行如下实验:
步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤II:取20.00mL溶液,与0.1000molL-酸性KMnO4溶液反应,消耗2.46mL。
步骤III:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤IV:将合并液与0.1000mol/L酸性KMnO4溶液反应,消耗2.86mL。
已知
 与
与 的反应为(未配平):
的反应为(未配平): +
+ +H+→CO2↑+Mn2++H2O
+H+→CO2↑+Mn2++H2O①写出Fe2+与酸性KMnO4溶液反应的离子方程式:
②研究小组制得的K3[Fe(C2O4)3]·3H2O纯度为
您最近一年使用:0次
名校
2 . 某学习小组探究潮湿的 与
与 反应的产物,进行如图实验:
反应的产物,进行如图实验:
(1)试剂Y的名称是________ 。
(2)请写出装置A中的化学方程式________ 。
(3)装置C中潮湿的 与
与 以等物质的量反应,生成
以等物质的量反应,生成 、气体
、气体 和另一种盐,试写出该反应的化学方程式
和另一种盐,试写出该反应的化学方程式________ 。
(4)若将上述装置中的C、D、E部分换成下图所述装置,其中I与Ⅲ是干燥的有色布条,E中盛装 溶液,请回答下列问题:
溶液,请回答下列问题:________ 。
②D中应装入的物质是________ (填序号)。
a.浓硫酸 b.生石灰 c. 固体 d.
固体 d. 固体
固体
 与
与 反应的产物,进行如图实验:
反应的产物,进行如图实验:
(1)试剂Y的名称是
(2)请写出装置A中的化学方程式
(3)装置C中潮湿的
 与
与 以等物质的量反应,生成
以等物质的量反应,生成 、气体
、气体 和另一种盐,试写出该反应的化学方程式
和另一种盐,试写出该反应的化学方程式(4)若将上述装置中的C、D、E部分换成下图所述装置,其中I与Ⅲ是干燥的有色布条,E中盛装
 溶液,请回答下列问题:
溶液,请回答下列问题:
②D中应装入的物质是
a.浓硫酸 b.生石灰 c.
 固体 d.
固体 d. 固体
固体
您最近一年使用:0次
2023-12-12更新
|
63次组卷
|
2卷引用:福建省福州市福建师范大学附属中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
3 . 某化学兴趣小组在实验室中以烧杯为容器,用饱和 溶液制备
溶液制备 胶体,并对其性质做了如下探究:
胶体,并对其性质做了如下探究:
(1)将饱和 溶液加到
溶液加到___________ 中,可制得 胶体。制备过程中,发生化学反应的方程式为
胶体。制备过程中,发生化学反应的方程式为___________ 。
(2)小米同学在制备时,加热时间过久,结果未能得到胶体。那么小米同学得到的物质应该是:_______ (填化学式),该物质属于_______ (请从下面选择)。
A.酸 B.碱 C.盐
(3)小庄同学想证明 胶体已经制备成功,她可以利用
胶体已经制备成功,她可以利用___________ (最简单的方法,请写出方法的名称)进行鉴别。
(4)小静同学利用___________ (填方法名称)方法对 胶体提纯。
胶体提纯。
(5)小邱同学将提纯后的 胶体置于U型管中,通入直流电一段时间后,观察到与电源负极相连的那个电极附近的颜色变深,说明可知
胶体置于U型管中,通入直流电一段时间后,观察到与电源负极相连的那个电极附近的颜色变深,说明可知 胶粒带
胶粒带___________ 电荷(填“正”、“负”或者“不带”)。化学上把这种现象称为___________ 。
 溶液制备
溶液制备 胶体,并对其性质做了如下探究:
胶体,并对其性质做了如下探究:(1)将饱和
 溶液加到
溶液加到 胶体。制备过程中,发生化学反应的方程式为
胶体。制备过程中,发生化学反应的方程式为(2)小米同学在制备时,加热时间过久,结果未能得到胶体。那么小米同学得到的物质应该是:
A.酸 B.碱 C.盐
(3)小庄同学想证明
 胶体已经制备成功,她可以利用
胶体已经制备成功,她可以利用(4)小静同学利用
 胶体提纯。
胶体提纯。(5)小邱同学将提纯后的
 胶体置于U型管中,通入直流电一段时间后,观察到与电源负极相连的那个电极附近的颜色变深,说明可知
胶体置于U型管中,通入直流电一段时间后,观察到与电源负极相连的那个电极附近的颜色变深,说明可知 胶粒带
胶粒带
您最近一年使用:0次
2023-11-02更新
|
18次组卷
|
2卷引用:福建省厦门市第十中学2023-2024学年高一上学期10月月考化学试题
名校
4 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速反应产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置,其中装有浓盐酸的仪器名称为______ 。
②除杂装置B中盛装的试剂为________ 。
③C中有多个反应发生,其中生成高铁酸钾的化学反应方程式为_________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
I.由方案I中溶液变红可知a中含有______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl—氧化,该离子还可能由反应_______ 产生(用离子方程式表示)。
II.方案II可证明K2FeO4氧化Cl—,用KOH溶液洗涤的目的是排除______ 的干扰。
②根据K2FeO4的制备实验得出:氧化性Cl2______ FeO (填“>”或“<”),而方案II实验表明,Cl2和FeO
(填“>”或“<”),而方案II实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速反应产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置,其中装有浓盐酸的仪器名称为
②除杂装置B中盛装的试剂为
③C中有多个反应发生,其中生成高铁酸钾的化学反应方程式为
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生。 |
II.方案II可证明K2FeO4氧化Cl—,用KOH溶液洗涤的目的是排除
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案II实验表明,Cl2和FeO
(填“>”或“<”),而方案II实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
解题方法
5 . 含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取 的化学方程式为
的化学方程式为_______ 。
(2)实验室制取干燥 时,净化与收集
时,净化与收集 所需装置的接口连接顺序为
所需装置的接口连接顺序为_______ 。

(3)某氯水久置后不能使品红溶液褪色,可推测氯水中_______ 已分解。检验此久置氯水中 存在的操作及现象是
存在的操作及现象是_______ 。
(4)某合作学习小组进行以下实验探究。
①实验任务 通过测定溶液电导率,探究温度对AgCl溶解度的影响。
②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。
③提出猜想 猜想a:较高温度的AgCl饱和溶液的电导率较大。
猜想b:AgCl在水中的溶解度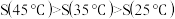
④设计实验、验证猜想 取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。
表1
⑤数据分析、交流讨论
实验结果为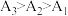 。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有
。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有_______ 。
⑥优化实验 小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5,请完成表2中内容。
表2
⑦实验总结 根据实验1~5的结果,并结合②中信息,小组同学认为猜想b也成立。猜想b成立的判断依据是_______ 。
 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。(1)实验室沿用舍勒的方法制取
 的化学方程式为
的化学方程式为(2)实验室制取干燥
 时,净化与收集
时,净化与收集 所需装置的接口连接顺序为
所需装置的接口连接顺序为
(3)某氯水久置后不能使品红溶液褪色,可推测氯水中
 存在的操作及现象是
存在的操作及现象是(4)某合作学习小组进行以下实验探究。
①实验任务 通过测定溶液电导率,探究温度对AgCl溶解度的影响。
②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。
③提出猜想 猜想a:较高温度的AgCl饱和溶液的电导率较大。
猜想b:AgCl在水中的溶解度
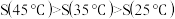
④设计实验、验证猜想 取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。
表1
| 实验序号 | 试样 | 测试温度/℃ | 电导率/( ) ) |
| 1 | Ⅰ:25℃的AgCl饱和溶液 | 25 | A1 |
| 2 | Ⅱ:35℃的AgCl饱和溶液 | 35 | A2 |
| 3 | Ⅲ:45℃的AgCl饱和溶液 | 45 | A3 |
实验结果为
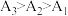 。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有
。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有⑥优化实验 小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5,请完成表2中内容。
表2
| 实验序号 | 试样 | 测试温度/℃ | 电导率/( ) ) |
| 4 | Ⅰ | B1 | |
| 5 | B2 |
您最近一年使用:0次
2022-08-17更新
|
407次组卷
|
2卷引用:福建省福清市一级达标校2022-2023学年高三上学期期中联考化学试题
解题方法
6 . 钴的某些化合物与铁的化合物性质相似,某研究性学习小组为探究钴的化合物的性质,进行了以下实验:
Ⅰ.探究草酸钴的热分解产物
(1)为探究草酸钴的热分解产物,按气体流动方向,各装置的连接顺序为:A→E→________________ 。
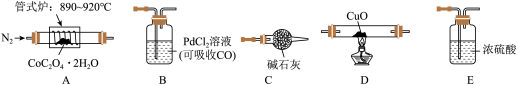
(2)能证明分解产物中有CO的实验现象是_____________________________________________________ 。
(3)取5.49gCoC2O4·2H2O于硬质玻璃管中加热至恒重,冷却、称量,剩余固体的质量为2.25g,球形干燥管增重1.32g。则球形干燥管吸收的气体的结构式为:__________________ ;A中发生反应的化学方程式为:_____________________________________________________ 。
Ⅱ.探究Co(OH)2的还原性及Co(OH)3的氧化性
取A装置所得固体溶解于稀H2SO4中得到粉红色溶液,备用。
已知试剂颜色:CoSO4溶液(粉红色),Co(OH)2(粉红色),Co(OH)3(棕褐色)。
实验记录如表:
Ⅰ.探究草酸钴的热分解产物
(1)为探究草酸钴的热分解产物,按气体流动方向,各装置的连接顺序为:A→E→

(2)能证明分解产物中有CO的实验现象是
(3)取5.49gCoC2O4·2H2O于硬质玻璃管中加热至恒重,冷却、称量,剩余固体的质量为2.25g,球形干燥管增重1.32g。则球形干燥管吸收的气体的结构式为:
Ⅱ.探究Co(OH)2的还原性及Co(OH)3的氧化性
取A装置所得固体溶解于稀H2SO4中得到粉红色溶液,备用。
已知试剂颜色:CoSO4溶液(粉红色),Co(OH)2(粉红色),Co(OH)3(棕褐色)。
实验记录如表:
| 实验操作及现象 | 实验分析 | |
| 实验1 | 取少许粉红色溶液于试管中,滴加0.1mol·L-1NaOH溶液,生成粉红色沉淀,并将该沉淀分成两份 | |
| 实验2 | 取一份实验1中所得的粉红色沉淀,加入3%的H2O2溶液,粉红色沉淀立即变为棕褐色 | 反应的化学方程式为 |
| 实验3 | 向实验2得到的棕褐色沉淀中滴加浓盐酸,固体逐渐溶解,并有黄绿色气体产生 | 反应的离子方程式为 |
| 实验4 | 取另一份实验1中所得的粉红色沉淀,滴加浓盐酸,粉红色沉淀溶解,未见气体生成 | 酸性条件下,Cl2、Co(OH)2、Co(OH)3的氧化能力由大到小的顺序是 |
您最近一年使用:0次
名校
7 . A、B、C、D为原子序数依次增大的短周期元素,A元素气态氢化物的水溶液呈碱性,B为最活泼的非金属元素,C元素原子的电子层数是最外层电子数的3倍,D元素最高化合价为+6价。
(1)A元素气态氢化物的电子式为______ ;B在元素周期表中的位置为________ 。
(2)DBn做制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂。该物质的摩尔质量为146 g·mol-1,则该物质的化学式为_____ 。已知DBn在温度高于45℃时为气态,DBn属于____ 晶体。该物质被称为人造惰性气体,目前广泛应用于电器工业,在空气中不能燃烧,请从氧化还原角度分析不能燃烧的理由_________ 。
(3)C与氢元素组成1∶1的化合物,与水发生剧烈反应生成碱和一种气体,写出该反应的化学反应方程式____________ ,生成1mol气体转移的电子的数目为______ 个。
(4)A和C两元素可形成离子化合物甲。取13.0g化合物甲,加热使其完全分解,生成A的单质和C的单质,生成的A单质气体折合成标准状况下的体积为6.72L。化合物甲分解的化学方程式为______________________________ 。
(5)D元素的+4价含氧酸钠盐在空气中容易变质,设计实验方案证明该盐已经变质____ 。
(1)A元素气态氢化物的电子式为
(2)DBn做制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂。该物质的摩尔质量为146 g·mol-1,则该物质的化学式为
(3)C与氢元素组成1∶1的化合物,与水发生剧烈反应生成碱和一种气体,写出该反应的化学反应方程式
(4)A和C两元素可形成离子化合物甲。取13.0g化合物甲,加热使其完全分解,生成A的单质和C的单质,生成的A单质气体折合成标准状况下的体积为6.72L。化合物甲分解的化学方程式为
(5)D元素的+4价含氧酸钠盐在空气中容易变质,设计实验方案证明该盐已经变质
您最近一年使用:0次
名校
解题方法
8 . Co(OH)2在空气中加热时,固体(不含其他杂质)质量随温度变化的曲线如图所示,取400℃时的产物(其中Co的化合价为+2,+3),用500mL5.1mol·L-1盐酸将其恰好完全溶解,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。下列说法错误的是
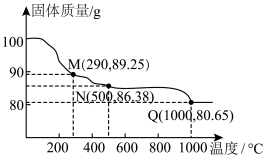

A.290℃时,固体的成分仅有 |
B.400℃时,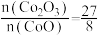 |
| C.500℃时,固体中氧元素总质量分数约为26.6% |
| D.生成的黄绿色气体可用于工业上生产“84”消毒液 |
您最近一年使用:0次
2022-07-03更新
|
549次组卷
|
4卷引用:2022年福建省高考真题变式题(选择题6-10)
(已下线)2022年福建省高考真题变式题(选择题6-10)河北省保定市2021-2022学年高二下学期期末考试化学试题山西省长治市2021-2022学年高二下学期期末联考化学试题江西省南昌市第二中学2022-2023学年高三上学期第三次考试化学试题
解题方法
9 . 二氧化锰矿粉中 含量测定实验流程如图。下列说法错误的是
含量测定实验流程如图。下列说法错误的是

 含量测定实验流程如图。下列说法错误的是
含量测定实验流程如图。下列说法错误的是
A.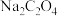 将 将 还原为 还原为 |
| B.滴定终点溶液的颜色从无色变为浅紫色 |
C. 含量为 含量为 |
D.若滴定终点时滴定管尖嘴处出现气泡,则测得 含量偏小 含量偏小 |
您最近一年使用:0次
2022-04-02更新
|
862次组卷
|
4卷引用:福建省八地市(福州、厦门、泉州、莆田、南平、宁德、三明、龙岩)2022届高三毕业班4月诊断性联考化学试题
福建省八地市(福州、厦门、泉州、莆田、南平、宁德、三明、龙岩)2022届高三毕业班4月诊断性联考化学试题(已下线)微专题45 定量测量类综合实验-备战2023年高考化学一轮复习考点微专题山东省临沂市沂水县2022-2023学年高二上学期学科素养(期中)检测化学试题(已下线)第12讲 酸碱中和滴定和氧化还原反应滴定-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)
名校
解题方法
10 . 氧化铍(BeO)在航天航空等领域有着广泛的应用。一种以预处理后的硅铍矿(主要含BeO、Fe2O3、SiO2和FeO等)为原料提取BeO的流程如下图所示:

已知:Be(OH)2具有两性,在强碱性溶液中可转化为BeO 。下列说法错误的是
。下列说法错误的是

已知:Be(OH)2具有两性,在强碱性溶液中可转化为BeO
 。下列说法错误的是
。下列说法错误的是| A.“酸浸”步骤所得“滤渣①”的主要成分为Si |
| B.“滤液②”经处理后可获得副产品Na2SO4·10H2O |
C.“碱溶”时,主要反应为Be(OH)2+2OH-=BeO +2H2O +2H2O |
| D.“水解”时,适当增大溶液pH有利于提高BeO的提取率 |
您最近一年使用:0次
2022-05-23更新
|
1304次组卷
|
9卷引用:福建省福州第三中学2021-2022学年高一下学期期末考试化学试题
福建省福州第三中学2021-2022学年高一下学期期末考试化学试题广东省深圳市2021届高三4月第二次调研考试化学试题(已下线)卷05 工艺流程型选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)湖南省株洲市九方中学2022届高三下学期第二次模拟考试化学试题(已下线)专题13 物质的反应和转化-2022年高考真题模拟题分项汇编(已下线)第九章 化学实验基础及综合实验(测)-2023年高考化学一轮复习讲练测(全国通用)新疆喀什地区英吉沙县2022-2023学年高三上学期11月期中考试化学试题湖北省十堰市郧阳中学2023届高三11月月考化学训练题湖南株洲南方中学2022-2023学年高三第四次月考化学试题



