1 . 某小组同学分别探究 溶液、
溶液、 溶液的性质。
溶液的性质。
Ⅰ.探究 溶液的性质。
溶液的性质。
(1)预测 具有氧化性,因此可以与Zn反应,此时Zn体现
具有氧化性,因此可以与Zn反应,此时Zn体现______ 性。
(2)预测 具有还原性,预测依据是
具有还原性,预测依据是______ ,因此可以与酸性 溶液反应。
溶液反应。
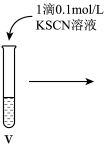
(3)进行如下实验操作:
①i中的现象是产生白色沉淀,变为灰绿色,最终为红褐色,用化学方程式表示产生该现象的原因: 、
、______ 。
②iii中的现象是______ 。
(4)某同学认为 中现象并不能证明
中现象并不能证明 具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象,②为证实该反应中
具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象,②为证实该反应中 确实被氧化,需要在反应后的溶液中加入试剂
确实被氧化,需要在反应后的溶液中加入试剂______ ,观察到现象______ 。
Ⅱ.探究 溶液的性质。
溶液的性质。
小组同学进行如下实验操作并观察到对应现象:
(5)ⅳ中反应的离子方程式是______ 。
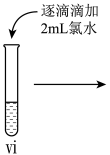
(6)vi中滴加氯水过程中,氯水反应的离子方程式是______ 。
Ⅲ.小组同学探究vi中褪色原因,提出两种假设:a.铁离子被转化,b.被转化。
(7)进一步预测 可能被转化为
可能被转化为 ,通过实验验证了该预测,写出实验操作及现象
,通过实验验证了该预测,写出实验操作及现象______ 。
 溶液、
溶液、 溶液的性质。
溶液的性质。Ⅰ.探究
 溶液的性质。
溶液的性质。(1)预测
 具有氧化性,因此可以与Zn反应,此时Zn体现
具有氧化性,因此可以与Zn反应,此时Zn体现(2)预测
 具有还原性,预测依据是
具有还原性,预测依据是 溶液反应。
溶液反应。(3)进行如下实验操作:
 | 序号 | 操作 |
i | 滴加 | |
iii | 加入少量锌粉 | |
iii | 滴加酸性 |
 、
、②iii中的现象是
(4)某同学认为
 中现象并不能证明
中现象并不能证明 具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象,②为证实该反应中
具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象,②为证实该反应中 确实被氧化,需要在反应后的溶液中加入试剂
确实被氧化,需要在反应后的溶液中加入试剂Ⅱ.探究
 溶液的性质。
溶液的性质。小组同学进行如下实验操作并观察到对应现象:
操作 |
|
|
|
现象 | 溶液由棕黄色变为浅绿色 | 无明显现象 | 溶液变为红色,而后红色褪去 |
(5)ⅳ中反应的离子方程式是
(6)vi中滴加氯水过程中,氯水反应的离子方程式是
Ⅲ.小组同学探究vi中褪色原因,提出两种假设:a.铁离子被转化,b.被转化。
(7)进一步预测
 可能被转化为
可能被转化为 ,通过实验验证了该预测,写出实验操作及现象
,通过实验验证了该预测,写出实验操作及现象
您最近一年使用:0次
解题方法
2 . Ⅰ. 广泛用作水处理剂及漂白剂。
广泛用作水处理剂及漂白剂。
已知:25℃时 溶液中
溶液中 、
、 物质的量分数随
物质的量分数随 的分布如图所示。
的分布如图所示。

(1)工业上将 通入
通入 的
的 溶液中制备
溶液中制备 。
。
①制备 的化学方程式为
的化学方程式为______ 。
②溶液 时,该溶液中主要存在的阴离子有
时,该溶液中主要存在的阴离子有______ (填化学式)。
Ⅱ. 是一种重要的杀菌消毒剂,其一种生产工艺如下:
是一种重要的杀菌消毒剂,其一种生产工艺如下:

(2)写出“反应”步骤中生成 的化学方程式
的化学方程式______ 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去 和
和 ,要加入的试剂分别为
,要加入的试剂分别为______ ,______ 。精制时如何证明 已经完全除尽:
已经完全除尽:______ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量 ,发生如下反应:
,发生如下反应:
______ ______
______ ______
______ ______
______ ______
______ ______
______
①配平上述化学方程式。______
②某容器中发生一个化学反应,其中涉及 、
、 、
、 、
、 、
、 、
、 六种粒子。其中
六种粒子。其中 、
、 的物质的量随时间变化的曲线如图所示。
的物质的量随时间变化的曲线如图所示。

则该反应的离子方程式为:______ 。
 广泛用作水处理剂及漂白剂。
广泛用作水处理剂及漂白剂。已知:25℃时
 溶液中
溶液中 、
、 物质的量分数随
物质的量分数随 的分布如图所示。
的分布如图所示。
(1)工业上将
 通入
通入 的
的 溶液中制备
溶液中制备 。
。①制备
 的化学方程式为
的化学方程式为②溶液
 时,该溶液中主要存在的阴离子有
时,该溶液中主要存在的阴离子有Ⅱ.
 是一种重要的杀菌消毒剂,其一种生产工艺如下:
是一种重要的杀菌消毒剂,其一种生产工艺如下:
(2)写出“反应”步骤中生成
 的化学方程式
的化学方程式(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去
 和
和 ,要加入的试剂分别为
,要加入的试剂分别为 已经完全除尽:
已经完全除尽:(4)“尾气吸收”是吸收“电解”过程排出的少量
 ,发生如下反应:
,发生如下反应:______
 ______
______ ______
______ ______
______ ______
______ ______
______
①配平上述化学方程式。
②某容器中发生一个化学反应,其中涉及
 、
、 、
、 、
、 、
、 、
、 六种粒子。其中
六种粒子。其中 、
、 的物质的量随时间变化的曲线如图所示。
的物质的量随时间变化的曲线如图所示。
则该反应的离子方程式为:
您最近一年使用:0次
名校
解题方法
3 . 下表为八种短周期主族元素的部分性质(已知铍的原子半径为0.89×10-10m):
(1)元素Z在元素周期表中的位置为______ 。
(2)写出 Q与J两种元素最高价氧化物对应的水化物之间反应的离子方程式________ 。
(3)R与T相比,非金属性较强的是____ (用元素符号表示),下列事实能证明这一结论的是_____ (填字母)。
a.常温下T的单质呈固态,R的单质呈气态
b.R的氢化物比T的氢化物稳定
c.R的氢化物水溶液酸性比T的氧化物对应水化物酸性强
(4)J与Q相比,金属性较强的是_____ (用元素符号表示),能证明这一结论的依据是__ 。
(5)根据表中数据推测,M的原子半径的最小范围是____________ 。
元素代号 | X | Y | Z | M | R | J | Q | T |
原子半径 /10-10m | 0.74 | 0.75 | 0.99 | 1.86 | 1.43 | 1.10 | ||
主要化合价 | -2 | +5、-3 | +4、-4 | +7、-1 | +1 | +3 | +5、-3 | |
其它 | 原子核内无中子 | 重要的半导体材料 | 有两种氧化物 |
(2)写出 Q与J两种元素最高价氧化物对应的水化物之间反应的离子方程式
(3)R与T相比,非金属性较强的是
a.常温下T的单质呈固态,R的单质呈气态
b.R的氢化物比T的氢化物稳定
c.R的氢化物水溶液酸性比T的氧化物对应水化物酸性强
(4)J与Q相比,金属性较强的是
(5)根据表中数据推测,M的原子半径的最小范围是
您最近一年使用:0次
名校
解题方法
4 . 某小组探究S单质与 溶液加热后得到的产物。向5
溶液加热后得到的产物。向5
 溶液中加入少量硫粉,加热至固体全部溶解,冷却后,得到淡黄色溶液A(
溶液中加入少量硫粉,加热至固体全部溶解,冷却后,得到淡黄色溶液A( )。
)。
【资料】1. 溶液无色,
溶液无色, 能与
能与 反应生成
反应生成 (臭鸡蛋气味气体),能与
(臭鸡蛋气味气体),能与 反应生成
反应生成 (黑色固体)。
(黑色固体)。
2. 溶液呈黄色,
溶液呈黄色, 能与
能与 反应生成S和
反应生成S和 ,能与
,能与 反应生成S和
反应生成S和 。
。
3. 和
和 均不能使品红褪色,
均不能使品红褪色, 或高浓度
或高浓度 能使品红褪色。
能使品红褪色。
(1)如图所示,进行实验I和Ⅱ,证实了产物中含 。
。

①补全实验Ⅱ的方案_______ (在横线上填写试剂)。
②证实产物中含 的现象是
的现象是_______ 。
(2)依据产物中含 ,甲同学认为产物还应该有
,甲同学认为产物还应该有 ,请依据氧化还原反应的规律进行解释:
,请依据氧化还原反应的规律进行解释:_______ 。
(3)甲同学推测溶液A中可能还含有 ,因为
,因为 在加热过程中可能与空气中氧气反应。
在加热过程中可能与空气中氧气反应。
针对此观点继续实验Ⅲ:取溶液A于试管中,加入足量稀盐酸,立即出现淡黄色浑浊,同时产生臭鸡蛋气味的气体,离心沉淀(固液分离),得到无色溶液B和淡黄色固体。取无色溶液B,_______ (填操作和现象),证实溶液A中存在 。
。
(4)甲同学根据溶液A呈淡黄色猜想其中还存在 ,并认为实验Ⅲ中的现象可做为证据。但乙同学认为实验Ⅲ中的现象不能说明,理由是
,并认为实验Ⅲ中的现象可做为证据。但乙同学认为实验Ⅲ中的现象不能说明,理由是_______ 。
(5)继续进行实验Ⅳ,验证了溶液A中存在 。
。
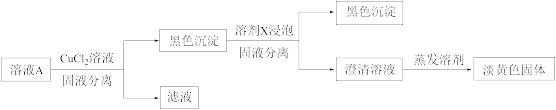
①溶剂X是_______ (填化学式)。
②证明溶液中含 的实验证据是
的实验证据是_______ 。
进一步实验,得到结论:硫单质在碱性条件下歧化反应的产物主要为 和
和 ,溶液中还会生成少量的
,溶液中还会生成少量的 、
、 和
和 。
。
 溶液加热后得到的产物。向5
溶液加热后得到的产物。向5
 溶液中加入少量硫粉,加热至固体全部溶解,冷却后,得到淡黄色溶液A(
溶液中加入少量硫粉,加热至固体全部溶解,冷却后,得到淡黄色溶液A( )。
)。【资料】1.
 溶液无色,
溶液无色, 能与
能与 反应生成
反应生成 (臭鸡蛋气味气体),能与
(臭鸡蛋气味气体),能与 反应生成
反应生成 (黑色固体)。
(黑色固体)。2.
 溶液呈黄色,
溶液呈黄色, 能与
能与 反应生成S和
反应生成S和 ,能与
,能与 反应生成S和
反应生成S和 。
。3.
 和
和 均不能使品红褪色,
均不能使品红褪色, 或高浓度
或高浓度 能使品红褪色。
能使品红褪色。(1)如图所示,进行实验I和Ⅱ,证实了产物中含
 。
。
①补全实验Ⅱ的方案
②证实产物中含
 的现象是
的现象是(2)依据产物中含
 ,甲同学认为产物还应该有
,甲同学认为产物还应该有 ,请依据氧化还原反应的规律进行解释:
,请依据氧化还原反应的规律进行解释:(3)甲同学推测溶液A中可能还含有
 ,因为
,因为 在加热过程中可能与空气中氧气反应。
在加热过程中可能与空气中氧气反应。针对此观点继续实验Ⅲ:取溶液A于试管中,加入足量稀盐酸,立即出现淡黄色浑浊,同时产生臭鸡蛋气味的气体,离心沉淀(固液分离),得到无色溶液B和淡黄色固体。取无色溶液B,
 。
。(4)甲同学根据溶液A呈淡黄色猜想其中还存在
 ,并认为实验Ⅲ中的现象可做为证据。但乙同学认为实验Ⅲ中的现象不能说明,理由是
,并认为实验Ⅲ中的现象可做为证据。但乙同学认为实验Ⅲ中的现象不能说明,理由是(5)继续进行实验Ⅳ,验证了溶液A中存在
 。
。
①溶剂X是
②证明溶液中含
 的实验证据是
的实验证据是进一步实验,得到结论:硫单质在碱性条件下歧化反应的产物主要为
 和
和 ,溶液中还会生成少量的
,溶液中还会生成少量的 、
、 和
和 。
。
您最近一年使用:0次
2023-01-06更新
|
671次组卷
|
3卷引用:江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题
名校
5 . 用如图所示实验装置进行相关实验探究,其中装置不合理的是


| A.用装置甲鉴别纯碱与小苏打 | B.用装置乙证明 与水反应放热 与水反应放热 |
C.用装置丙分离 混合物 混合物 | D.用装置丁探究钠与 反应 反应 |
您最近一年使用:0次
2022-01-24更新
|
237次组卷
|
2卷引用:江苏省扬州中学2023-2024学年高一上学期11月期中化学试题
6 . 铁在冷的稀硝酸中反应的主要还原产物为NO,而在热的稀硝酸中反应其主要还原产物为 ,当溶液更稀主要还原产物为
,当溶液更稀主要还原产物为 ,现向一定量的冷的稀硝酸中逐渐加入铁,如图为反应液中
,现向一定量的冷的稀硝酸中逐渐加入铁,如图为反应液中 的浓度与产生的气体量随铁的物质的量的变化情况(假设在任一气体产生曲线段内只有一种还原产物),下列有关说法不正确的是(已知:
的浓度与产生的气体量随铁的物质的量的变化情况(假设在任一气体产生曲线段内只有一种还原产物),下列有关说法不正确的是(已知: )
)
 ,当溶液更稀主要还原产物为
,当溶液更稀主要还原产物为 ,现向一定量的冷的稀硝酸中逐渐加入铁,如图为反应液中
,现向一定量的冷的稀硝酸中逐渐加入铁,如图为反应液中 的浓度与产生的气体量随铁的物质的量的变化情况(假设在任一气体产生曲线段内只有一种还原产物),下列有关说法不正确的是(已知:
的浓度与产生的气体量随铁的物质的量的变化情况(假设在任一气体产生曲线段内只有一种还原产物),下列有关说法不正确的是(已知: )
)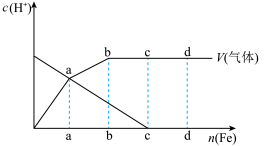
| A.若oa段与ab段铁的物质的量相等,则这两段所产生的气体的物质的量之比为2:1 |
B.bc段发生反应的离子方程式为: |
C.反应到达c点时,溶液中主要阳离子是 |
| D.若反应到达d点时反应完全结束,c、d两点对应的铁的物质的量之比为2:3 |
您最近一年使用:0次
名校
解题方法
7 . 已知:将Cl2通入适量NaOH溶液中,反应会放热,当温度升高后会发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O。则Cl2通入NaOH溶液的产物中可能有NaCl、NaClO、NaClO3中的两种或三种,且 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是| A.与碱的反应中,Cl2既是氧化剂又是还原剂 |
| B.参加反应的Cl2物质的量为0.5a mol |
C.若某温度下,反应后 =6,则溶液中 =6,则溶液中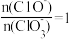 |
D.改变温度,反应中转移电子的物质的量可能为 mol mol |
您最近一年使用:0次
2022-10-24更新
|
2079次组卷
|
12卷引用:江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题
江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题江苏省苏州中学2022-2023学年高一下学期开学考试化学试题山东省实验中学2022-2023学年高一上学期11月期中考试化学试题甘肃省酒泉市玉门油田第一中学2022-2023学年高一上学期期中考试化学(A卷)试题北京市第八中学2022-2023学年高一上学期12月月考化学试题陕西省榆林中学2022-2023学年高一上学期期末考试化学试题浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试(选考)化学试题陕西省安康市2022-2023学年高一下学期开学摸底考试化学试题辽宁省沈阳市五校协作体2022-2023学年高一上学期期末考试化学试题 山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题(已下线)专题03 氧化还原反应-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
8 . 某新型纳米材料氧缺位铁酸盐ZnFe2Ox(3<x<4),能在常温下将工业废气中的SO2、NO2等转化为单质而除去,由锌灰(含ZnO和少量PbO、CuO、Fe2O3等)为主要原料制备氧缺位铁酸盐及其转化废气的流程如图所示,下列说法不正确 的是
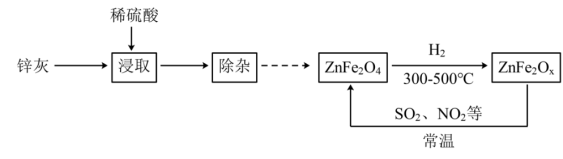

| A.浸取时为了提高酸浸效率,可以搅拌或延长浸取时间 |
| B.“除杂”过程中需要加入足量锌粉等操作,与锌粉反应的金属离子有Fe3+、Cu2+ |
| C.除去SO2时,ZnFe2Ox在反应中表现出氧化性 |
| D.ZnFe2O4与H2反应制得1molZnFe2Ox时,转移的电子物质的量为(8-2x)mol |
您最近一年使用:0次
2022-05-14更新
|
1311次组卷
|
6卷引用:江苏省连云港市2021-2022学年高三高考考前模拟考试(一)化学试题
江苏省连云港市2021-2022学年高三高考考前模拟考试(一)化学试题江苏省徐州市2021-2022学年高一下学期期末抽测化学试题江苏省扬州市宝应县2023-2024学年高三上学期期末模拟化学试卷(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)选择题6-10
9 . 某工厂以硝酸为原料生产亚硝酸钠,并对亚硝酸钠进行多角度探究。其工艺流程如下:

已知: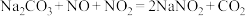 ;
;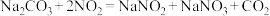
(1)分解塔中填有大量的瓷环,其目的是:___________ 。分解塔中的温度不宜过高,其原因是:___________ 。
(2)按一定计量比在分解塔中通 和喷入硝酸,若反应后生成的
和喷入硝酸,若反应后生成的 与
与 物质的量之比恰好
物质的量之比恰好 ,则分解塔中发生反应的化学方程式为
,则分解塔中发生反应的化学方程式为___________ 。
(3)下列关于吸收塔中变化,说法正确的是____ 。
a.升高吸收塔的温度,有利于氮氧化物的吸收
b.加快通入吸收塔中气体的流速,有利于提高氮氧化物的利用率
c.可向尾气中通入一定量的 ,再通入吸收塔中,实现循环吸收
,再通入吸收塔中,实现循环吸收
(4)酸性条件下 具有还原性。取
具有还原性。取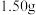 样品,配成
样品,配成 溶液。分别取出
溶液。分别取出 ,用
,用 酸性标准溶液滴定三次,测得平均消耗
酸性标准溶液滴定三次,测得平均消耗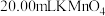 溶液。其离子方程式为:
溶液。其离子方程式为: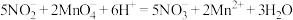 。计算样品中
。计算样品中 的纯度
的纯度____ 。(请写出计算过程)
(5)设计实验验证酸性条件下 具有氧化性:取一定量
具有氧化性:取一定量 溶液,
溶液,__ 。补充实验方案。(必须使用的试剂: 溶液、稀硫酸、淀粉溶液。)
溶液、稀硫酸、淀粉溶液。)

已知:
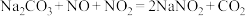 ;
;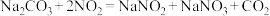
(1)分解塔中填有大量的瓷环,其目的是:
(2)按一定计量比在分解塔中通
 和喷入硝酸,若反应后生成的
和喷入硝酸,若反应后生成的 与
与 物质的量之比恰好
物质的量之比恰好 ,则分解塔中发生反应的化学方程式为
,则分解塔中发生反应的化学方程式为(3)下列关于吸收塔中变化,说法正确的是
a.升高吸收塔的温度,有利于氮氧化物的吸收
b.加快通入吸收塔中气体的流速,有利于提高氮氧化物的利用率
c.可向尾气中通入一定量的
 ,再通入吸收塔中,实现循环吸收
,再通入吸收塔中,实现循环吸收(4)酸性条件下
 具有还原性。取
具有还原性。取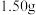 样品,配成
样品,配成 溶液。分别取出
溶液。分别取出 ,用
,用 酸性标准溶液滴定三次,测得平均消耗
酸性标准溶液滴定三次,测得平均消耗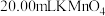 溶液。其离子方程式为:
溶液。其离子方程式为: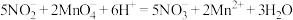 。计算样品中
。计算样品中 的纯度
的纯度(5)设计实验验证酸性条件下
 具有氧化性:取一定量
具有氧化性:取一定量 溶液,
溶液, 溶液、稀硫酸、淀粉溶液。)
溶液、稀硫酸、淀粉溶液。)
您最近一年使用:0次
名校
解题方法
10 . 金属镓有“电子工业脊梁”的美誉,镓与铝的化学性质类似。从刚玉渣(含钛、镓的低硅铁合金,还含有少量氧化铝)回收镓的流程如图所示:

溶液中金属离子开始沉淀利和完全沉淀的pH如下表所示:
请回答下列问题。
(1)“酸浸”过程中禁止明火加热,原因是___________ 。
(2)“结晶”过程中得到 的具体操作为
的具体操作为___________ 。
(3)“中和沉淀”过程中pH应调节的范围为___________ 。
(4)“碳酸化”过程中不能通入过量 的原因为
的原因为___________ (用离子方程式表示)。
(5)下列说法中不正确的是___________(填字母)。
(6)GaN具有优异的光电性能。工业上常采用在1100℃条件下,利用Ga与 反应可制备GaN,该过程的化学方程式为
反应可制备GaN,该过程的化学方程式为___________ 。

溶液中金属离子开始沉淀利和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时 的pH 的pH | 4.5 | 3.7 | 2.2 | 7.5 |
沉淀完全时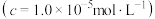 的pH 的pH | 5.5 | 4.7 | 3.2 | 9.0 |
(1)“酸浸”过程中禁止明火加热,原因是
(2)“结晶”过程中得到
 的具体操作为
的具体操作为(3)“中和沉淀”过程中pH应调节的范围为
(4)“碳酸化”过程中不能通入过量
 的原因为
的原因为(5)下列说法中不正确的是___________(填字母)。
| A.为提高浸出率,可将刚玉渣研磨 |
B.“结晶”过程中得到的 可作为净水剂 可作为净水剂 |
C.由流程图可知酸性: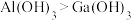 |
| D.“碱浸”过程中可用氨水代替NaOH溶液 |
 反应可制备GaN,该过程的化学方程式为
反应可制备GaN,该过程的化学方程式为
您最近一年使用:0次
2023-07-10更新
|
261次组卷
|
2卷引用:江苏省淮阴中学2022-2023学年高一下学期6月阶段测试化学试题