1 . 某小组同学探究不同条件下氯气与二价锰化合物的反应,
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、 (绿色)、
(绿色)、 (紫色);Mn(OH)2为不溶于水的白色固体。
(紫色);Mn(OH)2为不溶于水的白色固体。
ii.酸性条件下, 可被Cl-还原为Mn2+;浓碱条件下,
可被Cl-还原为Mn2+;浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。
iii.Cl2的氧化性与溶液的酸碱性无关,Cl2与碱溶液反应可生成NaClO,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
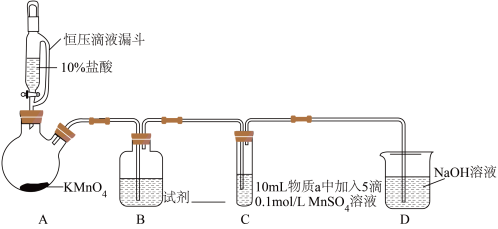
(1)A中制取Cl2的离子方程式为___________
(2)D装置的作用___________ 。
(3)通入Cl2前,Ⅱ、Ⅲ中沉淀由白色变为黑色的化学方程式为___________ 。
(4)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是___________ 。
(5)根据资料ii,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二;可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①化学方程式表示可能导致溶液碱性减弱的原因___________ ,但通过实验测定溶液的碱性变化很小。
②取Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深,溶液紫色变为绿色的离子方程式为___________ ,溶液绿色缓慢加深,原因是MnO2被NaClO氧化,可证明Ⅲ的悬浊液中氧化剂过量;
③取Ⅱ中放置后的1mL悬浊液,加入4mL水使溶液碱性减弱后,溶液紫色缓慢加深,发生的反应离子方程式是___________ 。
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、
 (绿色)、
(绿色)、 (紫色);Mn(OH)2为不溶于水的白色固体。
(紫色);Mn(OH)2为不溶于水的白色固体。ii.酸性条件下,
 可被Cl-还原为Mn2+;浓碱条件下,
可被Cl-还原为Mn2+;浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。iii.Cl2的氧化性与溶液的酸碱性无关,Cl2与碱溶液反应可生成NaClO,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):

| 序号 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)D装置的作用
(3)通入Cl2前,Ⅱ、Ⅲ中沉淀由白色变为黑色的化学方程式为
(4)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(5)根据资料ii,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二;可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①化学方程式表示可能导致溶液碱性减弱的原因
②取Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深,溶液紫色变为绿色的离子方程式为
③取Ⅱ中放置后的1mL悬浊液,加入4mL水使溶液碱性减弱后,溶液紫色缓慢加深,发生的反应离子方程式是
您最近一年使用:0次
解题方法
2 . 钙钛矿是一类陶瓷卤化物,通式为 ,在高温催化及光催化方面应用前景广泛。实验室制备一种钙钛矿型复合物
,在高温催化及光催化方面应用前景广泛。实验室制备一种钙钛矿型复合物 的方法如下:
的方法如下:
实验用品:氯化锌 、溴化铅
、溴化铅 、碳酸铯
、碳酸铯 、十八烯
、十八烯 、油酸
、油酸 、油胺
、油胺 。
。
已知:通过调节反应的温度,可以实现产物粒子的大小可控。

实验步骤:
 将适量
将适量 、
、 、
、 十八烯加入仪器
十八烯加入仪器 中,抽气后通入
中,抽气后通入 ,重复
,重复 次;
次;
 将混合物升温至
将混合物升温至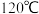 进行干燥,注入一定量油酸、油胺,待溶液澄清透明后升温到
进行干燥,注入一定量油酸、油胺,待溶液澄清透明后升温到 ,迅速注入铯前体,调节不同的温度
,迅速注入铯前体,调节不同的温度 ,
,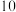 分钟后将溶液用水浴降至室温;
分钟后将溶液用水浴降至室温;
 将步骤
将步骤 中所得混合物与乙酸甲酯按一定比例混合后离心,分离出沉淀;
中所得混合物与乙酸甲酯按一定比例混合后离心,分离出沉淀;
 将步骤
将步骤 中所得沉淀,经过多次溶解,离心分离,最后得到上层清液即为
中所得沉淀,经过多次溶解,离心分离,最后得到上层清液即为 纳米晶体的分散系。
纳米晶体的分散系。
回答下列问题:
(1)仪器 的名称是
的名称是_____________________ 。
(2)铯前体是由碳酸铯与油酸加热时反应得到的产物,反应的化学方程式是__________________ 。
(3)为什么步骤 中要调节不同的温度
中要调节不同的温度_______________ 。
(4)步骤 中乙酸甲酯的作用是
中乙酸甲酯的作用是__________________ 。
(5)证明步骤 剩余固体中含有未反应完的
剩余固体中含有未反应完的 不考虑溴元素干扰
不考虑溴元素干扰 的操作是
的操作是_______ 。
(6)可用电感耦合等离子体质谱 来确定产品
来确定产品 中各元素的含量。取
中各元素的含量。取 产品溶于稀硝酸,测得锌
产品溶于稀硝酸,测得锌 、铅
、铅 ,则
,则 的值是
的值是____ 。 保留小数点后
保留小数点后 位
位
 ,在高温催化及光催化方面应用前景广泛。实验室制备一种钙钛矿型复合物
,在高温催化及光催化方面应用前景广泛。实验室制备一种钙钛矿型复合物 的方法如下:
的方法如下:实验用品:氯化锌
 、溴化铅
、溴化铅 、碳酸铯
、碳酸铯 、十八烯
、十八烯 、油酸
、油酸 、油胺
、油胺 。
。已知:通过调节反应的温度,可以实现产物粒子的大小可控。

实验步骤:
 将适量
将适量 、
、 、
、 十八烯加入仪器
十八烯加入仪器 中,抽气后通入
中,抽气后通入 ,重复
,重复 次;
次; 将混合物升温至
将混合物升温至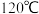 进行干燥,注入一定量油酸、油胺,待溶液澄清透明后升温到
进行干燥,注入一定量油酸、油胺,待溶液澄清透明后升温到 ,迅速注入铯前体,调节不同的温度
,迅速注入铯前体,调节不同的温度 ,
,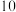 分钟后将溶液用水浴降至室温;
分钟后将溶液用水浴降至室温; 将步骤
将步骤 中所得混合物与乙酸甲酯按一定比例混合后离心,分离出沉淀;
中所得混合物与乙酸甲酯按一定比例混合后离心,分离出沉淀; 将步骤
将步骤 中所得沉淀,经过多次溶解,离心分离,最后得到上层清液即为
中所得沉淀,经过多次溶解,离心分离,最后得到上层清液即为 纳米晶体的分散系。
纳米晶体的分散系。回答下列问题:
(1)仪器
 的名称是
的名称是(2)铯前体是由碳酸铯与油酸加热时反应得到的产物,反应的化学方程式是
(3)为什么步骤
 中要调节不同的温度
中要调节不同的温度(4)步骤
 中乙酸甲酯的作用是
中乙酸甲酯的作用是(5)证明步骤
 剩余固体中含有未反应完的
剩余固体中含有未反应完的 不考虑溴元素干扰
不考虑溴元素干扰 的操作是
的操作是(6)可用电感耦合等离子体质谱
 来确定产品
来确定产品 中各元素的含量。取
中各元素的含量。取 产品溶于稀硝酸,测得锌
产品溶于稀硝酸,测得锌 、铅
、铅 ,则
,则 的值是
的值是 保留小数点后
保留小数点后 位
位
您最近一年使用:0次
名校
解题方法
3 . I.课外活动时间小吴同学制备Fe(OH)3胶体。
(1)他的具体操作:首先在烧杯中加入25 mL蒸馏水,用酒精灯加热至沸腾,然后向烧杯中逐滴滴加6滴___________ 饱和溶液,并继续煮沸至液体呈___________ ,即得Fe(OH)3胶体,该反应的化学方程式:___________ 。
(2)证明小吴同学已成功制得胶体的实验操作为:___________ 。
(3)若小吴同学在滴加饱和溶液的同时用玻璃棒不断搅拌,结果没有得到胶体,是因为:___________ 。
II. A B、C、D为四种可溶性的盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是 、
、 、Cl-、
、Cl-、 中的一种。(离子在物质中不能重复出现)
中的一种。(离子在物质中不能重复出现)
①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色;
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
(4) 根据①②实验事实可推断它们的化学式为:A___________ ,C___________ ,D___________ 。
(5)写出盐酸与D反应的离子方程式:___________ 。
(6)写出C与Ba(OH)2溶液反应的离子方程式:___________ 。
(1)他的具体操作:首先在烧杯中加入25 mL蒸馏水,用酒精灯加热至沸腾,然后向烧杯中逐滴滴加6滴
(2)证明小吴同学已成功制得胶体的实验操作为:
(3)若小吴同学在滴加饱和溶液的同时用玻璃棒不断搅拌,结果没有得到胶体,是因为:
II. A B、C、D为四种可溶性的盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是
 、
、 、Cl-、
、Cl-、 中的一种。(离子在物质中不能重复出现)
中的一种。(离子在物质中不能重复出现)①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色;
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
(4) 根据①②实验事实可推断它们的化学式为:A
(5)写出盐酸与D反应的离子方程式:
(6)写出C与Ba(OH)2溶液反应的离子方程式:
您最近一年使用:0次
4 . 下列实验中,利用图中装置或操作不能达到实验目的实验项数有
| 实验一 | 实验二 | 实验三 | 实验四 | |
| 装置 |  |  |  |  |
| 目的 | 向溶液中滴加 出现白色沉淀,证明试管中溶液含有 出现白色沉淀,证明试管中溶液含有 | 证明 与水反应放热 与水反应放热 | 验证铁粉与水蒸气的反应 | 证明氧化性: |
| A.1项 | B.2项 | C.3项 | D.4项 |
您最近一年使用:0次
名校
解题方法
5 . 实验小组制备高铁酸钾(K2FeO4) 并探究其性质。
资料: K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
I. 制备K2FeO4 (夹持装置略)_____ 。
(2)装置B的作用是除杂,所用试剂为______ 。
(3)C中得到紫色固体和溶液。C中主要反应的化学方程式为:____ ,此反应表明:氧化性Cl2____  (填“>”或“<”)。
(填“>”或“<”)。
(4)C中除了发生(3)中的反应,还可能发生的化学反应(离子方程式):_____ 。
II. 探究K2FeO4的性质
用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液a。取少量a,滴加盐酸,有Cl2产生。
(5)此实验可证明氧化Cl-的物质只能是 。用KOH溶液洗涤的目的是
。用KOH溶液洗涤的目的是_____ 。
(6)此实验得出Cl2和 的氧化性强弱关系与制备实验时得出的结论相反,原因是
的氧化性强弱关系与制备实验时得出的结论相反,原因是___ 。
资料: K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
I. 制备K2FeO4 (夹持装置略)
(2)装置B的作用是除杂,所用试剂为
(3)C中得到紫色固体和溶液。C中主要反应的化学方程式为:
 (填“>”或“<”)。
(填“>”或“<”)。(4)C中除了发生(3)中的反应,还可能发生的化学反应(离子方程式):
II. 探究K2FeO4的性质
用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液a。取少量a,滴加盐酸,有Cl2产生。
(5)此实验可证明氧化Cl-的物质只能是
 。用KOH溶液洗涤的目的是
。用KOH溶液洗涤的目的是(6)此实验得出Cl2和
 的氧化性强弱关系与制备实验时得出的结论相反,原因是
的氧化性强弱关系与制备实验时得出的结论相反,原因是
您最近一年使用:0次
2020-10-24更新
|
723次组卷
|
3卷引用:2021年湖北高考化学试题变式题11-19
名校
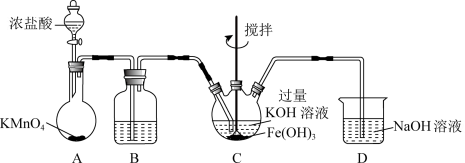
6 . 某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是__ 。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪色,有白色沉淀A产生。
针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:
请回答:
①根据白色沉淀B是__ (填化学式),判断沉淀A中一定存在CuSCN。
②仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:__ 。
③向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是__ (填化学式)。
根据以上实验,证明A仅为CuSCN。
④进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
_ Cu2++_ SCN-=_ CuSCN↓+_ (SCN)2
⑤结合上述过程以及Fe(SCN)3 Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:
Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:__ 。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是__ 或__ 。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪色,有白色沉淀A产生。
针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:

请回答:
①根据白色沉淀B是
②仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:
③向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是
根据以上实验,证明A仅为CuSCN。
④进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
⑤结合上述过程以及Fe(SCN)3
 Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:
Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是
您最近一年使用:0次
2020-04-27更新
|
321次组卷
|
5卷引用:湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题19 大题综合训练
名校
7 . 三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(以镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。

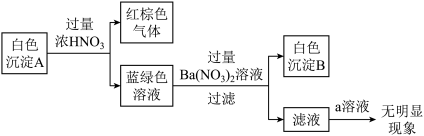
(1)操作1的名称为__________ 。
(2)保持其他条件相同,在不同温度下对废镍料进行“酸浸”,镍浸出率随时间变化如图。“酸浸”的适宜温度与时间分别为_______ (填字母)。
a.30℃、30min b.70℃、120min
c.90℃、150min d.90℃、120min
(3)沉淀A为CaF2和_________ (填化学式)。
(4)试剂B的化学式为_________________ 。
(5)NiC2O4·2H2O样品经某稀酸酸化处理后,用稀KMnO4标准溶液滴定[在本实验条件下,Ni(Ⅱ)不能被氧化,其他物质不参与反应],通过测定草酸的量可测定NiC2O4·2H2O样品的纯度,滴定反应为:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O。实验中称取0.183g样品,滴定时消耗了0.0400mol.L-1的KMnO4溶液8.00mL,则该样品中NiC2O4·2H2O的质量分数为_________ 。
(6)高温煅烧草酸镍制取三氧化二镍时会产生CO、CO2、水蒸气等混合气体。某同学设计如下实验流程进行检验。
混合气体 现象
现象 现象
现象
 现象
现象 现象
现象
①试剂1的名称为____________ 。
②证明混合气体有CO的现象是_____________________________________________ 。

(1)操作1的名称为
(2)保持其他条件相同,在不同温度下对废镍料进行“酸浸”,镍浸出率随时间变化如图。“酸浸”的适宜温度与时间分别为

a.30℃、30min b.70℃、120min
c.90℃、150min d.90℃、120min
(3)沉淀A为CaF2和
(4)试剂B的化学式为
(5)NiC2O4·2H2O样品经某稀酸酸化处理后,用稀KMnO4标准溶液滴定[在本实验条件下,Ni(Ⅱ)不能被氧化,其他物质不参与反应],通过测定草酸的量可测定NiC2O4·2H2O样品的纯度,滴定反应为:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O。实验中称取0.183g样品,滴定时消耗了0.0400mol.L-1的KMnO4溶液8.00mL,则该样品中NiC2O4·2H2O的质量分数为
(6)高温煅烧草酸镍制取三氧化二镍时会产生CO、CO2、水蒸气等混合气体。某同学设计如下实验流程进行检验。
混合气体
 现象
现象 现象
现象
 现象
现象 现象
现象①试剂1的名称为
②证明混合气体有CO的现象是
您最近一年使用:0次
2018-03-09更新
|
237次组卷
|
2卷引用:湖北孝感高中等五校2017-2018学年高二上学期期末联考化学试题
8 . A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)这四种元素名称分别是:A___________ ,B___________ ,C___________ ,D___________ 。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是_______________ 。(用化学式表示,下同)
(3)A与B形成的三原子分子的电子式是___________ ,B与D形成的原子个数比为l∶l的化合物中含有的化学键类型有___________ 。
(4)写一个能证明A和C的金属性或者非金属性强弱的化学方程式是___________ 。
(1)这四种元素名称分别是:A
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是
(3)A与B形成的三原子分子的电子式是
(4)写一个能证明A和C的金属性或者非金属性强弱的化学方程式是
您最近一年使用:0次
名校
解题方法
9 . 实验室测定氧化物 的组成实验如下:
的组成实验如下:

下列有关说法正确的是
 的组成实验如下:
的组成实验如下:
下列有关说法正确的是
A.溶液 中只含有 中只含有 和 和 | B.样品X中含有+3价铁元素 |
C.溶液 中 中 | D.根据步骤Ⅰ、Ⅱ可判断X为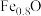 |
您最近一年使用:0次
解题方法
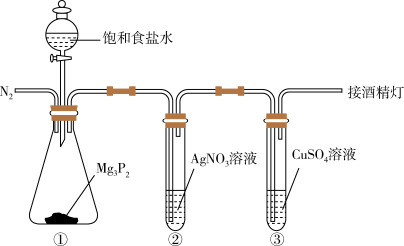
10 . 磷化氢 是一种无色有大蒜臭味的剧毒气体,微溶于水。某学习小组制备磷化氢并探究其性质的装置如下图。下列说法
是一种无色有大蒜臭味的剧毒气体,微溶于水。某学习小组制备磷化氢并探究其性质的装置如下图。下列说法错误的是
注:①磷化氢在空气中容易自燃;②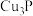 为灰黄色固体
为灰黄色固体
 是一种无色有大蒜臭味的剧毒气体,微溶于水。某学习小组制备磷化氢并探究其性质的装置如下图。下列说法
是一种无色有大蒜臭味的剧毒气体,微溶于水。某学习小组制备磷化氢并探究其性质的装置如下图。下列说法注:①磷化氢在空气中容易自燃;②
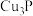 为灰黄色固体
为灰黄色固体
A.通入 的主要目的是将生成的 的主要目的是将生成的 赶入后续装置中发生反应 赶入后续装置中发生反应 |
B.使用饱和食盐水的目的是降低 产生的速率 产生的速率 |
C.装置②中产生了黑色沉淀,③中产生了灰黄色沉淀,体现了 的强还原性 的强还原性 |
D.③中反应的离子方程式为: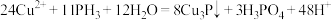 |
您最近一年使用:0次



