名校
解题方法
1 . 在一密闭容器中,反应 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是| A.平衡向逆反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增大了 | D. |
您最近一年使用:0次
2023-11-14更新
|
387次组卷
|
25卷引用:天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题
天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期阶段考试(12月)化学试题(已下线)【浙江新东方】双师118安徽省淮北市树人高级中学2020-2021学年高二上学期第一次联考化学试题广西百色中学2021-2022学年高二上学期第一次月考化学试题黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期中阶段性检测化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期开学考试化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期末考试化学试题吉林省长春希望高中2021-2022学年高二上学期期末考试化学试题广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题天津市第二南开学校2022-2023学年高二上学期9月阶段性线上练习化学试题 天津市宁河区芦台第一中学2022-2023学年高二上学期第一次学习诊断化学试题浙江省金华第一中学2022-2023学年高一下学期6月期末化学试题宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题山西省太原市第五中学校2023-2024学年高二上学期10月月考化学试题浙江省浙东北联盟(ZDB)2023-2024学年高二上学期期中考试化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题 北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业03 化学平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题河北省石家庄市第十五中学2023-2024学年高二上学期12月阶段考试化学试题安徽省阜阳市临泉第一中学(高铁分校)2023-2024学年高二上学期期末考试化学试题广东省汕头市潮阳区河溪中学2023-2024学年高二上学期月考化学试题
名校
解题方法
2 . 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
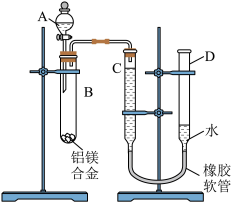
(1)A中试剂为NaOH溶液,实验前先检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;
②将B中剩余固体过滤,洗涤,干燥,称重;
③待B中不再有气体产生并恢复至室温后,记录C的液面位置;
④由A向B中滴加足量试剂。
上述操作的顺序是___________ (填序号);记录C的液面位置时,除平视外,还应___________ 。
(2)B中发生反应的化学方程式为___________ 。
(3)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将___________ (填“偏大”“偏小”或“不受影响”)。
(4)若实验用铝镁合金的质量为ag,测得氢气体积为bmL(已换算为标准状况),B中剩余固体的质量为cg,则铝的相对原子质量为___________ 。

(1)A中试剂为NaOH溶液,实验前先检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;
②将B中剩余固体过滤,洗涤,干燥,称重;
③待B中不再有气体产生并恢复至室温后,记录C的液面位置;
④由A向B中滴加足量试剂。
上述操作的顺序是
(2)B中发生反应的化学方程式为
(3)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将
(4)若实验用铝镁合金的质量为ag,测得氢气体积为bmL(已换算为标准状况),B中剩余固体的质量为cg,则铝的相对原子质量为
您最近一年使用:0次
名校
3 . 对于可逆反应mA(g)+nB(s)  pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D %与温度T或压强p的关系如图所示,下列说法正确的是
pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D %与温度T或压强p的关系如图所示,下列说法正确的是
 pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D %与温度T或压强p的关系如图所示,下列说法正确的是
pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D %与温度T或压强p的关系如图所示,下列说法正确的是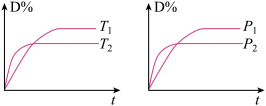
| A.降温,化学平衡向正反应方向移动 |
| B.使用催化剂可使D%有所增加 |
| C.化学方程式中化学计量数m+n<p+q |
| D.升温,A的转化率提高 |
您最近一年使用:0次
2023-04-25更新
|
441次组卷
|
5卷引用:天津市武清区河西务中学2023-2024学年高二上学期第二次月考化学试卷
天津市武清区河西务中学2023-2024学年高二上学期第二次月考化学试卷青海省西宁市六校联考2022-2023学年高二上学期期末考试化学试题(已下线)专题04 化学平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)安徽省合肥市第一中学2023-2024学年高二上学期12月月考化学试题安徽省合肥市普通高中六校联盟2023-2024学年高二上学期1月期末化学试题
4 . 下列叙述中正确个数的是
①标准状况下, 个分子所占体积约是
个分子所占体积约是 ;
;
②
 水解形成氢氧化铁胶体粒子的数目为
水解形成氢氧化铁胶体粒子的数目为 ;
;
③两种物质的物质的量相同,则它们在标况下的体积相同;
④ 水的摩尔质量是
水的摩尔质量是 水的摩尔质量的2倍;
水的摩尔质量的2倍;
⑤足量 和质量相等的
和质量相等的 在常温和加热条件下反应,转移的电子数相等;
在常温和加热条件下反应,转移的电子数相等;
⑥等物质的量的 与
与 投入等量且足量水中充分反应后所得溶液的物质的量浓度相等;
投入等量且足量水中充分反应后所得溶液的物质的量浓度相等;
⑦取
 和
和 混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重
混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重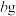 ,能测定混合物中
,能测定混合物中 质量分数。
质量分数。
①标准状况下,
 个分子所占体积约是
个分子所占体积约是 ;
;②

 水解形成氢氧化铁胶体粒子的数目为
水解形成氢氧化铁胶体粒子的数目为 ;
;③两种物质的物质的量相同,则它们在标况下的体积相同;
④
 水的摩尔质量是
水的摩尔质量是 水的摩尔质量的2倍;
水的摩尔质量的2倍;⑤足量
 和质量相等的
和质量相等的 在常温和加热条件下反应,转移的电子数相等;
在常温和加热条件下反应,转移的电子数相等;⑥等物质的量的
 与
与 投入等量且足量水中充分反应后所得溶液的物质的量浓度相等;
投入等量且足量水中充分反应后所得溶液的物质的量浓度相等;⑦取

 和
和 混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重
混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重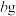 ,能测定混合物中
,能测定混合物中 质量分数。
质量分数。| A.2个 | B.3个 | C.4个 | D.5个 |
您最近一年使用:0次
5 . Ⅰ.某学习小组实验前先将铝镁合金在稀酸中浸泡片刻,然后用如圈所示装置进行实验测定铝镁合金中铝的质量分数。回答下列问题:
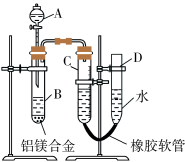
(1)A仪器名称为_______ ;实验前先将铝镁合金在稀酸中浸泡片刻其目的是:_______ 。
(2)实验过程中,若充分反应后发现试管B中有不溶物剩余,则A中试剂为_______ (填化学式)。
(3)实验过程中,若未洗涤B中过滤所得的不溶物,则测得铝的质量分数将_______ (填“偏大”“偏小”或“不受影响”)。
Ⅱ.某兴趣小组进行某补血剂中铁元素含量的测定实验,流程如下:

(4)步骤①研磨时需要在_______ (填选项)中进行。
a.蒸发皿 b.研钵
b.研钵 c.坩埚
c.坩埚
(5)步骤②加入 的作用是
的作用是_______ 。
(6)加入过量氨水发生的离子反应方程式为_______ 。
(7)步骤③多步操作依次为_______ 、洗涤、_______ 至恒重、冷却、称重。
(8)每片补血剂中铁元素的质量为_______ g。

(1)A仪器名称为
(2)实验过程中,若充分反应后发现试管B中有不溶物剩余,则A中试剂为
(3)实验过程中,若未洗涤B中过滤所得的不溶物,则测得铝的质量分数将
Ⅱ.某兴趣小组进行某补血剂中铁元素含量的测定实验,流程如下:

(4)步骤①研磨时需要在
a.蒸发皿
 b.研钵
b.研钵 c.坩埚
c.坩埚
(5)步骤②加入
 的作用是
的作用是(6)加入过量氨水发生的离子反应方程式为
(7)步骤③多步操作依次为
(8)每片补血剂中铁元素的质量为
您最近一年使用:0次
名校
6 . 工业上可用一氧化碳合成可再生能源甲醇。
(1)已知:Ⅰ.
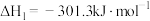 ;
;
 Ⅱ.
Ⅱ.
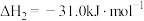 。
。
则CO与 合成气态甲醇的热化学方程式为
合成气态甲醇的热化学方程式为___________ 。
(2)某科研小组在 作催化剂的条件下,在500℃时,研究了
作催化剂的条件下,在500℃时,研究了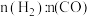 分别为
分别为 、
、 时CO的转化率变化情况(如图1所示),则图中表
时CO的转化率变化情况(如图1所示),则图中表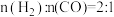 的变化曲线为:
的变化曲线为:___________ (填“曲线a”或“曲线b”)。 合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得
合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得 的产率与温度的关系如图2所示。下列说法正确的是
的产率与温度的关系如图2所示。下列说法正确的是___________ (填字母)。
b.在恒温恒压的平衡体系中充入氩气, 的产率降低
的产率降低
c.当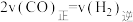 时,反应达到平衡状态
时,反应达到平衡状态
d.降低生成物甲醇的浓度,有利于提高甲醇的产率,加快反应速率
(4)一定温度下,在容积均为2L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
若甲容器平衡后气体的压强为开始时的 ,则该温度下,该反应的平衡常数K=
,则该温度下,该反应的平衡常数K=___________ ,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为___________ 。
(5)CO与日常生产生活相关。
①检测汽车尾气中CO含量,可用CO分析仪,工作原理类似于燃料电池,其中电解质是氧化钇( )和氧化锆(
)和氧化锆( )晶体,能传导
)晶体,能传导 。则负极的电极反应式为
。则负极的电极反应式为___________ 。
②碳酸二甲酯 毒性小,是一种绿色化工产品,用CO合成
毒性小,是一种绿色化工产品,用CO合成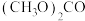 ,其电化学合成原理为
,其电化学合成原理为 ,装置如图3所示,写出阳极的电极反应式:
,装置如图3所示,写出阳极的电极反应式:___________ 。
(1)已知:Ⅰ.

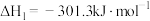 ;
; Ⅱ.
Ⅱ.
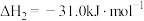 。
。则CO与
 合成气态甲醇的热化学方程式为
合成气态甲醇的热化学方程式为(2)某科研小组在
 作催化剂的条件下,在500℃时,研究了
作催化剂的条件下,在500℃时,研究了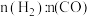 分别为
分别为 、
、 时CO的转化率变化情况(如图1所示),则图中表
时CO的转化率变化情况(如图1所示),则图中表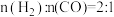 的变化曲线为:
的变化曲线为: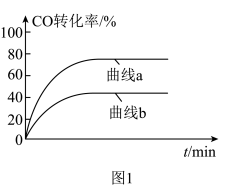
 合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得
合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得 的产率与温度的关系如图2所示。下列说法正确的是
的产率与温度的关系如图2所示。下列说法正确的是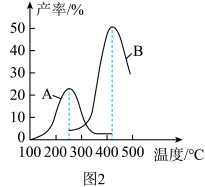
b.在恒温恒压的平衡体系中充入氩气,
 的产率降低
的产率降低c.当
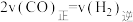 时,反应达到平衡状态
时,反应达到平衡状态d.降低生成物甲醇的浓度,有利于提高甲醇的产率,加快反应速率
(4)一定温度下,在容积均为2L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物起始投入量 | 2molCO、 | amolCO、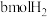 、 、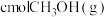 (a、b、c均不为零) (a、b、c均不为零) |
 ,则该温度下,该反应的平衡常数K=
,则该温度下,该反应的平衡常数K=(5)CO与日常生产生活相关。
①检测汽车尾气中CO含量,可用CO分析仪,工作原理类似于燃料电池,其中电解质是氧化钇(
 )和氧化锆(
)和氧化锆( )晶体,能传导
)晶体,能传导 。则负极的电极反应式为
。则负极的电极反应式为②碳酸二甲酯
 毒性小,是一种绿色化工产品,用CO合成
毒性小,是一种绿色化工产品,用CO合成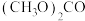 ,其电化学合成原理为
,其电化学合成原理为 ,装置如图3所示,写出阳极的电极反应式:
,装置如图3所示,写出阳极的电极反应式: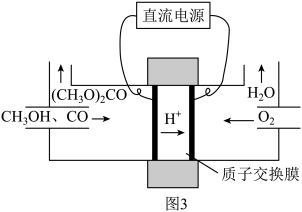
您最近一年使用:0次
7 . Ⅰ.已知X、Y两种元素的原子序数之和等于41。X元素原子的4p能级上有3个电子,Y元素原子的最外层2p能级上有4个电子。请回答下列问题。
(1)X元素基态原子的电子排布式__________ ,该元素的符号是__________ 。
(2)Y元素原子的价层电子排布式为__________ ,该元素的名称是__________ 。
Ⅱ.有四种短周期元素,与其相关的结构、性质等信息如下表所述:
请根据表中信息回答不列问题:
(3)A元素基态原子的电子排布式为__________ 。
(4)B元素在元素周期表中的位置为__________ 。
(5)C基态原子的轨道表示式是__________ ,其原子核外有__________ 个未成对电子,能量最高的电子为轨道上的电子,其原子轨道呈__________ 形。
(6)D原子的电子排布式为__________ , 的结构示意图为
的结构示意图为__________ 。
(1)X元素基态原子的电子排布式
(2)Y元素原子的价层电子排布式为
Ⅱ.有四种短周期元素,与其相关的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物对应水化物具有两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最高的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(3)A元素基态原子的电子排布式为
(4)B元素在元素周期表中的位置为
(5)C基态原子的轨道表示式是
(6)D原子的电子排布式为
 的结构示意图为
的结构示意图为
您最近一年使用:0次
名校
解题方法
8 . 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为离子交换膜。请按要求回答相关问题:
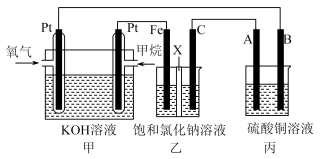
(1)甲烷燃料电池负极反应式是___________ 。
(2)Fe电极的电极反应式为___________ 。
(3)X选择___________ 离子交换膜(填“阴”,“阳”)。
(4)丙模拟粗铜的精炼,那么粗铜放在___________ (填“A”,“B”)极,反应结束后硫酸铜溶液的浓度___________ (填“变大”,“变小”,“不变”)。
(5)若在标准状况下,有1.12 L氧气参加反应,则乙装置中铁极上生成的气体体积为___________ L。
(6)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
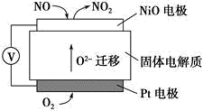
①Pt电极上发生的是___________ 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:___________ 。

(1)甲烷燃料电池负极反应式是
(2)Fe电极的电极反应式为
(3)X选择
(4)丙模拟粗铜的精炼,那么粗铜放在
(5)若在标准状况下,有1.12 L氧气参加反应,则乙装置中铁极上生成的气体体积为
(6)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是
②写出NiO电极的电极反应式:
您最近一年使用:0次
9 . 某品牌矿泉水标签上印有的主要矿物元素含量如表所示,则对此矿泉水的叙述正确的是
| 主要元素 | Ca | K | Mg | Na |
含量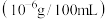 | ≥400 | ≥35 | ≥50 | ≥80 |
| A.该矿泉水是电解质 |
| B.该矿泉水可观察到丁达尔效应 |
| C.钙元素在矿泉水中均以钙单质形式存在 |
| D.该矿泉水能导电 |
您最近一年使用:0次
2023-02-24更新
|
104次组卷
|
3卷引用:天津市武清区2022-2023学年高一上学期期末考试化学试题
天津市武清区2022-2023学年高一上学期期末考试化学试题天津市武清区黄花店中学2023-2024学年高一上学期第二次形成性练习化学试题(已下线)专项01 离子方程式的书写、离子共存、检验与推断-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)
10 . 亚硝酰硫酸(NOSO4H)是一种浅黄色液体,遇水易分解,溶于浓硫酸,主要用于染料、医药领域的重氮化反应。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品中杂质硝酸的含量。
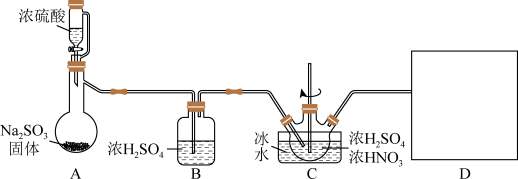
回答下列问题:
(1)装置A中盛装Na2SO3固体的仪器名称是_______ ,装置D最好选用_______ (填序号)。
a. b.
b. c.
c.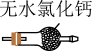 d.
d.
(2)装置C中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①C中“冷水”的温度一般控制在20℃,装置C中温度过高产率降低的原因是_______ 。
②开始通SO2时,反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其原因是_______ 。
③请写出亚硝酰硫酸(NOSO4H)与水分解时发生的化学方程式_______ (已知亚硝酸不稳定,易分解,亚硝酸发生分解反应的方程式为2HNO2=NO2↑+NO↑+H2O)。
(3)测定亚硝酰硫酸产品中杂质硝酸的含量。
称取1.400 g产品放入250mL锥形瓶中,加80mL浓硫酸,用0.1000mol/L (NH4)2Fe(SO4)2标准溶液滴定,消耗标准溶液20.00mL。
已知:(NH4)2Fe(SO4)2可与NO生成粉红色的FeSO4·NO。
①滴定过程中锥形瓶内发生的离子方程式为_______ 。
②锥形瓶中加入浓硫酸除了可以作溶剂外,另一个作用是_______ 。
③下列操作造成测定结果偏高的是_______ (填字母)。
A.滴定终点滴定管读数时俯视读数
B.用容量瓶配制(NH4)2Fe(SO4)2标准溶液时俯视
C.酸式滴定管用蒸馏水洗净后,未用标准液润洗
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失
④判断滴定达到终点的现象是_______ 。
⑤亚硝酰硫酸中硝酸的含量为_______ 。

回答下列问题:
(1)装置A中盛装Na2SO3固体的仪器名称是
a.
 b.
b. c.
c. d.
d.
(2)装置C中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①C中“冷水”的温度一般控制在20℃,装置C中温度过高产率降低的原因是
②开始通SO2时,反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其原因是
③请写出亚硝酰硫酸(NOSO4H)与水分解时发生的化学方程式
(3)测定亚硝酰硫酸产品中杂质硝酸的含量。
称取1.400 g产品放入250mL锥形瓶中,加80mL浓硫酸,用0.1000mol/L (NH4)2Fe(SO4)2标准溶液滴定,消耗标准溶液20.00mL。
已知:(NH4)2Fe(SO4)2可与NO生成粉红色的FeSO4·NO。
①滴定过程中锥形瓶内发生的离子方程式为
②锥形瓶中加入浓硫酸除了可以作溶剂外,另一个作用是
③下列操作造成测定结果偏高的是
A.滴定终点滴定管读数时俯视读数
B.用容量瓶配制(NH4)2Fe(SO4)2标准溶液时俯视
C.酸式滴定管用蒸馏水洗净后,未用标准液润洗
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失
④判断滴定达到终点的现象是
⑤亚硝酰硫酸中硝酸的含量为
您最近一年使用:0次
2023-01-11更新
|
348次组卷
|
3卷引用:天津市武清区黄花店中学2023-2024学年高三上学期第二次练习化学试题



