解题方法
1 . I.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X,Y既不同族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)请写出M的元素符号: ____________,Z的原子结构示意图: ____________。M与X两元素可形成两种液态化合物,其化学式分别为。
(2)请写出N元素在周期表中的位置;与N同族的短周期元素L,其最高价氧化物的电子式为。
(3)Y与Z相比,非金属性较强的元素是________,(填元素符号)可以证明该结论的实验事实是。
II.下列转化关系中,X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,A为红棕色固体,C、D、E是中学常见的三种化合物。分析转化关系回答问题。
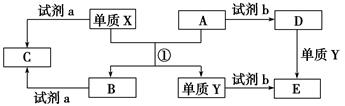
(1)请写出反应①的化学方程式:________________________________。
(2)由D到E的离子方程式_________________________________。
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式。
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制取高效净水剂Y(OH)SO4,已知还原产物为NO,则该反应的化学方程式是________________________________。
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 L,则阴极产物的质量为______________。
(1)请写出M的元素符号: ____________,Z的原子结构示意图: ____________。M与X两元素可形成两种液态化合物,其化学式分别为。
(2)请写出N元素在周期表中的位置;与N同族的短周期元素L,其最高价氧化物的电子式为。
(3)Y与Z相比,非金属性较强的元素是________,(填元素符号)可以证明该结论的实验事实是。
II.下列转化关系中,X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,A为红棕色固体,C、D、E是中学常见的三种化合物。分析转化关系回答问题。

(1)请写出反应①的化学方程式:________________________________。
(2)由D到E的离子方程式_________________________________。
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式。
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制取高效净水剂Y(OH)SO4,已知还原产物为NO,则该反应的化学方程式是________________________________。
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 L,则阴极产物的质量为______________。
您最近一年使用:0次
2016-12-09更新
|
428次组卷
|
2卷引用:2016届黑龙江大庆铁人中学高三上学期期中考试理化学试卷
名校
解题方法
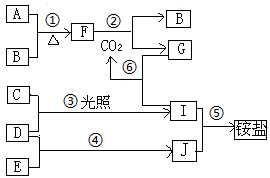
2 . 下图是部分短周期元素的单质及化合物(或溶液)的转化关系:
已知B、C、D、E是非金属单质,且在常温下都是气体;化合物G的焰色反应为黄色,化合物I、J通常状况下呈气态;反应④是化工生产中的一种重要固氮反应。请回答下列问题:
(1)写出A、B元素在周期表中的位置:A__________________ B__________________
(2)①~⑥反应中属于氧化还原反应的是___________________________________ (填序号)
(3)写出②的化学方程式:_____________________________
⑥的离子方程式:______________________________________
(4)反应⑤的现象是________ ,J的另一种检验方法及现象是_______________ 。
已知B、C、D、E是非金属单质,且在常温下都是气体;化合物G的焰色反应为黄色,化合物I、J通常状况下呈气态;反应④是化工生产中的一种重要固氮反应。请回答下列问题:
(1)写出A、B元素在周期表中的位置:A
(2)①~⑥反应中属于氧化还原反应的是
(3)写出②的化学方程式:
⑥的离子方程式:
(4)反应⑤的现象是
您最近一年使用:0次
2017-04-12更新
|
317次组卷
|
2卷引用:2016-2017学年黑龙江省大庆第一中学高一下学期第二次月考化学试卷
名校
解题方法
3 . 依据下图中氮元素及其化合物的转化关系,回答问题:
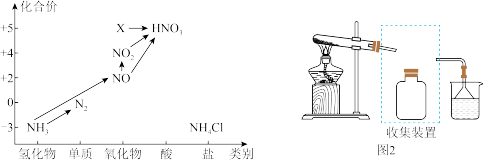
(1)图1中,X的化学式为_______ ,从化合价上看,X具有_______ 性(“氧化”、“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为_______ 。
②下列试剂不能用于干燥NH3的是_______ (填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将上述装置补充完整,在图2虚框内画出连接图_______ 。
④氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式_______ 。
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:_______ 。
②工业生产中利用氨水吸收SO2和NO2,原理如下图所示:
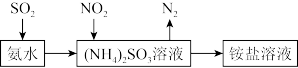
NO2被吸收过程的离子方程式是_______ 。
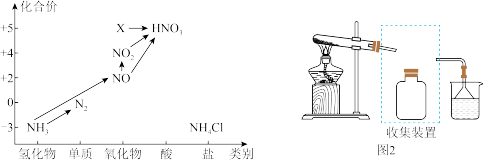
(1)图1中,X的化学式为
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为
②下列试剂不能用于干燥NH3的是
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将上述装置补充完整,在图2虚框内画出连接图
④氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:
②工业生产中利用氨水吸收SO2和NO2,原理如下图所示:
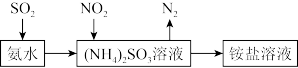
NO2被吸收过程的离子方程式是
您最近一年使用:0次
2021-04-13更新
|
262次组卷
|
2卷引用:黑龙江省哈尔滨市第一中学校2022-2023学年高一下学期期中考试化学试题
4 . 氮和氮的化合物在国防建设、工农业生产和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)亚硝酰氯(结构式为Cl-N=O)是有机合成中的重要试剂。它可由C12和NO在通常条件下反应制得,反应方程式为:2NO(g)+Cl2(g) 2ClNO(g)。已知几种化学键的键能数据如下表:
2ClNO(g)。已知几种化学键的键能数据如下表:
当Cl2与NO反应生成ClNO的过程中转移了4mol电子,理论上热量变化为_________ kJ。
(2)在一个恒容密闭容器中充入2molNO(g)和1molCl2(g)发生(1)中反应,在温度分别为T1、T2时测得NO的物质的量(单位:mol)与时间的关系如下表所示:
①若容器容积为1L,温度为T1℃时,反应开始到5min时,C12的平均反应速率为_______ 。
②在T1条件下,反应进行到13min时,反应的正反应速率________ 逆反应速率(填“大于”、“等于”或“小于”),请解释原因:________________________________ 。
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮( ),其工作原理如图所示:
),其工作原理如图所示:
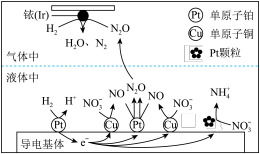
①Ir表面发生反应的方程式为______________ 。
②若导电基体上的Pt颗粒增多,造成的结果是______________ 。
(1)亚硝酰氯(结构式为Cl-N=O)是有机合成中的重要试剂。它可由C12和NO在通常条件下反应制得,反应方程式为:2NO(g)+Cl2(g)
 2ClNO(g)。已知几种化学键的键能数据如下表:
2ClNO(g)。已知几种化学键的键能数据如下表:| 化学键 | Cl—Cl | Cl—N | N=O | N O(NO) O(NO) |
| 键能(kJ/mol) | 243 | 200 | 607 | 630 |
(2)在一个恒容密闭容器中充入2molNO(g)和1molCl2(g)发生(1)中反应,在温度分别为T1、T2时测得NO的物质的量(单位:mol)与时间的关系如下表所示:
| 温度/℃ | 0min | 5min | 8min | 13min |
| T1 | 2 | 1.5 | 1.3 | 1.0 |
| T2 | 2 | 1.15 | 1.0 | 1.0 |
②在T1条件下,反应进行到13min时,反应的正反应速率
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(
 ),其工作原理如图所示:
),其工作原理如图所示:
①Ir表面发生反应的方程式为
②若导电基体上的Pt颗粒增多,造成的结果是
您最近一年使用:0次
12-13高三上·黑龙江大庆·开学考试
解题方法
5 . 已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol 丁分子中不同原子的数目比为1 :2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件已略去)。
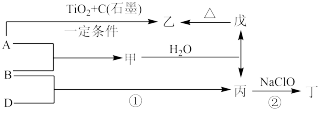
请回答:
(1)单质B的组成元素在周期表中的位置是___________ 。
(2)戊的化学式为___________ 。戊与强碱反应的离子方程式:___________
(3)丙中所包含的化学键类型有___________ (填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应①的化学方程式为___________ 。
(5)反应②中,0.5mol NaClO参加反应时,转移1 mol电子,其化学方程式为___________
(6)—定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知,该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为___________ 。
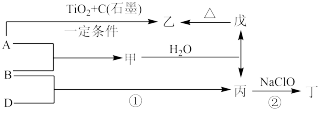
请回答:
(1)单质B的组成元素在周期表中的位置是
(2)戊的化学式为
(3)丙中所包含的化学键类型有
a.离子键 b.极性共价键 c.非极性共价键
(4)反应①的化学方程式为
(5)反应②中,0.5mol NaClO参加反应时,转移1 mol电子,其化学方程式为
(6)—定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知,该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为
您最近一年使用:0次
13-14高三上·河南三门峡·阶段练习
解题方法
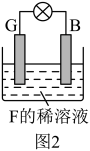
6 . 下列各种物质中,除B、D两种物质外,其余各物质均由短周期元素组成。已知常温常压下A为无色无味液体,B、C、G属于金属单质,化合物F的焰色反应为黄色火焰,常温下0.1mol/L的F溶液pH=13,D为黑色有磁性的氧化物。物质之间存在如图1所示的转化关系(略去部分反应条件)。

回答下列问题:
(1)写出F的电子式_______ ;
(2)组成G的元素在周期表中的位置是_______ ;
(3)写出反应①的化学方程式:_______ ;
(4)写出反应⑤的离子方程式:_______ ;
(5)由B、G、F溶液组成如图2所示的装置,其中G上的电极反应式为_______ 。

回答下列问题:
(1)写出F的电子式
(2)组成G的元素在周期表中的位置是
(3)写出反应①的化学方程式:
(4)写出反应⑤的离子方程式:
(5)由B、G、F溶液组成如图2所示的装置,其中G上的电极反应式为

您最近一年使用:0次
12-13高三上·黑龙江哈尔滨·期末
7 . A、B、C三种短周期元素在周期表中相对位置如右图:
(1)A与C形成的液态化合物是常见的重要有机溶剂,则A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:____________ >____________ >_____________ (用化学式表示)。
(2)X、Y为B、C两种元素形成的单质,标准状况下,X的密度为3.17g•L-1。Z是一种化合物,焰色反应呈紫色(透过蓝色钴玻璃),室温下0.1 mol•L-1Z水溶液pH=13。X、Y、Z有如图转化关系:

①写出X与Z反应的离子方程式:______________________________________________ 。
②已知丙能与稀硫酸反应生成能使品红褪色的气体。丁的化学式为__________________ ,丁的水溶液pH>7的原因是:______________________________ (用离子方程式表示)。
③将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/L KMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式_________________________________________________ 。
A | |||
B | C |
(2)X、Y为B、C两种元素形成的单质,标准状况下,X的密度为3.17g•L-1。Z是一种化合物,焰色反应呈紫色(透过蓝色钴玻璃),室温下0.1 mol•L-1Z水溶液pH=13。X、Y、Z有如图转化关系:

①写出X与Z反应的离子方程式:
②已知丙能与稀硫酸反应生成能使品红褪色的气体。丁的化学式为
③将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/L KMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式
您最近一年使用:0次
11-12高三上·黑龙江大庆·期中
8 . 有A、B、C三种短周期元素在周期表中相对位置如下图:
(1)A与C形成的液态化合物是常见的重要有机溶剂,则A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:______ >_______ >________ (用化学式表示)。
(2)X、Y为B、C两种元素形成的单质。标准状况下,X的密度为3.17g/L。Z是一种化合物,焰色反应呈紫色(透过钴玻璃),室温下0.1mol/LZ水溶液pH=13。X、Y、Z有如图转化关系:
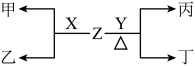
①写出X与Z反应的离子方程式:__________ 。
②已知丙能与稀硫酸反应生成使品红褪色的气体。丁的电子式__________ ,丁的水溶液pH____ 7(填“大于”“小于”或“等于”),其原因为__________ (用离子方程式表示)。
③将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/LKMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式__________ 。
④写出X与水反应生成两种酸的电子式__________ ,__________ 。
| A | |||
| B | C |
(2)X、Y为B、C两种元素形成的单质。标准状况下,X的密度为3.17g/L。Z是一种化合物,焰色反应呈紫色(透过钴玻璃),室温下0.1mol/LZ水溶液pH=13。X、Y、Z有如图转化关系:
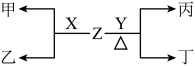
①写出X与Z反应的离子方程式:
②已知丙能与稀硫酸反应生成使品红褪色的气体。丁的电子式
③将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/LKMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式
④写出X与水反应生成两种酸的电子式
您最近一年使用:0次
解题方法
9 . 碳、氮和氯元素及其化合物与人类的生产、生活密切相关。
I.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。

在三个容积均为1L的密闭容器中以不同的氢碳比n(H2)/n(CO2)充入H2和CO2,在一定条件下发生反应:
2CO2(g) + 6H2(g) C2H4(g) + 4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(①、②、2.0分别代表三种氢碳比时的变化曲线)。
C2H4(g) + 4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(①、②、2.0分别代表三种氢碳比时的变化曲线)。
请回答下列问题:
(1)反应的△H_____ 0,氢碳比①________ ②,Q点v(正)_____ v(逆)(填“大于”或“小于”)
(2)若起始时,CO2的浓度为0.5mol/L,氢气的浓度为1.0mol/L;则P点对应温度的平衡常数的值为_____________________ 。
II.氯的化合物合成、转化一直是科学研究的热点。
①一定条件下,氯气与氨气反应可以制备氯胺[NH2Cl(g)],已知部分化学键的键能:
则上述反应的热化学方程式为_______________________________________________________ 。
②氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为
_________________________________________________________ 。
III.用氨水除去SO2
(1)已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8.若氨水的浓度为2.0mol/L,则溶液中的c(OH-)=_________ mol/L.将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的c(SO32-)/c(HSO3-)=_____________ .
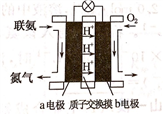
(2)利用氨气与空气催化氧化法制取联氨N2H4.如图是由“联氨-空气”形成的绿色燃料电池,以石墨为电极的电池工作原理示意图,b电极为____________ 极(填“正”或“负”),写出该电池工作时a电极的电极反应式___________________________________________ .
I.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。

在三个容积均为1L的密闭容器中以不同的氢碳比n(H2)/n(CO2)充入H2和CO2,在一定条件下发生反应:
2CO2(g) + 6H2(g)
 C2H4(g) + 4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(①、②、2.0分别代表三种氢碳比时的变化曲线)。
C2H4(g) + 4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(①、②、2.0分别代表三种氢碳比时的变化曲线)。 请回答下列问题:
(1)反应的△H
(2)若起始时,CO2的浓度为0.5mol/L,氢气的浓度为1.0mol/L;则P点对应温度的平衡常数的值为
II.氯的化合物合成、转化一直是科学研究的热点。
①一定条件下,氯气与氨气反应可以制备氯胺[NH2Cl(g)],已知部分化学键的键能:
则上述反应的热化学方程式为
| 化学键 | N—H | Cl—Cl | N—Cl | H—Cl |
| 键能/kJ·mol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
III.用氨水除去SO2
(1)已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8.若氨水的浓度为2.0mol/L,则溶液中的c(OH-)=
(2)利用氨气与空气催化氧化法制取联氨N2H4.如图是由“联氨-空气”形成的绿色燃料电池,以石墨为电极的电池工作原理示意图,b电极为

您最近一年使用:0次
12-13高三上·黑龙江哈尔滨·期末
10 . A、B、C三种短周期元素在周期表中相对位置如右图:
(1)A与C形成的液态化合物是常见的重要有机溶剂,则
A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱
的顺序是: > > (用化学式表示)。
(2)X、Y为B、C两种元素形成的单质,标准状况下,X的密度为3.17g•L-1。Z是一种化合物,焰色反应呈紫色(透过蓝色钴玻璃),室温下0.1 mol•L-1Z水溶液pH=13。X、Y、Z有如图转化关系:
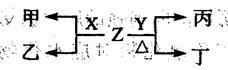
①写出X与Z反应的离子方程式: 。
②已知丙能与稀硫酸反应生成能使品红褪色的气体。丁的化学式为 ,丁的水溶液pH>7的原因是: (用离子方程式表示)。
③将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/L KMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式 。
| A | |||
| B | C |
(1)A与C形成的液态化合物是常见的重要有机溶剂,则
A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱
的顺序是: > > (用化学式表示)。
(2)X、Y为B、C两种元素形成的单质,标准状况下,X的密度为3.17g•L-1。Z是一种化合物,焰色反应呈紫色(透过蓝色钴玻璃),室温下0.1 mol•L-1Z水溶液pH=13。X、Y、Z有如图转化关系:
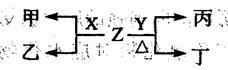
①写出X与Z反应的离子方程式: 。
②已知丙能与稀硫酸反应生成能使品红褪色的气体。丁的化学式为 ,丁的水溶液pH>7的原因是: (用离子方程式表示)。
③将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/L KMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式 。
您最近一年使用:0次



