名校
解题方法
1 . 科学研究人员在金星大气中探测到了只属于 的光谱特征,据此推断金星大气层或存在生命。已知
的光谱特征,据此推断金星大气层或存在生命。已知 与足量
与足量 溶液发生反应
溶液发生反应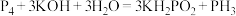 。
。 为弱电解质,下列说法正确的是
为弱电解质,下列说法正确的是
 的光谱特征,据此推断金星大气层或存在生命。已知
的光谱特征,据此推断金星大气层或存在生命。已知 与足量
与足量 溶液发生反应
溶液发生反应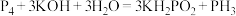 。
。 为弱电解质,下列说法正确的是
为弱电解质,下列说法正确的是A.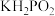 溶液中存在 溶液中存在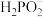 的电离平衡和水解平衡,以及水的电离平衡 的电离平衡和水解平衡,以及水的电离平衡 |
B.用 表示基态 表示基态 原子最外层电子排布违反能量最低原理 原子最外层电子排布违反能量最低原理 |
C.基态 原子核外电子有10种空间运动状态 原子核外电子有10种空间运动状态 |
D.加水稀释 溶液,溶液中所有离子浓度均减少 溶液,溶液中所有离子浓度均减少 |
您最近一年使用:0次
2024-03-25更新
|
146次组卷
|
2卷引用:黑龙江省大兴安岭实验中学2023-2024学年高二下学期开学考试化学试卷
名校
解题方法
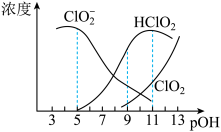
2 . 亚氯酸钠( )在溶液中会生成
)在溶液中会生成 、
、 、
、 、
、 等,其中
等,其中 和
和 都具有漂白作用。已知
都具有漂白作用。已知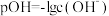 ,经测定
,经测定 时各组分含量随
时各组分含量随 变化情况如图所示(
变化情况如图所示( 没有画出),此温度下,下列分析正确的是
没有画出),此温度下,下列分析正确的是
 )在溶液中会生成
)在溶液中会生成 、
、 、
、 、
、 等,其中
等,其中 和
和 都具有漂白作用。已知
都具有漂白作用。已知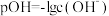 ,经测定
,经测定 时各组分含量随
时各组分含量随 变化情况如图所示(
变化情况如图所示( 没有画出),此温度下,下列分析正确的是
没有画出),此温度下,下列分析正确的是
A. 的电离平衡常数的数值 的电离平衡常数的数值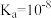 |
B.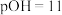 时, 时, 部分转化成 部分转化成 和 和 离子的方程式为 离子的方程式为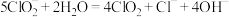 |
C. 时,溶液中含氯微粒的浓度大小为 时,溶液中含氯微粒的浓度大小为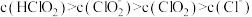 |
D.同浓度的 溶液和 溶液和 溶液等体积混合,则混合溶液中有 溶液等体积混合,则混合溶液中有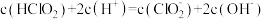 |
您最近一年使用:0次
名校
解题方法
3 . X、Y、Z、M、Q、R是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如表所示:
回答下列问题。
(1)X与Q的电负性大小顺序为___________ (用元素符号表示)。
(2)Y元素基态原子的简化电子排布式为___________ ;R元素基态原子的价层电子轨道表示式为___________ 。
(3)R元素可形成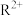 和
和 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是___________ 。
(4)Y、Z的电负性较大的是___________ (填元素符号)。
(5)与M元素成对角线规则关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物对应的水化物反应的离子方程式:___________ 。
| 元素 | 相关信息 |
| X | 原子核外有6种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相等 |
| Z | 原子半径在同周期主族元素中最大 |
| M | 逐级电离能(单位: )依次为578、1817、2745、11575、14830、18376、23293 )依次为578、1817、2745、11575、14830、18376、23293 |
| Q | 基态原子的核外电子占据5个能级,且最外层p轨道上有2个电子的自旋方向与其他电子的自旋方向相反 |
| R | 基态原子3d能级上有6个电子 |
(1)X与Q的电负性大小顺序为
(2)Y元素基态原子的简化电子排布式为
(3)R元素可形成
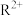 和
和 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是(4)Y、Z的电负性较大的是
(5)与M元素成对角线规则关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物对应的水化物反应的离子方程式:
您最近一年使用:0次
名校
解题方法
4 . 常温下,有关下列溶液的说法正确的是
A.加水稀释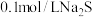 溶液时,溶液中各离子浓度一定都减小 溶液时,溶液中各离子浓度一定都减小 |
B.常温下 相同的① 相同的① ② ② ③ ③ 三种溶液的 三种溶液的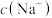 :③>①>② :③>①>② |
C.将 的氨水与 的氨水与 盐酸等体积混合,平衡时 盐酸等体积混合,平衡时 , , 的电离平衡常数可表示为 的电离平衡常数可表示为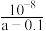 |
D.常温下 相同的 相同的 和 和 溶液中水的电离程度相同 溶液中水的电离程度相同 |
您最近一年使用:0次
5 . 某学生用标准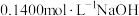 溶液滴定未知浓度硫酸的实验操作如下(正确的操作顺序自行判断):
溶液滴定未知浓度硫酸的实验操作如下(正确的操作顺序自行判断):
A.用酸式滴定管取稀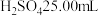 ,注入锥形瓶中,加入酚酞
,注入锥形瓶中,加入酚酞
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的 溶液润洗后,将标准液注入碱式滴定管刻度“0”以上
溶液润洗后,将标准液注入碱式滴定管刻度“0”以上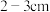 处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度,用去 溶液
溶液
(1)在G操作中如何确定终点___________ 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果___________ (填“偏小”、“偏大”或“恰好合适”)。
(3)配制 标准溶液,除了烧杯、玻璃棒,必须使用到的玻璃仪器是
标准溶液,除了烧杯、玻璃棒,必须使用到的玻璃仪器是___________ 。
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,会导致测得的稀 溶液浓度测定值
溶液浓度测定值___________ (选填“偏大”“偏小”或“无影响”)。
(5)计算待测硫酸溶液的物质的量浓度___________ 。
(6)利用 燃料电池电解制备
燃料电池电解制备 并得到副产物
并得到副产物 、
、 、
、 ,装置如图所示
,装置如图所示
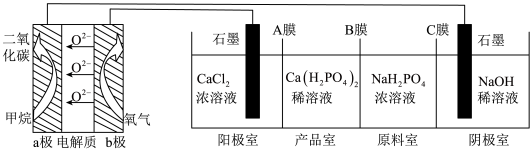
①a极的电极方程式:___________ 。
②A膜为___________ 、B膜为___________ (阳离子交换膜或阴离子交换膜)。
 溶液滴定未知浓度硫酸的实验操作如下(正确的操作顺序自行判断):
溶液滴定未知浓度硫酸的实验操作如下(正确的操作顺序自行判断):A.用酸式滴定管取稀
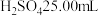 ,注入锥形瓶中,加入酚酞
,注入锥形瓶中,加入酚酞B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的
 溶液润洗后,将标准液注入碱式滴定管刻度“0”以上
溶液润洗后,将标准液注入碱式滴定管刻度“0”以上 处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度,用去
 溶液
溶液
(1)在G操作中如何确定终点
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
(3)配制
 标准溶液,除了烧杯、玻璃棒,必须使用到的玻璃仪器是
标准溶液,除了烧杯、玻璃棒,必须使用到的玻璃仪器是(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,会导致测得的稀
 溶液浓度测定值
溶液浓度测定值(5)计算待测硫酸溶液的物质的量浓度
(6)利用
 燃料电池电解制备
燃料电池电解制备 并得到副产物
并得到副产物 、
、 、
、 ,装置如图所示
,装置如图所示
①a极的电极方程式:
②A膜为
您最近一年使用:0次
名校
解题方法
6 . 环成二烯(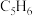 )是一种重要的有机化工原料。
)是一种重要的有机化工原料。
Ⅰ.环戊二烯容易反应生成双环戊二烯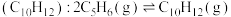 。不同温度下,溶液中环戊二烯(
。不同温度下,溶液中环戊二烯(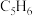 )浓度(初始浓度为
)浓度(初始浓度为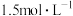 )与反应时间的关系如图所示。
)与反应时间的关系如图所示。
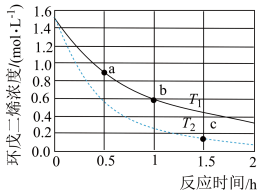
(1)反应开始至b点时,用双环戊二烯(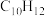 )表示的平均速率为
)表示的平均速率为___________  (小数表示)。
(小数表示)。
(2)
___________  (填“大于”、“小于”或“等于”);
(填“大于”、“小于”或“等于”);
(3)a点的正反应速率___________ b点的逆反应速率(填“大于”、“小于”或“等于”)。
Ⅱ.可用环戊二烯(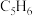 )制备环戊烯(
)制备环戊烯(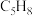 )。有如下反应:
)。有如下反应:
反应ⅰ: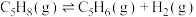
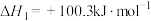
反应ⅱ:
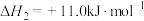
反应ⅲ: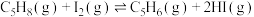

(4)反应ⅲ的焓变
___________  。
。
(5)某温度时在恒容密闭容器中充入等物质的量的碘和环戊烯发生反应ⅲ,起始总压为 ,平衡时总压为
,平衡时总压为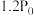 。
。
①平衡时环戊烯(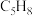 )的体积分数为
)的体积分数为___________  。
。
②用平衡分压(分压 总压
总压 物质的量分数)代替平衡浓度计算压强平衡常数
物质的量分数)代替平衡浓度计算压强平衡常数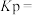
___________ 。
A.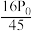 B.
B.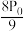 C.
C.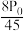 D.
D.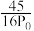
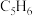 )是一种重要的有机化工原料。
)是一种重要的有机化工原料。Ⅰ.环戊二烯容易反应生成双环戊二烯
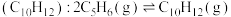 。不同温度下,溶液中环戊二烯(
。不同温度下,溶液中环戊二烯(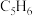 )浓度(初始浓度为
)浓度(初始浓度为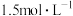 )与反应时间的关系如图所示。
)与反应时间的关系如图所示。
(1)反应开始至b点时,用双环戊二烯(
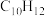 )表示的平均速率为
)表示的平均速率为 (小数表示)。
(小数表示)。(2)

 (填“大于”、“小于”或“等于”);
(填“大于”、“小于”或“等于”);(3)a点的正反应速率
Ⅱ.可用环戊二烯(
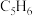 )制备环戊烯(
)制备环戊烯(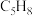 )。有如下反应:
)。有如下反应:反应ⅰ:
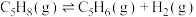
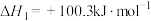
反应ⅱ:

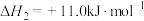
反应ⅲ:
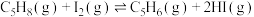

(4)反应ⅲ的焓变

 。
。(5)某温度时在恒容密闭容器中充入等物质的量的碘和环戊烯发生反应ⅲ,起始总压为
 ,平衡时总压为
,平衡时总压为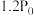 。
。①平衡时环戊烯(
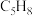 )的体积分数为
)的体积分数为 。
。②用平衡分压(分压
 总压
总压 物质的量分数)代替平衡浓度计算压强平衡常数
物质的量分数)代替平衡浓度计算压强平衡常数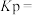
A.
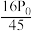 B.
B.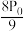 C.
C.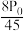 D.
D.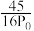
您最近一年使用:0次
名校
解题方法
7 . 将电化学法和生物还原法有机结合,利用微生物电化学方法可生产甲烷,装置如图所示。下列说法正确的是
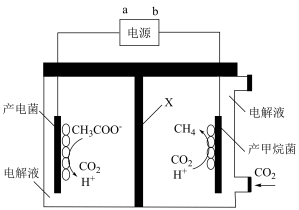

A.通电时,电子由 →电解池阴极→电解液→电解池阳极→ →电解池阴极→电解液→电解池阳极→ |
| B.X为阴离子交换膜 |
C.阳极的电极反应式为: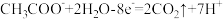 |
| D.生成0.1mol甲烷时阳极室理论上生成4.48L二氧化碳 |
您最近一年使用:0次
2024-03-03更新
|
183次组卷
|
2卷引用:黑龙江省大兴安岭实验中学2023-2024学年高二下学期开学考试化学试卷
名校
解题方法
8 . 汽车尾气中含有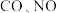 等有害气体。
等有害气体。
(1)汽车尾气中 生成过程的能量变化示意图如图:
生成过程的能量变化示意图如图:___________ 。
(2)利用催化技术可将汽车尾气中的 和
和 转化为
转化为 和
和 。
。
①该反应的化学方程式为___________ 。
②某温度下,在 的密闭容器中通入
的密闭容器中通入 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:
用 的浓度变化表示反应由开始到
的浓度变化表示反应由开始到 时的平均反应速率为
时的平均反应速率为___________  ;若恒温下保持起始投料量相同,容器体积变为
;若恒温下保持起始投料量相同,容器体积变为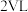 ,则该反应的速率会
,则该反应的速率会___________ (填“增大”“减小”或“不变”)。
③下列可以表明上述可逆反应已达到化学平衡状态的是___________ (填序号)。
a.容器中的气体压强保持不变
b.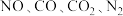 的浓度之比为
的浓度之比为
c. 的浓度不再改变
的浓度不再改变
d.相同时间内,反应消耗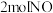 的同时消耗
的同时消耗
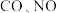 等有害气体。
等有害气体。(1)汽车尾气中
 生成过程的能量变化示意图如图:
生成过程的能量变化示意图如图: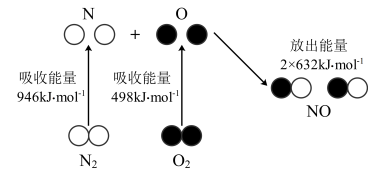
(2)利用催化技术可将汽车尾气中的
 和
和 转化为
转化为 和
和 。
。①该反应的化学方程式为
②某温度下,在
 的密闭容器中通入
的密闭容器中通入 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:时间/ | 0 | 1 | 2 | 3 | … |
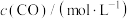 | 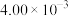 |  |  |  | … |
 的浓度变化表示反应由开始到
的浓度变化表示反应由开始到 时的平均反应速率为
时的平均反应速率为 ;若恒温下保持起始投料量相同,容器体积变为
;若恒温下保持起始投料量相同,容器体积变为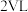 ,则该反应的速率会
,则该反应的速率会③下列可以表明上述可逆反应已达到化学平衡状态的是
a.容器中的气体压强保持不变
b.
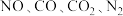 的浓度之比为
的浓度之比为
c.
 的浓度不再改变
的浓度不再改变d.相同时间内,反应消耗
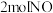 的同时消耗
的同时消耗
您最近一年使用:0次
名校
9 . 乙烯是重要的化工原料,有关乙烯的部分转化关系如图:
(1)写出A的结构简式:___________ 。
(2)反应②的反应类型为___________ 。
(3)反应③的化学方程式为___________ 。
(4)乙二醇和乙酸发生酯化反应得到产物 ,为测定B的分子式,取有机物
,为测定B的分子式,取有机物 ,在足量氧气中充分燃烧,并使产物依次缓慢通过浓硫酸、碱石灰,两者分别增重7.2和
,在足量氧气中充分燃烧,并使产物依次缓慢通过浓硫酸、碱石灰,两者分别增重7.2和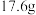 ,写出有机物
,写出有机物 的分子式
的分子式___________ 。
(5)有机物 的同分异构体
的同分异构体 ,
,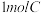 与足量的
与足量的 粉末反应,生成
粉末反应,生成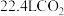 (标准状况),若与足量金属钠反应则生成
(标准状况),若与足量金属钠反应则生成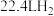 (标准状况),则
(标准状况),则 可能的结构有
可能的结构有___________ 种。

(1)写出A的结构简式:
(2)反应②的反应类型为
(3)反应③的化学方程式为
(4)乙二醇和乙酸发生酯化反应得到产物
 ,为测定B的分子式,取有机物
,为测定B的分子式,取有机物 ,在足量氧气中充分燃烧,并使产物依次缓慢通过浓硫酸、碱石灰,两者分别增重7.2和
,在足量氧气中充分燃烧,并使产物依次缓慢通过浓硫酸、碱石灰,两者分别增重7.2和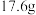 ,写出有机物
,写出有机物 的分子式
的分子式(5)有机物
 的同分异构体
的同分异构体 ,
,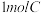 与足量的
与足量的 粉末反应,生成
粉末反应,生成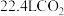 (标准状况),若与足量金属钠反应则生成
(标准状况),若与足量金属钠反应则生成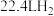 (标准状况),则
(标准状况),则 可能的结构有
可能的结构有
您最近一年使用:0次
名校
10 . 氮及其化合物在生产生活中有广泛的应用,按要求回答下列问题:
I.氨气是重要的化工原料,回答下列问题:
(1)实验室制取 的化学方程式为
的化学方程式为___________ 。
(2)1909年化学家哈伯在实验室首次用单质合成了氨。2007年化学家格哈德埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖。用 、
、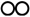 、
、 分别表示
分别表示 ,观察如图,判断符合在催化剂表面合成氨反应过程的顺序为___________。
,观察如图,判断符合在催化剂表面合成氨反应过程的顺序为___________。
II.氮氧化物是造成环境污染的主要原因之一,消除氮氧化物有多种方法。
(3)某学习小组设计如图装置,有效降低含氮化合物的排放,同时充分利用化学能,相同温度和压强下,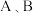 两电极产生气体的体积比为
两电极产生气体的体积比为___________ , 电极的电极反应方程式为
电极的电极反应方程式为___________ 。
I.氨气是重要的化工原料,回答下列问题:
(1)实验室制取
 的化学方程式为
的化学方程式为(2)1909年化学家哈伯在实验室首次用单质合成了氨。2007年化学家格哈德埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖。用
 、
、 、
、 分别表示
分别表示 ,观察如图,判断符合在催化剂表面合成氨反应过程的顺序为___________。
,观察如图,判断符合在催化剂表面合成氨反应过程的顺序为___________。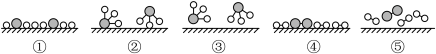
| A.②③④①⑤ | B.③②①④⑤ | C.③②④①⑤ | D.⑤④①②③ |
II.氮氧化物是造成环境污染的主要原因之一,消除氮氧化物有多种方法。
(3)某学习小组设计如图装置,有效降低含氮化合物的排放,同时充分利用化学能,相同温度和压强下,
 两电极产生气体的体积比为
两电极产生气体的体积比为 电极的电极反应方程式为
电极的电极反应方程式为
您最近一年使用:0次



