名校
解题方法
1 . 下列除杂的方法(括号里为少量杂质)中,所用试剂或操作不正确的是
A. 溶液( 溶液( ):通入适量的 ):通入适量的 |
B.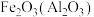 :加入NaOH溶液再过滤 :加入NaOH溶液再过滤 |
C. 溶液( 溶液( ):通入适量的氯气 ):通入适量的氯气 |
D.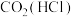 :将气体通过盛有饱和 :将气体通过盛有饱和 溶液的洗气瓶 溶液的洗气瓶 |
您最近一年使用:0次
2024-03-31更新
|
260次组卷
|
15卷引用:湖北省十堰市第二中学2021-2022学年高一上学期期末考试化学试题
湖北省十堰市第二中学2021-2022学年高一上学期期末考试化学试题广东省广州市南武中学2022-2023学年高一上学期线上综合测试(二)化学试题陕西省西安市第六中学2022-2023学年高一上学期期末考试化学试题陕西省商洛市洛南中学2022-2023学年高一上学期12月月考化学试题江西省宜春市宜丰中学2022-2023学年高一上学期期末考试化学试题江西省南昌市东湖区八一中学2022-2023学年高一上学期12月月考化学试题山西省阳泉市2023-2024学年高一上学期期末教学质量监测化学试题江西省丰城市第九中学2023-2024学年高一下学期开学考试化学试题陕西省宝鸡市金台区2023-2024学年高一上学期期末检测化学试题四川省内江市第六中学2023-2024学年高一下学期入学考试化学试题 安徽省六安市金寨县青山中学2023-2024学年高一下学期第一次月考化学试题江西省宜春市万载县万载二中 2023?2024 学年高一上学期期末模拟考试化学试卷河南省平顶山市第二中学2023-2024学年高一上学期期末化学试题四川省德阳市外国语学校2023-2024学年高一上学期期末模拟考试化学试题河南省南阳市社旗县第一高级中学2023-2024学年高三上学期1月月考化学试题
名校
解题方法
2 . 只用一种试剂,将 、
、 、
、 、
、 4种物质的溶液区分开,这种试剂是
4种物质的溶液区分开,这种试剂是
 、
、 、
、 、
、 4种物质的溶液区分开,这种试剂是
4种物质的溶液区分开,这种试剂是A. 溶液 溶液 | B. 溶液 溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
您最近一年使用:0次
2024-01-27更新
|
337次组卷
|
68卷引用:湖北省竹山县第二中学2021-2022学年高一下学期第一次月考化学试题
湖北省竹山县第二中学2021-2022学年高一下学期第一次月考化学试题浙江省山河联盟学校2020-2021学年高一下学期4月月考化学试题 长春市榆树高级中学2020-2021学年高一下学期期中考试化学试题辽宁省大连市普兰店区第二中学2020-2021学年高一下学期期中考试化学试题辽宁省大连市第一中学2020-2021学年高一下学期期中(合格性)考试化学试题河北省衡水市第十四中学2021-2022学年高一上学期一调考试(1)化学试题江西省奉新县部分学校2021-2022学年高一上学期第二次月考化学试题贵州省“三新”改革联盟校2021-2022学年高一下学期联考试题(三) 化学试题北京市北京师范大学附属实验中学2021-2022学年高一下学期期中考试化学试题北京师范大学附属实验中学2021-2022学年高一下学期期中考试化学试题黑龙江佳木斯市第一中学2021-2022学年高一下学期期中考试化学(文)试题吉林省通化市2021-2022学年高一下学期期中联考化学试题(已下线)第02练 氮及其化合物-2022年【暑假分层作业】高一化学(人教版2019必修第二册)安徽省芜湖市2021-2022学年高一下学期期末质量监测化学试题广东省惠州市2021-2022学年高一下学期7月期末统考化学试题湖北省宜城市第三中学2021-2022学年高一上学期期中化学试题广西桂林市逸仙中学2021-2022学年高一下学期期中考试 化学试题青海省西宁市湟中区多巴高级中学2021-2022学年高一下学期第一次月考化学试题湖北省武汉市钢城第四中学2021-2022学年高一下学期期中考试化学试题新疆哈密市第八中学2021-2022学年高一下学期期中考试化学试题新疆和田地区洛浦县第一中学2021-2022学年高一下学期3月月考化学试题浙江省台州市书生中学2022-2023学年高一上学期第一次月考化学试题云南省建水县第二中学2021-2022学年高一下学期期末考试化学试题黑龙江省饶河县高级中学2021-2022学年高一下学期学业水平(合格考)化学试题(已下线)3.2.2 铵盐和硝酸-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)黑龙江省哈尔滨市第十九中学2021-2022学年高一上学期第一次月考化学试题云南省曲靖市富源县第一中学2020-2021学年高一下学期期中考试化学试题(已下线)【知识图鉴】单元讲练测必修第二册第五单元 01讲核心2023年广东省普通高中学业水平合格性考试化学科模拟测试卷(二)陕西省西安市第六中学2022-2023学年高一下学期第一次月考化学试题北京市顺义区第一中学2022-2023学年高一下学期3月月考化学试题甘肃省张掖市高台县第一中学2022-2023学年高一下学期3月月考化学试题广西百色高级中学田林分校2022-2023学年高一下学期3月月考化学试题安徽省合肥市第一中学2022-2023 学年高一下学期第三次素质拓展训练化学试题安徽省合肥市第一中学2022-2023学年高一下学期段考一化学试题湖南省长沙市长郡中学2022-2023学年高一下学期期中考试化学试题 安徽省黄山市屯溪第一中学2022-2023学年高一下学期4月期中考试化学试题广东省江门市新会陈经纶中学2022-2023学年高一下学期期中考试(合格考)化学试题云南省大理白族自治州民族中学2022-2023学年高一下学期5月期中化学试题云南省红河哈尼族彝族自治州第一中学2022-2023学年高一下学期5月期中化学试题云南省昆明市第一中学2022-2023学年高一下学期期中考试化学试题陕西省西安市第八十五中学2022-2023学年高一下学期月考化学试题 广东省揭阳岐山中学2022-2023学年高一下学期4月期中考试化学试题 河南大学附属中学2022-2023学年高一下学期期中考试 化学试题黑龙江省哈尔滨市第三中学2022-2023学年高一下学期学业水平强化模拟考试化学试题【精品卷】1.2.3 离子反应的应用课堂例题-人教版2023-2024学年必修第一册黑龙江省大庆市大庆中学2022-2023学年高一下学期7月期末考试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高一下学期6月考试化学试题浙江省嘉兴八校联盟2021-2022学年高一下学期期中联考化学试题(已下线)专题六 物质的电离与离子反应云南省昆明市第八中学2023-2024学年高一上学期9月月考化学试卷题甘肃省天水市秦安县第一中学2022-2023学年高一上学期10月期中考试化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高一下学期4月月考化学试题江西省宜春市宜丰中学2022-2023学年高一下学期3月月考化学试题(已下线)专题二 物质的检验、除杂和鉴别四川省自贡市蜀光中学2023-2024学年高一上学期10月月考化学试题湖南省岳阳市岳阳楼区2022-2023学年高一下学期期末考试化学试题湖北省钟祥市旧口高级中学2023-2024学年高一上学期期中考试化学试卷云南省文山州砚山县第三高级中学2021-2022学年高一上学期期末考试化学试卷云南省保山市腾冲市第八中学2020-2021学年高一下学期期中考试化学试题广东省江门市某校2023-2024学年高一下学期第一次质量检测化学试题(已下线)5.2.2 氨和铵盐广东省韶关实验中学2023-2024学年高一下学期3月份月考化学试题宁夏回族自治区石嘴山市平罗县平罗中学2023-2024学年高一下学期5月期中化学试题浙江省平阳县万全综合高级中学2021-2022学年高二上学期第一次月考化学试题浙江省台州市路桥区东方理想学校2021-2022学年高二10月阶段性考试化学试题2021年海南高考化学试题变式题1-10(已下线)专题突破卷04?非金属及其化合物?-2024年高考化学一轮复习考点通关卷(新教材新高考)
名校
解题方法
3 . 下列实验装置不能达到实验目的的是
A.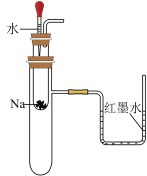 验证Na和水反应是否为放热反应 验证Na和水反应是否为放热反应 |
B.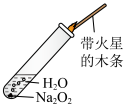 检验 检验  与 与 反应有 反应有 生成 生成 |
C.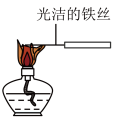 观察纯碱的焰色反应 观察纯碱的焰色反应 |
D.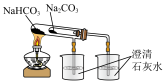 比较 比较 、 、 的热稳定性 的热稳定性 |
您最近一年使用:0次
2024-01-04更新
|
441次组卷
|
59卷引用:湖北省十堰市2020-2021学年高一上学期期末考试化学试题
湖北省十堰市2020-2021学年高一上学期期末考试化学试题专题3 第二单元 第2课时 碳酸钠 碳酸氢钠-高中化学苏教2019版必修第一册广西贵港市覃塘高中2020-2021学年高一上学期12月月考化学试题吉林省磐石一中、伊通一中、梅河口五中、四平一中等2020-2021学年高一上学期期末考试化学试题江西省抚州市2020-2021学年高一上学期学生学业发展水平测试(期末考试) 化学(B卷) 试题山西省怀仁市第一中学云东校区2020-2021学年高一下学期第一次月考化学试题江西省宜春市奉新县第一中学2020-2021学年高一下学期第二次月考化学试题(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00151】.山西省太原市第五中学2021-2022学年高一上学期10月月考化学试题湖北省沙市中学2021-2022学年高一上学期期中考试化学试题安徽省滁州市定远县民族中学2021-2022学年高一上学期第一次月考化学试题安徽省定远县炉桥中学2021-2022学年高一上学期10月教学质量检测化学试题山东省济南市第一中学2021-2022学年高一上学期期中考试化学试题湖南省长沙市第一中学2021-2022学年高一上学期期中考试化学试题黑龙江省绥化市第一中学2021-2022学年高一上学期期中考试化学试卷广东省东莞市东华高级中学2021-2022学年高一上学期前段考化学试题黑龙江省大庆中学2021-2022学年高一上学期期中考试化学试题吉林省长春市第二中学2021-2022学年高一上学期期中考试化学试题重庆复旦中学2021-2022学年高一上学期期中考试化学试题山西省长治市第二中学校2021-2022学年高一上学期第二次练考化学试题(已下线)第08练 钠及其化合物-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)河北武强中学2021-2022学年高一上学期期中考试化学试题四川省南充高级中学2021-2022学年高一上学期第二次月考化学试题新疆乌鲁木齐市第三十一中学2021-2022学年高一上学期期中考试化学试题湖南省株洲市攸县第一中学2022-2023学年高一上学期期中考试化学试题黑龙江省齐齐哈尔市克东县五校2022-2023学年高一上学期期中考试化学试题江苏省南通市海安高级中学2022-2023学年高一上学期11月期中考试化学试题广东省茂名市电白区2022-2023学年高一上学期期中考试化学试题陕西省西安市碑林区2022-2023学年高一上学期期中联考化学试题湖南省长沙市明德中学2022-2023学年高一上学期期中考试化学试题四川省成都外国语学校2022-2023学年高一上学期期中考试化学试题湖南省邵阳市第二中学2022-2023学年高一上学期期中考试化学试题北京市首都师范大学附属中学2022-2023学年高一上学期12月月考化学试题广东省广州市番禺区洛城中学2022-2023学年高一上学期第一次月考化学试题湖南省邵阳市隆回县第二中学2022-2023学年高一上学期期中考试化学试题浙江省绍兴鲁迅高级中学2021-2022学年高一上学期期中考试化学试题山东省临沂市郯城县江山高级中学2022-2023学年高一上学期期中考试化学试题广东省汕头市实验学校2022-2023学年高一上学期期中质量检测化学试题江苏省南通市海安李堡中学2021-2022学年高一上学期期中考试化学试题云南省西双版纳傣族自治州第一中学2022-2023学年高一上学期期中考试化学试题广东省揭阳市揭东区2022-2023学年高一上学期期末考试化学试题天津市武清区2022-2023学年高一上学期期末考试化学试题陕西省咸阳市兴平南郊高级中学2022-2023学年高一上学期期中考试化学试题贵州省毕节地区黔西县2022-2023学年高一上学期期末测试化学试题云南省曲靖市会泽县实验高级中学校2022-2023学年高一下学期月考(四)化学试题广西贵港市名校2023-2024学年高一上学期入学联考化学试题福建省南安市侨光中学2022-2023学年高一上学期12月月考化学试题四川省南充高级中学2022-2023学年高一上学期期中考试化学试题河南省商丘名校联考2023-2024学年高一上学期11月期中考试化学试题天津市耀华中学2023-2024学年高一上学期11月期中考试化学试题安徽省肥东县综合高中2022-2023学年高一上学期11月期中化学试题江西省南昌市东湖区八一中学2022-2023学年高一上学期12月月考化学试题江西省南昌市南钢学校2023-2024学年高一上学期期中考试化学试卷 湖北省襄阳市第一中学2023-2024学年高一上学期10月月考化学试题北京市铁路第二中学2023-2024学年高一上学期期中考试化学试题福建省福州教育学院第二附属中学2023-2024学年高一上学期12月月考化学试卷(已下线)寒假作业04 钠及其化合物-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)北京市第一六一中学2023-2024学年高一上学期期中考试化学试题广东省乐昌第一中学2022届高三下学期2月第二次周考化学试题
名校
解题方法
4 . 硫元素的几种化合物及其单质存在下列转化关系(反应条件省略)。

下列判断不正确的是

下列判断不正确的是
A.反应①中氧化剂与还原剂物质的量之比为 |
B.反应②表明 具有酸性氧化物的性质 具有酸性氧化物的性质 |
| C.反应③的原子利用率是100% |
D.反应④中稀 是氧化剂 是氧化剂 |
您最近一年使用:0次
2023-12-27更新
|
258次组卷
|
9卷引用:湖北省竹山县第二中学2021-2022学年高一下学期第一次月考化学试题
湖北省竹山县第二中学2021-2022学年高一下学期第一次月考化学试题辽宁省锦州市2019-2020学年高一下学期期末考试化学试题(已下线)5.1.3 不同价态含硫物质的转化-2021-2022学年高一化学课后培优练(人教版2019必修第二册)浙江省玉环市玉城中学2021-2022学年高一下学期开学考试化学试题第五章 化工生产中的重要非金属元素(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第01练 硫及其化合物-2023年【暑假分层作业】高一化学(人教版2019必修第二册)第3课时 不同价态含硫物质的转化山东省菏泽市第一中学2023-2024学年高一上学期第三次月考化学试题山东省菏泽市曹县第一中学2023-2024学年高一上学期 月考化学试题
名校
5 . 过氧化氢(分子结构为H—O—O—H)俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。根据下列反应回答问题:
A.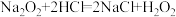
B.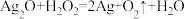
C.
D.
E.4H2O2+ +2H+=2CrO5+5H2O(CrO5分子结构为
+2H+=2CrO5+5H2O(CrO5分子结构为 )
)
(1)A反应属于四种基本反应类型中的___________ (填化学反应名称)。
(2)上述反应中,H2O2仅体现还原性的是___________ (填字母序号,下同),H2O2既体现氧化性又体现还原性的反应是___________ ;
(3)E反应___________ (填“是”、“不是”)氧化还原反应,你的判断理由是___________ 。
(4)配平下列足量的酸性高锰酸钾溶液与过氧化氢溶液反应的离子方程式,并用单线桥法标出反应中电子转移的方向和数目:___________ 。
 +H2O2+_________—Mn2++O2↑+__________
+H2O2+_________—Mn2++O2↑+__________
(5)将黄色、微溶的NaBiO3固体加入MnSO4和H2SO4的混合溶液里并加热,最后溶液显紫色(Bi3+无色)。写出该反应的离子方程式:___________ 。
A.
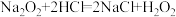
B.
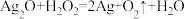
C.

D.

E.4H2O2+
 +2H+=2CrO5+5H2O(CrO5分子结构为
+2H+=2CrO5+5H2O(CrO5分子结构为 )
)(1)A反应属于四种基本反应类型中的
(2)上述反应中,H2O2仅体现还原性的是
(3)E反应
(4)配平下列足量的酸性高锰酸钾溶液与过氧化氢溶液反应的离子方程式,并用单线桥法标出反应中电子转移的方向和数目:
 +H2O2+_________—Mn2++O2↑+__________
+H2O2+_________—Mn2++O2↑+__________(5)将黄色、微溶的NaBiO3固体加入MnSO4和H2SO4的混合溶液里并加热,最后溶液显紫色(Bi3+无色)。写出该反应的离子方程式:
您最近一年使用:0次
名校
6 . P元素有三种含氧酸:H3PO4、H3PO3、H3PO2,它们依次为三元、二元、一元弱酸。H3PO2可将溶液中的Ag+还原为Ag,从而可用于化学镀银。请回答下列问题:
(1)写出H3PO4与足量NaOH溶液反应的化学方程式:___________ 。
(2)H3PO3中,P元素的化合价为___________ ;H3PO2的电离方程式是___________ 。
(3)Na2HPO3、NaH2PO2均属于___________ 盐(填“酸式”、“碱式”、“正”)。
(4)用H3PO2进行化学镀银时,氧化剂与还原剂的粒子个数之比为 ,则氧化产物可能为下列选项中的
,则氧化产物可能为下列选项中的___________ (填字母序号)。
a.H3PO3 b.H3PO4 c.无法确定
据此,写出上述镀银反应的离子方程式:___________ 。
(1)写出H3PO4与足量NaOH溶液反应的化学方程式:
(2)H3PO3中,P元素的化合价为
(3)Na2HPO3、NaH2PO2均属于
(4)用H3PO2进行化学镀银时,氧化剂与还原剂的粒子个数之比为
 ,则氧化产物可能为下列选项中的
,则氧化产物可能为下列选项中的a.H3PO3 b.H3PO4 c.无法确定
据此,写出上述镀银反应的离子方程式:
您最近一年使用:0次
名校
解题方法
7 . 某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中两次检测结果如下表所示,请回答下列问题:
(1)在上述的两次检测中,如果检测结果正确的那一次涉及的五种离子(顺序见上表)个数之比为4∶5∶1∶x∶3,则x=___________ 。
(2)为了进一步确认检验溶液中存在的 、
、 和Cl-,按照下列步骤依次进行:
和Cl-,按照下列步骤依次进行:
第一步:向溶液中滴加过量的___________ 溶液(填化学式),其目的是确认 并将其除去;发生反应的
并将其除去;发生反应的离子方程式 为___________ ;
第二步:加入过量的___________ 溶液(填化学式),其目的是确认 并将其除去;发生反应的
并将其除去;发生反应的离子方程式 为___________ ;
第三步:过滤,再向滤液中加入___________ 溶液(填化学式),其目的是确认Cl-离子。
| 检测次数 | 溶液中检测出的离子 |
| 第①次 | K+、Na+、 、 、 、Cl- 、Cl- |
| 第②次 | K+、Na+、Ba2+、Cl-、 |
(2)为了进一步确认检验溶液中存在的
 、
、 和Cl-,按照下列步骤依次进行:
和Cl-,按照下列步骤依次进行:第一步:向溶液中滴加过量的
 并将其除去;发生反应的
并将其除去;发生反应的第二步:加入过量的
 并将其除去;发生反应的
并将其除去;发生反应的第三步:过滤,再向滤液中加入
您最近一年使用:0次
名校
解题方法
8 . 制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。
(1)方案一:用下图所示方法和步骤进行实验:

①操作I、II涉及的实验名称依次是___________ 、洗涤、干燥、称量。
②该方案中涉及有关反应的离子方程式为___________ 。
(2)方案二:利用下图所示装置来测定纯碱样品中Na2CO3的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:

a.按图连接装置,并检查气密性;
b.准确称得盛有碱石灰的装置D的质量为86.2g;
c.准确称得5.9g纯碱样品放入容器II中;
d.打开分液漏斗I的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
e.打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得装置D的总质量为88.4g。
①装置D的名称是___________ 。
②若d、e两步的实验操作太快,则会导致测定结果___________ (填“偏大”或“偏小”)。
③装置E的作用是___________ 。
④根据实验中测得的有关数据,计算纯碱样品中Na2CO3的质量分数为___________ %(结果保留到小数点后一位)。
(1)方案一:用下图所示方法和步骤进行实验:

①操作I、II涉及的实验名称依次是
②该方案中涉及有关反应的离子方程式为
(2)方案二:利用下图所示装置来测定纯碱样品中Na2CO3的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:

a.按图连接装置,并检查气密性;
b.准确称得盛有碱石灰的装置D的质量为86.2g;
c.准确称得5.9g纯碱样品放入容器II中;
d.打开分液漏斗I的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
e.打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得装置D的总质量为88.4g。
①装置D的名称是
②若d、e两步的实验操作太快,则会导致测定结果
③装置E的作用是
④根据实验中测得的有关数据,计算纯碱样品中Na2CO3的质量分数为
您最近一年使用:0次
2023-09-16更新
|
105次组卷
|
2卷引用:湖北省十堰市郧阳中学2022-2023学年高一上学期10月月考化学试题
9 . 玻璃仪器内壁残留的硫单质可用热NaOH溶液洗涤除去,发生如下反应:
①3S+6NaOH 2Na2S+Na2SO3+3H2O
2Na2S+Na2SO3+3H2O
②(x-1)S+Na2S Na2Sx(x=2~6)
Na2Sx(x=2~6)
③S+Na2SO3 Na2S2O3
Na2S2O3
下列说法正确的是
①3S+6NaOH
 2Na2S+Na2SO3+3H2O
2Na2S+Na2SO3+3H2O②(x-1)S+Na2S
 Na2Sx(x=2~6)
Na2Sx(x=2~6)③S+Na2SO3
 Na2S2O3
Na2S2O3下列说法正确的是
| A.反应①、②、③中,硫单质的作用完全相同 |
| B.反应①中,氧化产物与还原产物中的S元素的质量之比为2:1 |
| C.S与溶质NaOH质量之比为1:a时二者恰好完全反应,S只转化为Na2S和Na2SO3,则a=5 |
| D.S与溶质NaOH个数之比为2:1时二者恰好完全反应,S只转化为Na2Sx和Na2S2O3,则x=5 |
您最近一年使用:0次
名校
解题方法
10 . 在密闭容器中充入CO、CO2、H2、CH4混合气体共5g,若加入足量Na2O2固体,充分振荡并不断用电火花引燃至反应完全,测得固体增加的质量为5g,则CO2与CH4的分子个数之比为
| A.2∶1 | B.1∶2 | C.1∶1 | D.无法确定 |
您最近一年使用:0次
2023-09-16更新
|
465次组卷
|
4卷引用:湖北省十堰市郧阳中学2022-2023学年高一上学期10月月考化学试题



