名校
解题方法
1 . 离子液体被认为是21世纪最有希望的绿色溶液和功能材料之一,在诸多领域的用途已被研究开发。有几种离子液体由原子序数依次增大的短周期主族元素X、Y、Z、W、R、Q组成。请回答:
(1)基态Z原子的价电子排布式为________ ,基态Y原子占据最高能级的电子云轮廓图为________ 形。
(2)下列说法正确的是____。
(3)试解释 分子中X-W-X键角比
分子中X-W-X键角比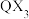 分子中X-Q-X键角大的原因
分子中X-Q-X键角大的原因________ 。
(4)化合物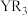 水解生成
水解生成 【也可写作
【也可写作 ,结构如图1】和
,结构如图1】和 。
。
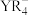 中Y原子的杂化方式为
中Y原子的杂化方式为________ , 晶体中含有
晶体中含有________  氢键。当
氢键。当 溶于水,
溶于水, 分子与水中
分子与水中 结合形成配位键,Y原子杂化方式由
结合形成配位键,Y原子杂化方式由 杂化变为
杂化变为 杂化,请用离子方程式解释
杂化,请用离子方程式解释 为一元弱酸原因
为一元弱酸原因________ 。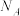 ,该晶体密度表达式为
,该晶体密度表达式为________  (YW的摩尔质量为
(YW的摩尔质量为 )。
)。
| 元素 | 元素性质或原子结构 |
| X | 电子只有一种自旋取向 |
| Y | 2p能级上有1个电子 |
| Z | 有6个不同运动状态的电子 |
| W | 2p轨道处于半充满状态,简单氢化物易液化,可用作制冷剂 |
| R | 仅有一个未成对电子,简单阴离子含10个电子 |
| Q | 与W位于同一主族 |
(1)基态Z原子的价电子排布式为
(2)下列说法正确的是____。
| A.氢化物的沸点:R>Z | B.分子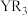 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.元素的电负性:R>X>Z | D.最高价含氧酸的酸性:W>Q |
(3)试解释
 分子中X-W-X键角比
分子中X-W-X键角比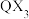 分子中X-Q-X键角大的原因
分子中X-Q-X键角大的原因(4)化合物
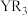 水解生成
水解生成 【也可写作
【也可写作 ,结构如图1】和
,结构如图1】和 。
。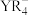 中Y原子的杂化方式为
中Y原子的杂化方式为 晶体中含有
晶体中含有 氢键。当
氢键。当 溶于水,
溶于水, 分子与水中
分子与水中 结合形成配位键,Y原子杂化方式由
结合形成配位键,Y原子杂化方式由 杂化变为
杂化变为 杂化,请用离子方程式解释
杂化,请用离子方程式解释 为一元弱酸原因
为一元弱酸原因 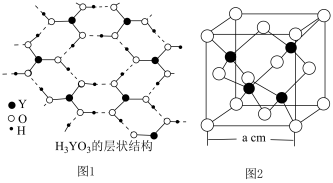
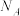 ,该晶体密度表达式为
,该晶体密度表达式为 (YW的摩尔质量为
(YW的摩尔质量为 )。
)。
您最近一年使用:0次
名校
解题方法
2 . 二氧化铈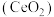 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: 能与
能与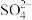 结合成
结合成 ;
;
②在硫酸体系中 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。
回答下列问题:
(1)“氧化焙烧”中氧化的目的是___________ 。
(2)“酸浸”时提高浸取率的方法___________ (写出一种)。
(3)“萃取”时存在反应: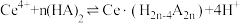 ,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为___________ (填标号);硫酸浓度过大时,萃取率降低的原因是___________ 。
(4)“反萃取”中,在稀硫酸和 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:___________ 。
(5)向水层中加入 溶液来调节溶液的
溶液来调节溶液的 ,
, 大于
大于___________ 时, 完全生成
完全生成 沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
(6)二氧化铈( )作为一种脱硝催化剂,能在
)作为一种脱硝催化剂,能在 和
和 之间改变氧化状态,将NO氧化为
之间改变氧化状态,将NO氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物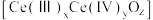 。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为
。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为___________ ,当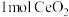 发生如图所示变化时,可吸收标况下NO的体积为
发生如图所示变化时,可吸收标况下NO的体积为___________ 。
 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:
 能与
能与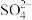 结合成
结合成 ;
;②在硫酸体系中
 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。回答下列问题:
(1)“氧化焙烧”中氧化的目的是
(2)“酸浸”时提高浸取率的方法
(3)“萃取”时存在反应:
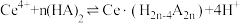 ,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
(4)“反萃取”中,在稀硫酸和
 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:(5)向水层中加入
 溶液来调节溶液的
溶液来调节溶液的 ,
, 大于
大于 完全生成
完全生成 沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)(6)二氧化铈(
 )作为一种脱硝催化剂,能在
)作为一种脱硝催化剂,能在 和
和 之间改变氧化状态,将NO氧化为
之间改变氧化状态,将NO氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物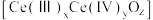 。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为
。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为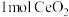 发生如图所示变化时,可吸收标况下NO的体积为
发生如图所示变化时,可吸收标况下NO的体积为
您最近一年使用:0次
名校
解题方法
3 . Ⅰ.工业生产纯碱的工艺流程示意图如图:
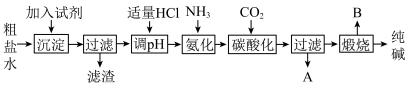
(1)为除去粗盐水中的
 、
、 、
、 等杂质离子,加入试剂顺序合理的是______。
等杂质离子,加入试剂顺序合理的是______。| A.碳酸钠、氢氧化钠、氯化钡 | B.碳酸钠、氯化钡、氢氧化钠 |
| C.氢氧化钠、碳酸钠、氯化钡 | D.氯化钡、氢氧化钠、碳酸钠 |
(2)工业生产纯碱工艺流程中,碳酸化时产生的现象是
(3)工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是
(4)碳酸化后过滤,滤液A最主要的成分是
Ⅱ.纯碱在生产生活中有广泛的用途。
(5)工业上,可用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与氯气反应可制得有效成分为次氯酸钠的消毒液,其反应的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量含氧橄榄石矿物(ZxW2-xRX4)。已知前四周期元素X、Y、Z、R、W的原子序数依次增大,Y的氢化物常用于雕刻玻璃,R元素的一种氧化物可制作光导纤维,W的合金材料是生活中用途最广泛的金属材料,基态Z原子核外s,p能级上电子总数相等。下列叙述正确的是
| A.原子半径:Z>R>Y>X |
| B.X的第一电离能比同周期相邻元素小 |
| C.X的简单氢化物的热稳定性强于Y的简单氢化物 |
| D.熔点:ZY2>RX2 |
您最近一年使用:0次
2023-10-26更新
|
1049次组卷
|
7卷引用:广西名校2023-2024学年高三上学期仿真卷(一)化学试题
广西名校2023-2024学年高三上学期仿真卷(一)化学试题湖南省郴州市2024届高三上学期一模化学试题湖南省邵阳市绥宁县世贤中学2023-2024学年高三上学期12月月考化学试题湖南省常德市 临澧县第一中学2023-2024学年高三上学期第五次阶段性考试化学试题(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届海南省海南中学高三下学期第一次模拟化学试题重庆市江北区2023-2024学年高三下学期模拟测试化学试题(七)
名校
5 . 碳酸钠俗称纯碱,用途非常广泛,我国化学家侯德榜发明了“侯氏制碱法”。南宁二中2023级化学兴趣小组在实验室中模拟“侯氏制碱法”制备 ,进一步处理得到产品
,进一步处理得到产品 和
和 ,实验流程如下所示。
,实验流程如下所示。
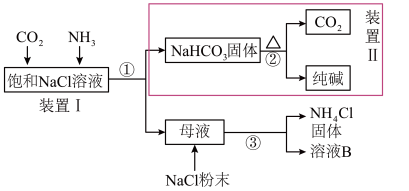
请回答下列问题:
(1)上述流程中,①②③所涉及的操作方法,包含过滤的是___________ (填序号)。过滤时,所需要的玻璃仪器:烧杯、___________ 、___________ 。
(2)向装置Ⅰ的饱和 溶液中通入足量的
溶液中通入足量的 和
和 ,应先通入足量
,应先通入足量___________ (填“ ”或“
”或“ ”)。装置Ⅰ中发生反应的化学方程式为
”)。装置Ⅰ中发生反应的化学方程式为___________ 。
(3)检验装置Ⅱ中制备的纯碱含有 的方法:取少量该纯碱样品溶于水,
的方法:取少量该纯碱样品溶于水,___________ 。
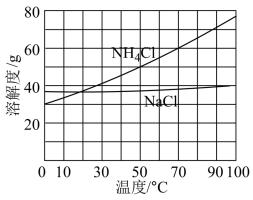
(4)向母液中加入一定量 粉末,存在
粉末,存在 。为使
。为使 晶体充分析出并分离,根据下图中
晶体充分析出并分离,根据下图中 和
和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为___________ 、___________ 、过滤、洗涤、干燥。
(5)整个实验流程中,可循环利用的物质的化学式是___________ 。
(6)若装置Ⅱ中得到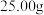 的碳酸钠和碳酸氢钠的固体混合物,加热至混合物质量不再变化,固体质量共减少了
的碳酸钠和碳酸氢钠的固体混合物,加热至混合物质量不再变化,固体质量共减少了 ,则原混合物中碳酸钠的质量分数为
,则原混合物中碳酸钠的质量分数为___________ 。
 ,进一步处理得到产品
,进一步处理得到产品 和
和 ,实验流程如下所示。
,实验流程如下所示。
请回答下列问题:
(1)上述流程中,①②③所涉及的操作方法,包含过滤的是
(2)向装置Ⅰ的饱和
 溶液中通入足量的
溶液中通入足量的 和
和 ,应先通入足量
,应先通入足量 ”或“
”或“ ”)。装置Ⅰ中发生反应的化学方程式为
”)。装置Ⅰ中发生反应的化学方程式为(3)检验装置Ⅱ中制备的纯碱含有
 的方法:取少量该纯碱样品溶于水,
的方法:取少量该纯碱样品溶于水,(4)向母液中加入一定量
 粉末,存在
粉末,存在 。为使
。为使 晶体充分析出并分离,根据下图中
晶体充分析出并分离,根据下图中 和
和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为
(5)整个实验流程中,可循环利用的物质的化学式是
(6)若装置Ⅱ中得到
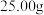 的碳酸钠和碳酸氢钠的固体混合物,加热至混合物质量不再变化,固体质量共减少了
的碳酸钠和碳酸氢钠的固体混合物,加热至混合物质量不再变化,固体质量共减少了 ,则原混合物中碳酸钠的质量分数为
,则原混合物中碳酸钠的质量分数为
您最近一年使用:0次
名校
解题方法
6 . 钛、锌、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。铁的基态原子价电子排布式为_______ 。
(2)黄铜是人类最早使用的合金之一,主要由 和
和 组成。第一电离能I1(Zn)
组成。第一电离能I1(Zn) _______ I1(Cu) (填“大于”或“小于”)。原因是_______ 。
(3)《中华本草》等中医典籍中,记载了炉甘石( )入药,可用于治疗皮肤炎症或表面创伤。
)入药,可用于治疗皮肤炎症或表面创伤。 中,阴离子空间构型为
中,阴离子空间构型为_______ , 原子的杂化形式为
原子的杂化形式为_______ 。
(4) 与酚类物质的显色反应常用于其离子检验,已知
与酚类物质的显色反应常用于其离子检验,已知 遇邻苯二酚(
遇邻苯二酚(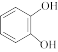 )和对苯二酚(
)和对苯二酚( )均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是
)均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是_______ ;已知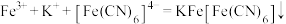 ,利用该离子方程式可以检验溶液中的
,利用该离子方程式可以检验溶液中的 。
。 中
中 键、
键、 键数目之比为
键数目之比为_______ 。
(5) 和
和 的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
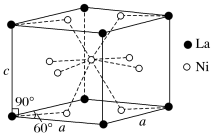
①该晶体的化学式为_______ 。
②已知该晶胞的摩尔质量为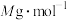 ,密度为
,密度为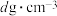 。设
。设 为阿伏加德罗常数的值,则该晶胞的边长是
为阿伏加德罗常数的值,则该晶胞的边长是_______  (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。铁的基态原子价电子排布式为
(2)黄铜是人类最早使用的合金之一,主要由
 和
和 组成。第一电离能I1(Zn)
组成。第一电离能I1(Zn) (3)《中华本草》等中医典籍中,记载了炉甘石(
 )入药,可用于治疗皮肤炎症或表面创伤。
)入药,可用于治疗皮肤炎症或表面创伤。 中,阴离子空间构型为
中,阴离子空间构型为 原子的杂化形式为
原子的杂化形式为(4)
 与酚类物质的显色反应常用于其离子检验,已知
与酚类物质的显色反应常用于其离子检验,已知 遇邻苯二酚(
遇邻苯二酚( )和对苯二酚(
)和对苯二酚( )均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是
)均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是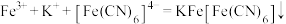 ,利用该离子方程式可以检验溶液中的
,利用该离子方程式可以检验溶液中的 。
。 中
中 键、
键、 键数目之比为
键数目之比为(5)
 和
和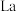 的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
①该晶体的化学式为
②已知该晶胞的摩尔质量为
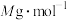 ,密度为
,密度为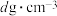 。设
。设 为阿伏加德罗常数的值,则该晶胞的边长是
为阿伏加德罗常数的值,则该晶胞的边长是 (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2022-05-31更新
|
360次组卷
|
2卷引用:广西河池市八校2021-2022学年高二下学期第二次联考化学试题
7 . 钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及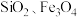 。采用以下工艺流程可由黏土矿制备
。采用以下工艺流程可由黏土矿制备 。
。
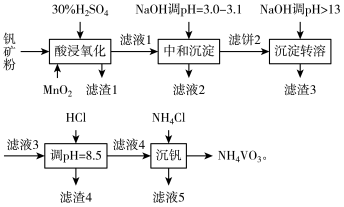
该工艺条件下,溶液中金属离子开始和完全沉淀的pH值如下表所示:
回答下列问题:
(1)“酸浸氧化”时需要加热,其目的是___________ 。
(2)“酸浸氧化”中,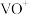 和
和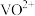 均被氧化成
均被氧化成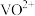 ,同时还有
,同时还有___________ 离子被氧化。写出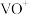 被氧化成
被氧化成 反应的离子方程式
反应的离子方程式___________ 。
(3)“中和沉淀”中,钒水解并沉淀为 。随滤液2可除去金属离子
。随滤液2可除去金属离子 和
和___________ ,以及部分的___________ 。
(4)“沉淀转溶”中, 转化为钒酸盐溶解。滤渣3的主要成分是
转化为钒酸盐溶解。滤渣3的主要成分是___________ 。
(5)用HCl“调 ”时有沉淀生成,生成该滤渣4反应的化学方程式为
”时有沉淀生成,生成该滤渣4反应的化学方程式为___________ 。
(6)“沉钒”反应的离子方程式为___________ 。
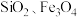 。采用以下工艺流程可由黏土矿制备
。采用以下工艺流程可由黏土矿制备 。
。
该工艺条件下,溶液中金属离子开始和完全沉淀的pH值如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH值 | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀的pH值 | 3.2 | 9.0 | 4.7 | 10.1 |
回答下列问题:
(1)“酸浸氧化”时需要加热,其目的是
(2)“酸浸氧化”中,
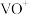 和
和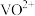 均被氧化成
均被氧化成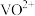 ,同时还有
,同时还有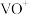 被氧化成
被氧化成 反应的离子方程式
反应的离子方程式(3)“中和沉淀”中,钒水解并沉淀为
 。随滤液2可除去金属离子
。随滤液2可除去金属离子 和
和(4)“沉淀转溶”中,
 转化为钒酸盐溶解。滤渣3的主要成分是
转化为钒酸盐溶解。滤渣3的主要成分是(5)用HCl“调
 ”时有沉淀生成,生成该滤渣4反应的化学方程式为
”时有沉淀生成,生成该滤渣4反应的化学方程式为(6)“沉钒”反应的离子方程式为
您最近一年使用:0次
8 . 工业上以粗盐(含 、
、 杂质)为原料生产
杂质)为原料生产 ,工艺流程如图所示:
,工艺流程如图所示:

(1)向粗盐水加入 的目的是
的目的是_______ ,滤渣A为_______ (写化学式),加入 和
和 的顺序
的顺序_______ (填“能”或“不能”)互换。
(2)先通入 再通入
再通入 的目的是
的目的是_______ 。
(3)“碳酸化”时没有 晶体析出,原因是
晶体析出,原因是_______ 。
(4)滤液B中溶质的主要成分是_______ (写化学式),该物质在农业上的用途是_______ 。
(5)“煅烧”发生的化学反应方程式为_______ 。
(6)得到的 产品中常含有
产品中常含有 ,可用加热分解的方法测定产品中
,可用加热分解的方法测定产品中 的质量分数。若取a g产品,充分加热后固体的质量变为b g,
的质量分数。若取a g产品,充分加热后固体的质量变为b g, 在产品中的质量分数为
在产品中的质量分数为_______ 。(列出计算式)。
 、
、 杂质)为原料生产
杂质)为原料生产 ,工艺流程如图所示:
,工艺流程如图所示:
(1)向粗盐水加入
 的目的是
的目的是 和
和 的顺序
的顺序(2)先通入
 再通入
再通入 的目的是
的目的是(3)“碳酸化”时没有
 晶体析出,原因是
晶体析出,原因是(4)滤液B中溶质的主要成分是
(5)“煅烧”发生的化学反应方程式为
(6)得到的
 产品中常含有
产品中常含有 ,可用加热分解的方法测定产品中
,可用加热分解的方法测定产品中 的质量分数。若取a g产品,充分加热后固体的质量变为b g,
的质量分数。若取a g产品,充分加热后固体的质量变为b g, 在产品中的质量分数为
在产品中的质量分数为
您最近一年使用:0次
解题方法
9 . 钴元素的用途广泛,据古文献记载:宜德时期青花瓷使用的颜料“苏勃泥青"是从一种进口钴毒矿[主要成分:(FeCo)xAsS]中提取出来的。
(1)Co的价电子排布式为_______
(2)无水CoCl2的熔点是735°C ,沸点1049°C ,CoCl2属于_______ 晶体;砷酸(H3AsO4)分子中As原子的杂化方式为_______ 杂化;砷酸根离子的空间构型为_______ ;第一电离能I1(As)_______ I1(Se)(填“大于”或“小于")。
(3)[Co(NH3)4(H2O)2]Cl3是一种特殊的配合物,其中心离子的配位数是_______ ,每个[Co(NH3)4(H2O)2]3+所含共价键的数目是_______ ,配体NH3的熔沸点大于同族元素氢化物AsH3的原因是_______ 。
(4)钴氰化钾K3[Co(CN)6]是一种浅黄色单斜棱晶体,与配体CN-原子总数相等的等电子体是_______ 。
(5)金属钴晶体的晶胞结构如图所示,其中正六边形的面积为apm2,棱长为bpm;每个Co距离最近且相等的Co原子数目为_______ ; 设阿伏加德罗常数的值为NA,则该晶体的密度为_______ (用含a、b、NA的代数式表示) g·cm-3。

(1)Co的价电子排布式为
(2)无水CoCl2的熔点是735°C ,沸点1049°C ,CoCl2属于
(3)[Co(NH3)4(H2O)2]Cl3是一种特殊的配合物,其中心离子的配位数是
(4)钴氰化钾K3[Co(CN)6]是一种浅黄色单斜棱晶体,与配体CN-原子总数相等的等电子体是
(5)金属钴晶体的晶胞结构如图所示,其中正六边形的面积为apm2,棱长为bpm;每个Co距离最近且相等的Co原子数目为

您最近一年使用:0次
10 . 水合肼是一种重要的精细化工原料,纯品为无色透明的油状液体,在高温下分解,水合肼具有还原性,在农药、医药及有机合成中有广泛用途。
用尿素法制备水合肼,反应方程式为:CO(NH2)2+NaClO+2NaOH=N2H4•H2O+NaCl+Na2CO3
实验步骤:
步骤1.向30%的NaOH溶液中通入Cl2,保持温度在30℃以下,至溶液显浅黄绿色停止通Cl2,静置,检测NaClO的浓度后,倾出上层清液,配制所需浓度的NaClO和NaOH的混合溶液。
步骤2.称取一定质量尿素配成溶液,置于冰水浴.将一定体积步骤1配得的溶液倒入分液漏斗中,慢慢滴加到尿素溶液中(如图),0.5h左右滴完。
步骤3.在三口烧瓶(见图)中加入5g KMnO4作催化剂,急速升温,在108℃回流5min,制取粗产品。

(1)配制30%的NaOH溶液需要的玻璃仪器有___________ 、__________ 和烧杯。
(2)用如图装置制取NaClO。

①Ⅱ中的导管a的作用是___________ 。
②已知3NaClO 2NaCl+NaClO3,Ⅱ中用冰水浴控制温度在30℃以下,其主要目的是
2NaCl+NaClO3,Ⅱ中用冰水浴控制温度在30℃以下,其主要目的是________ 。
③氯气中含有氯化氢,能降低NaClO产率,除去杂质气体的试剂是__________ 。
(3)步骤2中若将尿素滴加到NaClO中,降低水合肼的产率,原因是________ (用化学方程式表示)。
(4)步骤1中检测NaClO浓度的目的是__________ 。
(5)N2H4有较强的还原性,在银的提取过程中有重要的应用,N2H4可以直接还原AgCl得到银单质,反应的化学方程式是____________ 。
用尿素法制备水合肼,反应方程式为:CO(NH2)2+NaClO+2NaOH=N2H4•H2O+NaCl+Na2CO3
实验步骤:
步骤1.向30%的NaOH溶液中通入Cl2,保持温度在30℃以下,至溶液显浅黄绿色停止通Cl2,静置,检测NaClO的浓度后,倾出上层清液,配制所需浓度的NaClO和NaOH的混合溶液。
步骤2.称取一定质量尿素配成溶液,置于冰水浴.将一定体积步骤1配得的溶液倒入分液漏斗中,慢慢滴加到尿素溶液中(如图),0.5h左右滴完。
步骤3.在三口烧瓶(见图)中加入5g KMnO4作催化剂,急速升温,在108℃回流5min,制取粗产品。

(1)配制30%的NaOH溶液需要的玻璃仪器有
(2)用如图装置制取NaClO。

①Ⅱ中的导管a的作用是
②已知3NaClO
 2NaCl+NaClO3,Ⅱ中用冰水浴控制温度在30℃以下,其主要目的是
2NaCl+NaClO3,Ⅱ中用冰水浴控制温度在30℃以下,其主要目的是③氯气中含有氯化氢,能降低NaClO产率,除去杂质气体的试剂是
(3)步骤2中若将尿素滴加到NaClO中,降低水合肼的产率,原因是
(4)步骤1中检测NaClO浓度的目的是
(5)N2H4有较强的还原性,在银的提取过程中有重要的应用,N2H4可以直接还原AgCl得到银单质,反应的化学方程式是
您最近一年使用:0次



