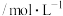1 . X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少的、构成蛋白质的重要组成元素;Z的基态原子核外9个原子轨道上填充了电子且有2个未成对电子,与X不同族;W是一种常见元素,可以形成一种具有磁性的黑色晶体氧化物。
(1)写出下列元素的名称:X__________ ,Y__________ ,Z__________ 。
(2)X—H和Y—H属于极性共价键,其中极性较强的是________ (X、Y用元素符号表示)。X的第一电离能比Y的________ (填“大”或“小”)。
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:_______________ 。
(4)W的基态原子的价层电子排布式为_________________ 。
(5)Y元素的核外电子轨道表达式为________________ 。
(1)写出下列元素的名称:X
(2)X—H和Y—H属于极性共价键,其中极性较强的是
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:
(4)W的基态原子的价层电子排布式为
(5)Y元素的核外电子轨道表达式为
您最近一年使用:0次
解题方法
2 . 物质结构决定物质性质。下列性质差异与结构因素匹配错误 的是
| 性质差异 | 结构因素 | |
| A | 溶解度: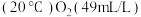 大于 大于 | 分子间作用力 |
| B | 键角: | 杂化类型 |
| C | 酸性: 远强于 远强于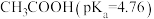 | 羟基极性 |
| D | 气态氢化物稳定性:HF强于HCl | 氢键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
3 . 化学与生活密切相关。下列说法错误的是
| A.可以用氢氧化钠溶液鉴别地沟油和矿物油 |
| B.糯米酿制甜酒的过程中,淀粉最终转化成乙醇和二氧化碳 |
C. 是有毒物质,所有食品中禁止添加 是有毒物质,所有食品中禁止添加 |
| D.为加快漂白精的漂白速率,使用时可滴加几滴食醋 |
您最近一年使用:0次
名校
4 . 四种短周期元素X、Y、Z和W在周期表中的位置如下图所示,Z的原子序数是Y的2倍。下列说法正确的是
| X | Y | ||
| Z | W |
A.原子半径: |
| B.X只能形成一种含氧酸 |
| C.Y、Z、W元素在自然界中均不能以游离态存在 |
| D.X、Z、W分别能与Y形成共价化合物 |
您最近一年使用:0次
2024-05-29更新
|
184次组卷
|
2卷引用:2024届四川省雅安市高三下学期三诊理综试题-高中化学
名校
解题方法
5 . 化学与生产、生活密切相关,下列说法错误的是
| A.“化干戈为玉帛”中的“帛”的主要成分是纤维素,一定条件下可以水解生成单糖 |
| B.“神舟十七号”宇宙飞船返回舱所用高温结构陶瓷,属于新型无机非金属材料 |
C.用 人工合成淀粉,可减少碳排放,有利于促进“碳中和” 人工合成淀粉,可减少碳排放,有利于促进“碳中和” |
| D.铝粉与氧化铁发生的铝热反应可用于焊接铁轨 |
您最近一年使用:0次
2024-05-21更新
|
239次组卷
|
6卷引用:四川省雅安市2023-2024学年高三下学期5月联考理综试题-高中化学
解题方法
6 . 磷酸铁锂电池是以磷酸铁锂( )为正极材料的一种锂离子二次电池。一种由钛白副产物硫酸亚铁[主要成分为
)为正极材料的一种锂离子二次电池。一种由钛白副产物硫酸亚铁[主要成分为 ,还含有少量
,还含有少量 、
、 、
、 ]制备锂离子电池正极材料的前驱体
]制备锂离子电池正极材料的前驱体 的工艺流程如图所示:
的工艺流程如图所示: ,有关微粒浓度如下表所示:
,有关微粒浓度如下表所示:
②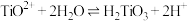 ,
, 时,
时, 沉淀完全。
沉淀完全。
③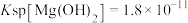
(1)为加快“酸溶”速率,可采取的措施有________ (写两点)。
(2)“除杂过滤”工序中,将 转化为
转化为 除去。加入铁粉的作用是
除去。加入铁粉的作用是______________ 。
(3)当 沉淀完全时,“滤渣”中是否含有
沉淀完全时,“滤渣”中是否含有 ?结合计算说明原因(忽略溶液体积的变化)
?结合计算说明原因(忽略溶液体积的变化)_______________ 。
(4)“结晶过滤”后从滤液中获得 的操作为
的操作为________ ,过滤。
(5)书写“氧化”时发生反应的离子方程式______________ 。
(6)工业上可以用电解磷铁渣(主要含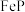 )的方法制备
)的方法制备 ,电解原理如图所示,溶液中的
,电解原理如图所示,溶液中的 向
向________ 极移动(填“石墨”或“磷铁渣”);生成 的电极反应式为
的电极反应式为______________ 。
 )为正极材料的一种锂离子二次电池。一种由钛白副产物硫酸亚铁[主要成分为
)为正极材料的一种锂离子二次电池。一种由钛白副产物硫酸亚铁[主要成分为 ,还含有少量
,还含有少量 、
、 、
、 ]制备锂离子电池正极材料的前驱体
]制备锂离子电池正极材料的前驱体 的工艺流程如图所示:
的工艺流程如图所示: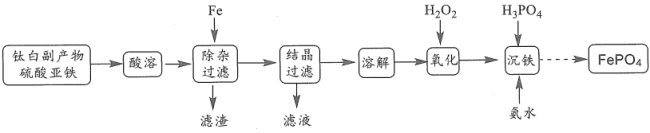
 ,有关微粒浓度如下表所示:
,有关微粒浓度如下表所示:微粒 |
|
|
浓度 | 0.0043 | 0.07 |
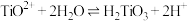 ,
, 时,
时, 沉淀完全。
沉淀完全。③
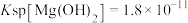
(1)为加快“酸溶”速率,可采取的措施有
(2)“除杂过滤”工序中,将
 转化为
转化为 除去。加入铁粉的作用是
除去。加入铁粉的作用是(3)当
 沉淀完全时,“滤渣”中是否含有
沉淀完全时,“滤渣”中是否含有 ?结合计算说明原因(忽略溶液体积的变化)
?结合计算说明原因(忽略溶液体积的变化)(4)“结晶过滤”后从滤液中获得
 的操作为
的操作为(5)书写“氧化”时发生反应的离子方程式
(6)工业上可以用电解磷铁渣(主要含
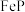 )的方法制备
)的方法制备 ,电解原理如图所示,溶液中的
,电解原理如图所示,溶液中的 向
向 的电极反应式为
的电极反应式为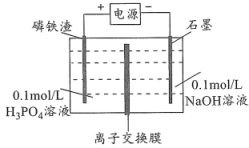
您最近一年使用:0次
7 . 下列实验操作或现象可以达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 探究次氯酸钠溶液的酸碱性 | 用pH试纸测溶液的pH值 |
B | 证明 和 和 之间是可逆反应 之间是可逆反应 | 向   溶液中滴加 溶液中滴加  的 的 溶液,充分反应后,滴加几滴 溶液,充分反应后,滴加几滴 溶液后变为红色 溶液后变为红色 |
C | 证明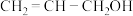 中含有碳碳双键 中含有碳碳双键 | 向酸性 溶液中加入 溶液中加入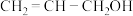 |
D | 除去 溶液中混有的 溶液中混有的 | 加入过量铁粉,充分反应后,过滤 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
8 . 化学与生活息息相关。下列说法正确的是
| A.用水煤气可合成液态烃和含氧有机物 |
| B.食品加工过程中不能添加任何防腐剂 |
| C.聚氯乙烯通过加聚反应制得,可用于制作不粘锅的耐热涂层 |
D.指南针由天然磁石制成,磁石的主要成分是 |
您最近一年使用:0次
9 . 二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)某小组通过查阅资料发现可以使用SO2和NaClO3反应的方法制备ClO2。写出该过程的离子方程式:______________ 。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。______ ,装置B中的试剂X为______ 。
②D装置通入氮气的主要作用有2个,一是可以起到搅拌作用,二是__________ 。
③装置D用于生成ClO2气体,该反应的化学方程式为___________ 。
(3)ClO2气体具有强氧化性,其还原产物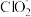 、Cl-的转化率与pH关系如图所示。ClO2对污水中S2-、CN-等也有明显的去除效果,请写出pH≥7时,ClO2与S2-反应的离子方程式
、Cl-的转化率与pH关系如图所示。ClO2对污水中S2-、CN-等也有明显的去除效果,请写出pH≥7时,ClO2与S2-反应的离子方程式_______ 。 =2I-+
=2I-+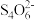 ),当看到
),当看到____________ 现象时,测得标准液消耗的体积为20.00mL,通过计算可知D中ClO2溶液的浓度为_____ 。
(1)某小组通过查阅资料发现可以使用SO2和NaClO3反应的方法制备ClO2。写出该过程的离子方程式:
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。
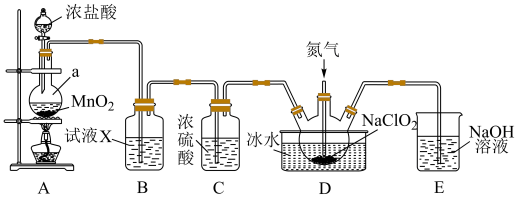
②D装置通入氮气的主要作用有2个,一是可以起到搅拌作用,二是
③装置D用于生成ClO2气体,该反应的化学方程式为
(3)ClO2气体具有强氧化性,其还原产物
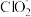 、Cl-的转化率与pH关系如图所示。ClO2对污水中S2-、CN-等也有明显的去除效果,请写出pH≥7时,ClO2与S2-反应的离子方程式
、Cl-的转化率与pH关系如图所示。ClO2对污水中S2-、CN-等也有明显的去除效果,请写出pH≥7时,ClO2与S2-反应的离子方程式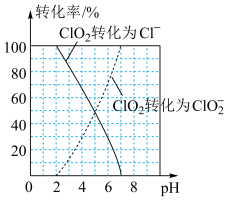
 =2I-+
=2I-+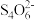 ),当看到
),当看到
您最近一年使用:0次
解题方法
10 . 甲醇来源丰富、价格低廉,是一种重要的化工原料,有着重要的用途和应用前景。
2CO(g)+O2(g)=2CO2(g) △H = -570 kJ/mol
(1)计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H =_______ 。
(2)若在绝热恒容 的容器内进行反应2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g),初始加入2mol CH3OH和3mol O2下列不能 表示该反应达到平衡状态的有__________ (填字母序号)。
A.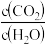 保持不变 B.容器中混合气体的密度不变化
保持不变 B.容器中混合气体的密度不变化
C.2v正(H2O)=v逆(CO2) D.容器中混合气体的压强不变化
E. 平均相对分子量保持不变 F. K值保持不变_______ ,初始压强为P,该反应的压强平衡常数Kp=______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)若再次向容器中充入0.5mol H2和0.5mol CO,则此时该反应v(正)_____ v(逆)(填“>”、“<”或“=”);
(5)某实验小组设计了甲醇以氢氧化钾为电解质溶液的燃料电池装置。该电池负极反应的离子方程式为______ 。
Ⅰ.工业生产甲醇的常用方法是:CO(g)+2H2(g)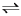 CH3OH(g) △H = -91 kJ/mol。
CH3OH(g) △H = -91 kJ/mol。
2CO(g)+O2(g)=2CO2(g) △H = -570 kJ/mol
(1)计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H =
(2)若在
A.
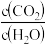 保持不变 B.容器中混合气体的密度不变化
保持不变 B.容器中混合气体的密度不变化C.2v正(H2O)=v逆(CO2) D.容器中混合气体的压强不变化
E. 平均相对分子量保持不变 F. K值保持不变
Ⅱ.制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g)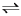 H2(g)+ CO2(g) △H<0,某温度下该反应,若起始时向2L容器中充入1 mol CO和1 mol H2O,5min达到平衡时,CO的转化率为60%,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应,若起始时向2L容器中充入1 mol CO和1 mol H2O,5min达到平衡时,CO的转化率为60%,试回答下列问题:
(4)若再次向容器中充入0.5mol H2和0.5mol CO,则此时该反应v(正)
(5)某实验小组设计了甲醇以氢氧化钾为电解质溶液的燃料电池装置。该电池负极反应的离子方程式为
您最近一年使用:0次