解题方法
1 . 钛是一种银白色过渡金属,在高科技社会中得到了广泛的应用。可以从钛铁矿( )中提取
)中提取 ,并常用Na置换熔融
,并常用Na置换熔融 来获得单质Ti。
来获得单质Ti。
(1)基态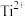 的价电子排布式为
的价电子排布式为___________ ,其核外能量最高的电子所在的能层符号为___________ ,其核外共有___________ 种运动状态不同的电子。
(2)Ti的配合物有多种。在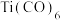 、
、 和
和 三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是
三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是___________ (填写元素名称), 中
中
___________ (填“大于”、“小于”或“等于”)单个水分子中 ,原因是
,原因是___________ 。
(3) 的球棍结构如图,Ti的配位数是
的球棍结构如图,Ti的配位数是___________ ,N原子的杂化方式为___________ ,与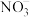 互为等电子体的分子为
互为等电子体的分子为___________ (写分子式)。 和
和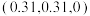 ,则微粒3的原子分数坐标为
,则微粒3的原子分数坐标为___________ ;若阿伏加德罗常数的值为 ,金红石的密度为
,金红石的密度为___________  (列出计算表达式)。
(列出计算表达式)。
 )中提取
)中提取 ,并常用Na置换熔融
,并常用Na置换熔融 来获得单质Ti。
来获得单质Ti。(1)基态
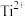 的价电子排布式为
的价电子排布式为(2)Ti的配合物有多种。在
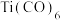 、
、 和
和 三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是
三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是 中
中
 ,原因是
,原因是(3)
 的球棍结构如图,Ti的配位数是
的球棍结构如图,Ti的配位数是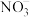 互为等电子体的分子为
互为等电子体的分子为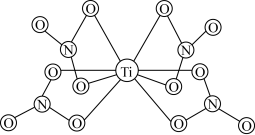
 和
和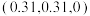 ,则微粒3的原子分数坐标为
,则微粒3的原子分数坐标为 ,金红石的密度为
,金红石的密度为 (列出计算表达式)。
(列出计算表达式)。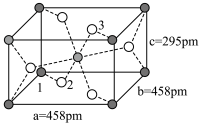
您最近一年使用:0次
解题方法
2 . 硫酸四氨合铜(Ⅱ)晶体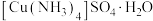 为深蓝色,易溶于水,不溶于乙醇等有机溶剂,加热时易失氨。某研究小组拟用粗
为深蓝色,易溶于水,不溶于乙醇等有机溶剂,加热时易失氨。某研究小组拟用粗 (含少量
(含少量 )合成硫酸四氨合铜晶体并测定其纯度。
)合成硫酸四氨合铜晶体并测定其纯度。
I.硫酸四氨合铜(Ⅱ)晶体制备与提纯
步骤①:称取 粗
粗 倒入烧杯中,加入适量稀硫酸溶解,将溶液加热至沸腾,边搅拌边逐滴加入
倒入烧杯中,加入适量稀硫酸溶解,将溶液加热至沸腾,边搅拌边逐滴加入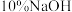 溶液至pH为3.5,继续加热溶液片刻,趁热过滤,得到
溶液至pH为3.5,继续加热溶液片刻,趁热过滤,得到 溶液。
溶液。
步骤②:___________ ,调pH为3.5的目的是___________ 。
(2)写出操作①中发生的离子反应方程式___________ 。
(3)操作③中洗涤步骤中可选用的洗涤液是___________ 。
A.乙醇与乙醚的混合液 B.蒸馏水 C.饱和硫酸钠溶液
(4)某同学认为操作②也可以通过蒸发浓缩、冷却结晶获得所要晶体,你___________ (填“是”或“否”)同意他的观点,并说明理由___________ 。
Ⅱ.硫酸四氨合铜(Ⅱ)晶体纯度测定
步骤①:准确称取 固体于烧杯中,加稀硫酸溶解,配制为
固体于烧杯中,加稀硫酸溶解,配制为 的溶液。
的溶液。
步骤②:量取上述试液 于锥形瓶中,加入
于锥形瓶中,加入 水和KI固体(稍过量)
水和KI固体(稍过量)
步骤③:用 标准溶液(
标准溶液( )滴定至溶液呈淡黄色,加入淀粉溶液
)滴定至溶液呈淡黄色,加入淀粉溶液 ,溶液变为蓝色,再加入
,溶液变为蓝色,再加入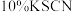 溶液
溶液 ,继续用
,继续用 标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为
标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为 。
。
已知:①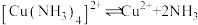 ,
,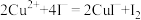 ,
, 沉淀表面易吸附
沉淀表面易吸附 。
。
② 比
比 更难溶。③
更难溶。③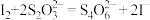 。
。
(5)硫酸四氨合铜晶体纯度是___________ (写出用m、V表示的计算表达式。)。
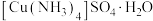 为深蓝色,易溶于水,不溶于乙醇等有机溶剂,加热时易失氨。某研究小组拟用粗
为深蓝色,易溶于水,不溶于乙醇等有机溶剂,加热时易失氨。某研究小组拟用粗 (含少量
(含少量 )合成硫酸四氨合铜晶体并测定其纯度。
)合成硫酸四氨合铜晶体并测定其纯度。I.硫酸四氨合铜(Ⅱ)晶体制备与提纯
步骤①:称取
 粗
粗 倒入烧杯中,加入适量稀硫酸溶解,将溶液加热至沸腾,边搅拌边逐滴加入
倒入烧杯中,加入适量稀硫酸溶解,将溶液加热至沸腾,边搅拌边逐滴加入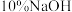 溶液至pH为3.5,继续加热溶液片刻,趁热过滤,得到
溶液至pH为3.5,继续加热溶液片刻,趁热过滤,得到 溶液。
溶液。步骤②:

(2)写出操作①中发生的离子反应方程式
(3)操作③中洗涤步骤中可选用的洗涤液是
A.乙醇与乙醚的混合液 B.蒸馏水 C.饱和硫酸钠溶液
(4)某同学认为操作②也可以通过蒸发浓缩、冷却结晶获得所要晶体,你
Ⅱ.硫酸四氨合铜(Ⅱ)晶体纯度测定
步骤①:准确称取
 固体于烧杯中,加稀硫酸溶解,配制为
固体于烧杯中,加稀硫酸溶解,配制为 的溶液。
的溶液。步骤②:量取上述试液
 于锥形瓶中,加入
于锥形瓶中,加入 水和KI固体(稍过量)
水和KI固体(稍过量)步骤③:用
 标准溶液(
标准溶液( )滴定至溶液呈淡黄色,加入淀粉溶液
)滴定至溶液呈淡黄色,加入淀粉溶液 ,溶液变为蓝色,再加入
,溶液变为蓝色,再加入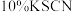 溶液
溶液 ,继续用
,继续用 标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为
标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为 。
。已知:①
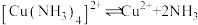 ,
,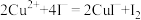 ,
, 沉淀表面易吸附
沉淀表面易吸附 。
。②
 比
比 更难溶。③
更难溶。③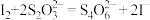 。
。(5)硫酸四氨合铜晶体纯度是
您最近一年使用:0次
解题方法
3 . 布洛芬是常用的解热镇痛药,其结构简式如下图所示,下列有关说法正确的是
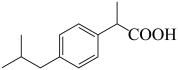
A.布洛芬的分子式为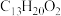 | B.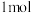 布洛芬可与 布洛芬可与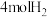 发生加成反应 发生加成反应 |
| C.所有原子可能共平面 | D.苯环上的一氯代物有两种 |
您最近一年使用:0次
解题方法
4 . 电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。常温下,利用盐酸滴定某溶液中碳酸钠的含量,其电位滴定曲线与pH曲线如图所示。(已知碳酸的电离常数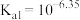 ,
,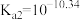 )下列说法正确的是
)下列说法正确的是
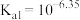 ,
,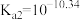 )下列说法正确的是
)下列说法正确的是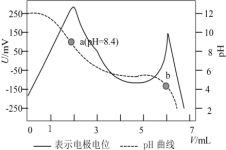
| A.该滴定过程需要两种指示剂 |
B.b点溶液中存在: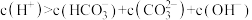 |
C.水的电离程度:a点 b点 b点 |
D.a点溶液中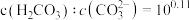 |
您最近一年使用:0次
5 . 利用钛铁矿(主要成分为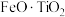 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备磷酸铁和锂离子电池正极材料(
等杂质)制备磷酸铁和锂离子电池正极材料( )的部分工业流程如图所示:
)的部分工业流程如图所示: (
(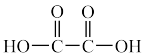 )、
)、 ,中C原子的杂化方式依次为
,中C原子的杂化方式依次为___________ 、___________ 。
(2) 、
、 的熔、沸点:
的熔、沸点: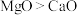 ,原因为
,原因为___________ 。
(3)已知 的配合物有多种,如
的配合物有多种,如 、
、 (
( )等。
)等。
① 的VSEPR模型名称为
的VSEPR模型名称为___________ 。
②从原子结构角度预测 具有较强的还原性,原因为
具有较强的还原性,原因为___________ 。
③配合物 (
( )与游离的
)与游离的 分子相比,配合物中的
分子相比,配合物中的 键角
键角___________ (填“>”“<”或“=”) 中的,原因是
中的,原因是___________ 。
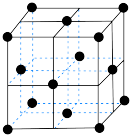
(4)在一定条件下铁形成的晶体的基本结构单元如图所示,设铁原子的半径为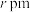 ,则
,则 原子的配位数为
原子的配位数为___________ ,该晶体的密度为___________ (列出计算式) 。
。
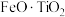 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备磷酸铁和锂离子电池正极材料(
等杂质)制备磷酸铁和锂离子电池正极材料( )的部分工业流程如图所示:
)的部分工业流程如图所示: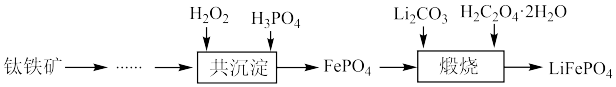
 (
(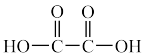 )、
)、 ,中C原子的杂化方式依次为
,中C原子的杂化方式依次为(2)
 、
、 的熔、沸点:
的熔、沸点: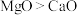 ,原因为
,原因为(3)已知
 的配合物有多种,如
的配合物有多种,如 、
、 (
( )等。
)等。①
 的VSEPR模型名称为
的VSEPR模型名称为②从原子结构角度预测
 具有较强的还原性,原因为
具有较强的还原性,原因为③配合物
 (
( )与游离的
)与游离的 分子相比,配合物中的
分子相比,配合物中的 键角
键角 中的,原因是
中的,原因是(4)在一定条件下铁形成的晶体的基本结构单元如图所示,设铁原子的半径为
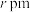 ,则
,则 原子的配位数为
原子的配位数为 。
。
您最近一年使用:0次
2024-05-24更新
|
111次组卷
|
4卷引用:四川省雅安市2023-2024学年高三下学期5月联考理综试题-高中化学
名校
解题方法
6 . 25℃时,一水合二甲胺[ ]的
]的 ,叠氮酸(
,叠氮酸( )的
)的 (K为电离常数)。0.1
(K为电离常数)。0.1 的
的 溶液中,
溶液中, 、
、 、
、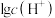 、
、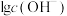 随pOH变化(加入盐酸或NaOH溶液)的关系如图所示。下列说法错误的是
随pOH变化(加入盐酸或NaOH溶液)的关系如图所示。下列说法错误的是
 ]的
]的 ,叠氮酸(
,叠氮酸( )的
)的 (K为电离常数)。0.1
(K为电离常数)。0.1 的
的 溶液中,
溶液中, 、
、 、
、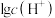 、
、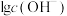 随pOH变化(加入盐酸或NaOH溶液)的关系如图所示。下列说法错误的是
随pOH变化(加入盐酸或NaOH溶液)的关系如图所示。下列说法错误的是
| A.图中P点对应溶液的pH=7.5 |
B.曲线d、c分别代表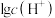 、 、 随pOH的变化 随pOH的变化 |
C.原溶液中 |
D.原溶液中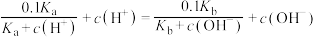 |
您最近一年使用:0次
2024-05-19更新
|
53次组卷
|
4卷引用:四川省雅安市2023-2024学年高三下学期5月联考理综试题-高中化学
7 . 实验是探究物质性质的重要方法,下列操作中,实验现象与得出的结论相一致的是
| 选项 | 实验目的 | 操作及现象 | 结论 |
| A | 比较HClO和CH3COOH的酸性强弱 | 用pH计测定NaClO和CH3COONa的pH值,测得pH(NaClO)>pH(CH3COONa) | 酸性:HClO>CH3COOH |
| B | 验证反应2Fe3++2I- 2Fe2++I2是可逆反应 2Fe2++I2是可逆反应 | 向2mL 0.1mol/L FeCl3溶液加入几滴0.1mol/L KI溶液,充分反应。取反应后试样,滴加淀粉溶液,溶液变为蓝色;另取反应后试样,加入KSCN溶液,溶液变成血红色 | 反应2Fe3++2I- 2Fe2++I2是可逆反应 2Fe2++I2是可逆反应 |
| C | 判断 (AgCl)与 (AgCl)与 (AgI)的大小 (AgI)的大小 | 向等浓度的NaCl、NaI的混合溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
| D | 判断某 溶液样品中是否含有 溶液样品中是否含有 | 向某 溶液样品中加入硫酸酸化的 溶液样品中加入硫酸酸化的 溶液,紫色褪去 溶液,紫色褪去 | 该样品中一定含有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 在反应N2(g)+3H2(g) 2NH3(g) △H<0中,既能使反应速率加快又能增大H2转化率的是
2NH3(g) △H<0中,既能使反应速率加快又能增大H2转化率的是
①增大压强 ②升高温度③及时液化移走NH3④通入N2 ⑤通入H2⑥加入催化剂
 2NH3(g) △H<0中,既能使反应速率加快又能增大H2转化率的是
2NH3(g) △H<0中,既能使反应速率加快又能增大H2转化率的是①增大压强 ②升高温度③及时液化移走NH3④通入N2 ⑤通入H2⑥加入催化剂
| A.①②③ | B.①②④ | C.①④ | D.①②⑥ |
您最近一年使用:0次
名校
解题方法
9 . 硒 是人体必需微量元素之一,含硒化合物在药物和材料等领域具有广泛的应用。乙烷硒啉是一种抗癌新药,其结构式如下图所示:
是人体必需微量元素之一,含硒化合物在药物和材料等领域具有广泛的应用。乙烷硒啉是一种抗癌新药,其结构式如下图所示:_______ 区。
(2) 与S同主族,则基态硒原子的核外电子排布式为
与S同主族,则基态硒原子的核外电子排布式为_______ 。
(3) 、O、N的第一电离能由大到小的顺序为
、O、N的第一电离能由大到小的顺序为_______ 。
(4)比较键角大小:气态 分子
分子_______  离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是_______ 。
(5)根据价层电子对互斥理论,可以推知 的空间构型为
的空间构型为_______ (用文字描述),其中 原子采用的轨道杂化方式为
原子采用的轨道杂化方式为_______ 。
(6)甲硒醇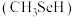 可增加抗癌效力,下表中有机物沸点不同的原因是
可增加抗癌效力,下表中有机物沸点不同的原因是_______ 。
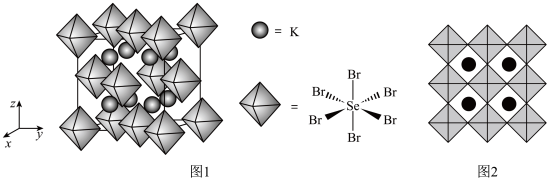
(7)化合物X是通过理论计算的方法筛选出的潜在热电材料之一,其晶胞结构如题图1,沿x、y、z轴方向的投影均为题图2。则X的化学式为_______ 。
 是人体必需微量元素之一,含硒化合物在药物和材料等领域具有广泛的应用。乙烷硒啉是一种抗癌新药,其结构式如下图所示:
是人体必需微量元素之一,含硒化合物在药物和材料等领域具有广泛的应用。乙烷硒啉是一种抗癌新药,其结构式如下图所示: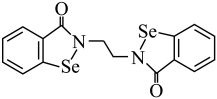
(2)
 与S同主族,则基态硒原子的核外电子排布式为
与S同主族,则基态硒原子的核外电子排布式为(3)
 、O、N的第一电离能由大到小的顺序为
、O、N的第一电离能由大到小的顺序为(4)比较键角大小:气态
 分子
分子 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是(5)根据价层电子对互斥理论,可以推知
 的空间构型为
的空间构型为 原子采用的轨道杂化方式为
原子采用的轨道杂化方式为(6)甲硒醇
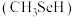 可增加抗癌效力,下表中有机物沸点不同的原因是
可增加抗癌效力,下表中有机物沸点不同的原因是| 有机物 | 甲醇 | 甲硫醇 | 甲硒醇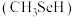 |
| 沸点/℃ | 64.7 | 5.95 | 25.05 |
(7)化合物X是通过理论计算的方法筛选出的潜在热电材料之一,其晶胞结构如题图1,沿x、y、z轴方向的投影均为题图2。则X的化学式为
您最近一年使用:0次
2024-04-19更新
|
300次组卷
|
3卷引用:四川省雅安市天全中学2024届高三下学期模拟预测化学试题5
23-24高一·全国·课堂例题
解题方法
10 . 中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。
Ⅰ.海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:_______ 中进行。
(2)操作Ⅰ中具体实验步骤:_______
(3)为寻找氯水的替代品,某同学设计了用 代替氯水。请写出此反应的离子方程式:
代替氯水。请写出此反应的离子方程式:_______ 。
Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其流程如图所示,试回答下列问题:_______ 。
(5)步骤Ⅱ中涉及的离子方程式如下,请在下面横线上填入适当的化学计量数_______ 。
_______ _______
_______ _______
_______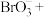 _______
_______ _______
_______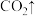
(6)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:_______ 。
Ⅲ.镁及其合金是一种用途很广的金属材料,目前60%的镁是从海水中提取的。主要步骤如下: 转化为
转化为 ,试剂①工业上选用
,试剂①工业上选用_______ (填化学式)。
(8)熔融状态的无水 通电后会产生Mg和
通电后会产生Mg和 ,试写出该反应的化学方程式:
,试写出该反应的化学方程式:_______ 。
Ⅰ.海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:

(2)操作Ⅰ中具体实验步骤:
(3)为寻找氯水的替代品,某同学设计了用
 代替氯水。请写出此反应的离子方程式:
代替氯水。请写出此反应的离子方程式:Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其流程如图所示,试回答下列问题:

(5)步骤Ⅱ中涉及的离子方程式如下,请在下面横线上填入适当的化学计量数
_______
 _______
_______ _______
_______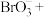 _______
_______ _______
_______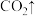
(6)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:
Ⅲ.镁及其合金是一种用途很广的金属材料,目前60%的镁是从海水中提取的。主要步骤如下:
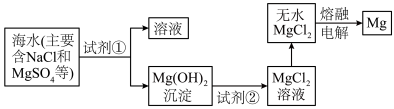
 转化为
转化为 ,试剂①工业上选用
,试剂①工业上选用(8)熔融状态的无水
 通电后会产生Mg和
通电后会产生Mg和 ,试写出该反应的化学方程式:
,试写出该反应的化学方程式:
您最近一年使用:0次



