真题
解题方法
1 . 丙烯腈( )是一种重要的化工原料。工业上以
)是一种重要的化工原料。工业上以 为载气,用
为载气,用 作催化剂生产
作催化剂生产 的流程如下:
的流程如下:
②反应釜Ⅰ中发生的反应:
ⅰ: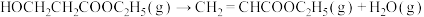

③反应釜Ⅱ中发生的反应:
ⅱ:

ⅲ: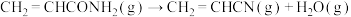

④在此生产条件下,酯类物质可能发生水解。
回答下列问题:
(1)总反应

_______ (用含 、
、 、和
、和 的代数式表示);
的代数式表示);
(2)进料混合气中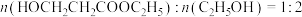 ,出料中四种物质(
,出料中四种物质( 、
、 、
、 、
、 )的流量,(单位时间内出料口流出的物质的量)随时间变化关系如图:
)的流量,(单位时间内出料口流出的物质的量)随时间变化关系如图: 的曲线是
的曲线是_______ (填“a”“b”或“c”);
②反应釜Ⅰ中加入 的作用是
的作用是_______ 。
③出料中没有检测到 的原因是
的原因是_______ 。
④反应 后,a、b、c曲线对应物质的流量逐渐降低的原因是
后,a、b、c曲线对应物质的流量逐渐降低的原因是_______ 。
(3)催化剂 再生时会释放
再生时会释放 ,可用氨水吸收获得
,可用氨水吸收获得 。现将一定量的
。现将一定量的 固体(含
固体(含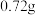 水)置于密闭真空容器中,充入
水)置于密闭真空容器中,充入 和
和 ,其中
,其中 的分压为
的分压为 ,在
,在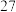 ℃下进行干燥。为保证
℃下进行干燥。为保证 不分解,
不分解, 的分压应不低于
的分压应不低于_______  (已知
(已知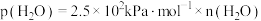
 分解的平衡常数
分解的平衡常数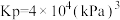 );
);
(4)以 为原料,稀硫酸为电解液,Sn作阴极,用电解的方法可制得
为原料,稀硫酸为电解液,Sn作阴极,用电解的方法可制得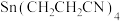 ,其阴极反应式
,其阴极反应式_______ 。
 )是一种重要的化工原料。工业上以
)是一种重要的化工原料。工业上以 为载气,用
为载气,用 作催化剂生产
作催化剂生产 的流程如下:
的流程如下:
②反应釜Ⅰ中发生的反应:
ⅰ:
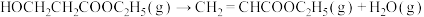

③反应釜Ⅱ中发生的反应:
ⅱ:


ⅲ:
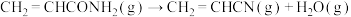

④在此生产条件下,酯类物质可能发生水解。
回答下列问题:
(1)总反应


 、
、 、和
、和 的代数式表示);
的代数式表示);(2)进料混合气中
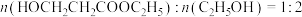 ,出料中四种物质(
,出料中四种物质( 、
、 、
、 、
、 )的流量,(单位时间内出料口流出的物质的量)随时间变化关系如图:
)的流量,(单位时间内出料口流出的物质的量)随时间变化关系如图:
 的曲线是
的曲线是②反应釜Ⅰ中加入
 的作用是
的作用是③出料中没有检测到
 的原因是
的原因是④反应
 后,a、b、c曲线对应物质的流量逐渐降低的原因是
后,a、b、c曲线对应物质的流量逐渐降低的原因是(3)催化剂
 再生时会释放
再生时会释放 ,可用氨水吸收获得
,可用氨水吸收获得 。现将一定量的
。现将一定量的 固体(含
固体(含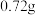 水)置于密闭真空容器中,充入
水)置于密闭真空容器中,充入 和
和 ,其中
,其中 的分压为
的分压为 ,在
,在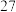 ℃下进行干燥。为保证
℃下进行干燥。为保证 不分解,
不分解, 的分压应不低于
的分压应不低于 (已知
(已知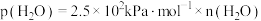
 分解的平衡常数
分解的平衡常数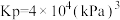 );
);(4)以
 为原料,稀硫酸为电解液,Sn作阴极,用电解的方法可制得
为原料,稀硫酸为电解液,Sn作阴极,用电解的方法可制得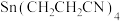 ,其阴极反应式
,其阴极反应式
您最近一年使用:0次
真题
2 . 铜阳极泥(含有Au、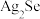 、
、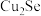 、
、 等)是一种含贵金属的可再生资源,回收贵金属的化工流程如下:
等)是一种含贵金属的可再生资源,回收贵金属的化工流程如下: 时,可忽略该离子的存在;
时,可忽略该离子的存在;
②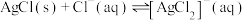
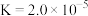 ;
;
③ 易从溶液中结晶析出;
易从溶液中结晶析出;
④不同温度下 的溶解度如下:
的溶解度如下:
回答下列问题:
(1)Cu属于_______ 区元素,其基态原子的价电子排布式为_______ ;
(2)“滤液1”中含有 和
和 ,“氧化酸浸”时
,“氧化酸浸”时 反应的离子方程式为
反应的离子方程式为_______ ;
(3)“氧化酸浸”和“除金”工序抣需加入一定量的 :
:
①在“氧化酸浸”工序中,加入适量 的原因是
的原因是_______ 。
②在“除金”工序溶液中, 浓度不能超过
浓度不能超过_______  。
。
(4)在“银转化”体系中, 和
和 浓度之和为
浓度之和为 ,两种离子分布分数
,两种离子分布分数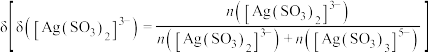 随
随 浓度的变化关系如图所示,若
浓度的变化关系如图所示,若 浓度为
浓度为 ,则
,则 的浓度为
的浓度为_______  。
。_______ (填化学式);在连续生产的模式下,“银转化”和“银还原”工序需在 ℃左右进行,若反应温度过高,将难以实现连续生产,原因是
℃左右进行,若反应温度过高,将难以实现连续生产,原因是_______ 。
 、
、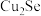 、
、 等)是一种含贵金属的可再生资源,回收贵金属的化工流程如下:
等)是一种含贵金属的可再生资源,回收贵金属的化工流程如下:
 时,可忽略该离子的存在;
时,可忽略该离子的存在;②
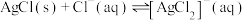
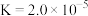 ;
;③
 易从溶液中结晶析出;
易从溶液中结晶析出;④不同温度下
 的溶解度如下:
的溶解度如下:温度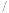 ℃ ℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 14.4 | 26.1 | 37.4 | 33.2 | 29.0 |
(1)Cu属于
(2)“滤液1”中含有
 和
和 ,“氧化酸浸”时
,“氧化酸浸”时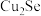 反应的离子方程式为
反应的离子方程式为(3)“氧化酸浸”和“除金”工序抣需加入一定量的
 :
:①在“氧化酸浸”工序中,加入适量
 的原因是
的原因是②在“除金”工序溶液中,
 浓度不能超过
浓度不能超过 。
。(4)在“银转化”体系中,
 和
和 浓度之和为
浓度之和为 ,两种离子分布分数
,两种离子分布分数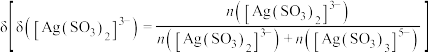 随
随 浓度的变化关系如图所示,若
浓度的变化关系如图所示,若 浓度为
浓度为 ,则
,则 的浓度为
的浓度为 。
。
 ℃左右进行,若反应温度过高,将难以实现连续生产,原因是
℃左右进行,若反应温度过高,将难以实现连续生产,原因是
您最近一年使用:0次
真题
3 . 氢是清洁能源,硼氢化钠( )是一种环境友好的固体储氢材料,其水解生氢反应方程式如下:(除非特别说明,本题中反应条件均为
)是一种环境友好的固体储氢材料,其水解生氢反应方程式如下:(除非特别说明,本题中反应条件均为 ,
, )
)

请回答:
(1)该反应能自发进行的条件是_______。
(2)该反应比较缓慢。忽略体积变化的影响,下列措施中可加快反应速率的是_______。
(3)为加速 水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率v与投料比
水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率v与投料比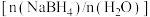 之间的关系,结果如图1所示。请解释ab段变化的原因
之间的关系,结果如图1所示。请解释ab段变化的原因_______ 。_______ 。该电池以 恒定电流工作14分钟,消耗
恒定电流工作14分钟,消耗 体积为
体积为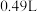 ,故可测得该电池将化学能转化为电能的转化率为
,故可测得该电池将化学能转化为电能的转化率为_______ 。[已知:该条件下 的摩尔体积为
的摩尔体积为 ;电荷量
;电荷量 电流
电流 时间
时间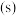 ;
;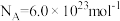 ;
;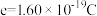 。]
。]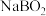 )再生为
)再生为 。(已知:
。(已知: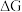 是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比
是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比 计算方法;当
计算方法;当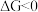 时,反应能自发进行。)
时,反应能自发进行。)
I.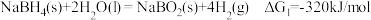
II.
III.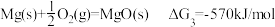
请书写一个方程式表示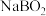 再生为
再生为 的一种制备方法,并注明
的一种制备方法,并注明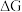
_______ 。(要求:反应物不超过三种物质;氢原子利用率为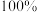 。)
。)
 )是一种环境友好的固体储氢材料,其水解生氢反应方程式如下:(除非特别说明,本题中反应条件均为
)是一种环境友好的固体储氢材料,其水解生氢反应方程式如下:(除非特别说明,本题中反应条件均为 ,
, )
)
请回答:
(1)该反应能自发进行的条件是_______。
| A.高温 | B.低温 | C.任意温度 | D.无法判断 |
| A.升高溶液温度 | B.加入少量异丙胺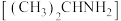 |
C.加入少量固体硼酸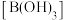 | D.增大体系压强 |
 水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率v与投料比
水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率v与投料比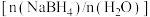 之间的关系,结果如图1所示。请解释ab段变化的原因
之间的关系,结果如图1所示。请解释ab段变化的原因
 恒定电流工作14分钟,消耗
恒定电流工作14分钟,消耗 体积为
体积为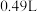 ,故可测得该电池将化学能转化为电能的转化率为
,故可测得该电池将化学能转化为电能的转化率为 的摩尔体积为
的摩尔体积为 ;电荷量
;电荷量 电流
电流 时间
时间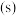 ;
;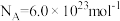 ;
;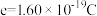 。]
。]
 )再生为
)再生为 。(已知:
。(已知: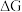 是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比
是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比 计算方法;当
计算方法;当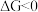 时,反应能自发进行。)
时,反应能自发进行。)I.
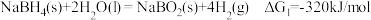
II.

III.
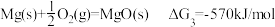
请书写一个方程式表示
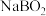 再生为
再生为 的一种制备方法,并注明
的一种制备方法,并注明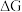
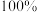 。)
。)
您最近一年使用:0次
真题
4 . 研究人员制备了一种具有锂离子通道的导电氧化物(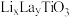 ),其立方晶胞和导电时
),其立方晶胞和导电时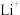 迁移过程如下图所示。已知该氧化物中
迁移过程如下图所示。已知该氧化物中 为
为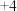 价,
价,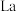 为
为 价。下列说法错误的是
价。下列说法错误的是
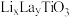 ),其立方晶胞和导电时
),其立方晶胞和导电时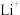 迁移过程如下图所示。已知该氧化物中
迁移过程如下图所示。已知该氧化物中 为
为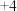 价,
价,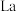 为
为 价。下列说法错误的是
价。下列说法错误的是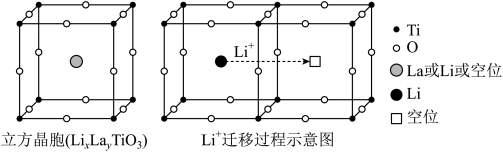
A.导电时, 和 和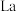 的价态不变 的价态不变 | B.若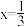 , ,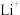 与空位的数目相等 与空位的数目相等 |
| C.与体心最邻近的O原子数为12 | D.导电时、空位移动方向与电流方向相反 |
您最近一年使用:0次
真题
解题方法
5 . 氧是构建化合物的重要元素。请回答:
(1)某化合物的晶胞如图1, 的配位数(紧邻的阳离子数)为
的配位数(紧邻的阳离子数)为_______ ;写出该化合物的化学式_______ ,写出该化合物与足量 溶液反应的化学方程式
溶液反应的化学方程式_______ 。
(3)化合物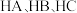 和
和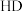 的结构如图2。
的结构如图2。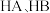 和
和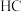 中羟基与水均可形成氢键(
中羟基与水均可形成氢键( ),按照氢键由强到弱对三种酸排序
),按照氢键由强到弱对三种酸排序_______ ,请说明理由_______ 。
②已知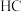 、
、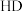 钠盐的碱性
钠盐的碱性 ,请从结构角度说明理由
,请从结构角度说明理由_______ 。
(1)某化合物的晶胞如图1,
 的配位数(紧邻的阳离子数)为
的配位数(紧邻的阳离子数)为 溶液反应的化学方程式
溶液反应的化学方程式
A. 的基态原子电子排布方式只有一种 的基态原子电子排布方式只有一种 |
B. 的第二电离能 的第二电离能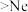 的第一电离能 的第一电离能 |
C. 的基态原子简化电子排布式为 的基态原子简化电子排布式为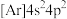 |
D. 原子变成 原子变成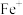 ,优先失去 ,优先失去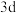 轨道上的电子 轨道上的电子 |
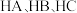 和
和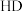 的结构如图2。
的结构如图2。
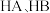 和
和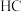 中羟基与水均可形成氢键(
中羟基与水均可形成氢键( ),按照氢键由强到弱对三种酸排序
),按照氢键由强到弱对三种酸排序②已知
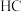 、
、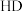 钠盐的碱性
钠盐的碱性 ,请从结构角度说明理由
,请从结构角度说明理由
您最近一年使用:0次
2024·全国·高考真题
6 . 我国科学家最近研究的一种无机盐 纳米药物具有高效的细胞内亚铁离子捕获和抗氧化能力。W、X、Y、Z的原子序数依次增加,且W、X、Y属于不同族的短周期元素。W的外层电子数是其内层电子数的2倍,X和Y的第一电离能都比左右相邻元素的高。Z的M层未成对电子数为4。下列叙述错误的是
纳米药物具有高效的细胞内亚铁离子捕获和抗氧化能力。W、X、Y、Z的原子序数依次增加,且W、X、Y属于不同族的短周期元素。W的外层电子数是其内层电子数的2倍,X和Y的第一电离能都比左右相邻元素的高。Z的M层未成对电子数为4。下列叙述错误的是
 纳米药物具有高效的细胞内亚铁离子捕获和抗氧化能力。W、X、Y、Z的原子序数依次增加,且W、X、Y属于不同族的短周期元素。W的外层电子数是其内层电子数的2倍,X和Y的第一电离能都比左右相邻元素的高。Z的M层未成对电子数为4。下列叙述错误的是
纳米药物具有高效的细胞内亚铁离子捕获和抗氧化能力。W、X、Y、Z的原子序数依次增加,且W、X、Y属于不同族的短周期元素。W的外层电子数是其内层电子数的2倍,X和Y的第一电离能都比左右相邻元素的高。Z的M层未成对电子数为4。下列叙述错误的是| A.W、X、Y、Z四种元素的单质中Z的熔点最高 |
B.在X的简单氢化物中X原子轨道杂化类型为 |
C.Y的氢氧化物难溶于NaCl溶液,可以溶于 溶液 溶液 |
D. 中 中 提供电子对与 提供电子对与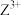 形成配位键 形成配位键 |
您最近一年使用:0次
7日内更新
|
2149次组卷
|
4卷引用:2024年新课标卷理综化学试题(网络回忆版,内容不完整)
(已下线)2024年新课标卷理综化学试题(网络回忆版,内容不完整)2024年新课标卷理科综合化学试题(已下线)2024年高考化学真题完全解读(新课标卷)河南省驻马店市新蔡县第一高级中学2023-2024学年高二下学期6月月考化学试题
7 . 钴在新能源、新材料领域具有重要用途。某炼锌废渣含有锌、铅、铜、铁、钴、锰的 价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。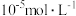 ,其他金属离子不沉淀,即认为完全分离。
,其他金属离子不沉淀,即认为完全分离。
已知:①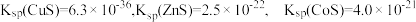 。
。
②以氢氧化物形式沉淀时,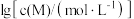 和溶液
和溶液 的关系如图所示。
的关系如图所示。
(1)“酸浸”前,需将废渣磨碎,其目的是_____ 。
(2)“酸浸”步骤中, 发生反应的化学方程式是
发生反应的化学方程式是_____ 。
(3)假设“沉铜”后得到的滤液中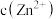 和
和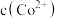 均为
均为 ,向其中加入
,向其中加入 至
至 沉淀完全,此时溶液中
沉淀完全,此时溶液中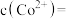
_____  ,据此判断能否实现
,据此判断能否实现 和
和 的完全分离
的完全分离_____ (填“能”或“不能”)。
(4)“沉锰”步骤中,生成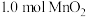 ,产生
,产生 的物质的量为
的物质的量为_____ 。
(5)“沉淀”步骤中,用 调
调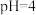 ,分离出的滤渣是
,分离出的滤渣是_____ 。
(6)“沉钴”步骤中,控制溶液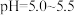 ,加入适量的
,加入适量的 氧化
氧化 ,其反应的离子方程式为
,其反应的离子方程式为_____ 。
(7)根据题中给出的信息,从“沉钴”后的滤液中回收氢氧化锌的方法是_____ 。
 价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
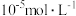 ,其他金属离子不沉淀,即认为完全分离。
,其他金属离子不沉淀,即认为完全分离。已知:①
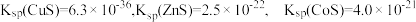 。
。②以氢氧化物形式沉淀时,
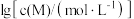 和溶液
和溶液 的关系如图所示。
的关系如图所示。
(1)“酸浸”前,需将废渣磨碎,其目的是
(2)“酸浸”步骤中,
 发生反应的化学方程式是
发生反应的化学方程式是(3)假设“沉铜”后得到的滤液中
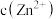 和
和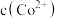 均为
均为 ,向其中加入
,向其中加入 至
至 沉淀完全,此时溶液中
沉淀完全,此时溶液中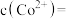
 ,据此判断能否实现
,据此判断能否实现 和
和 的完全分离
的完全分离(4)“沉锰”步骤中,生成
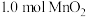 ,产生
,产生 的物质的量为
的物质的量为(5)“沉淀”步骤中,用
 调
调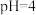 ,分离出的滤渣是
,分离出的滤渣是(6)“沉钴”步骤中,控制溶液
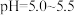 ,加入适量的
,加入适量的 氧化
氧化 ,其反应的离子方程式为
,其反应的离子方程式为(7)根据题中给出的信息,从“沉钴”后的滤液中回收氢氧化锌的方法是
您最近一年使用:0次
真题
8 . 科学家合成了一种如图所示的纳米“分子客车”,能装载多种稠环芳香烃。三种芳烃与“分子客车”的结合常数(值越大越稳定)见表。下列说法错误的是

| 芳烃 | 芘 | 并四苯 | 蒄 |
| 结构 |
|
|
|
| 结合常数 | 385 | 3764 | 176000 |
| A.芳烃与“分子客车”可通过分子间相互作用形成超分子 |
| B.并四苯直立装载与平躺装载的稳定性基本相同 |
| C.从分子大小适配看“分子客车”可装载2个芘 |
| D.芳烃π电子数越多越有利于和“分子客车”的结合 |
您最近一年使用:0次
真题
9 . 回收磁性合金钕铁硼( )可制备半导体材料铁酸铋和光学材料氧化钕。
)可制备半导体材料铁酸铋和光学材料氧化钕。
(1)钕铁硼在空气中焙烧转化为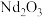 、
、 等(忽略硼的化合物),用
等(忽略硼的化合物),用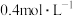 盐酸酸浸后过滤得到
盐酸酸浸后过滤得到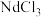 溶液和含铁滤渣。Nd、Fe浸出率(
溶液和含铁滤渣。Nd、Fe浸出率( )随浸取时间变化如图所示。
)随浸取时间变化如图所示。_______ (填化学式)。
②浸出初期Fe浸出率先上升后下降的原因是_______ 。
(2)含铁滤渣用硫酸溶解,经萃取、反萃取提纯后,用于制备铁酸铋。
①用含有机胺(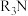 )的有机溶剂作为萃取剂提纯一定浓度的
)的有机溶剂作为萃取剂提纯一定浓度的 溶液,原理为:
溶液,原理为:
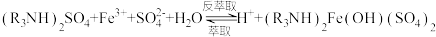 (有机层)
(有机层)
已知:
其他条件不变,水层初始pH在0.2~0.8范围内,随水层pH增大,有机层中Fe元素含量迅速增多的原因是_______ 。
②反萃取后, 经转化可得到铁酸铋。铁酸铋晶胞如图所示(图中有4个Fe原子位于晶胞体对角线上,O原子未画出),其中原子数目比
经转化可得到铁酸铋。铁酸铋晶胞如图所示(图中有4个Fe原子位于晶胞体对角线上,O原子未画出),其中原子数目比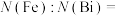
_______ 。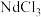 溶液通过沉钕、焙烧得到
溶液通过沉钕、焙烧得到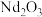 。
。
①向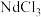 溶液中加入
溶液中加入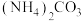 溶液,
溶液,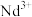 可转化为
可转化为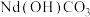 沉淀。该反应的离子方程式为
沉淀。该反应的离子方程式为_______ 。
②将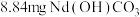 (摩尔质量为
(摩尔质量为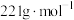 )在氮气氛围中焙烧,剩余固体质量随温度变化曲线如图所示。
)在氮气氛围中焙烧,剩余固体质量随温度变化曲线如图所示。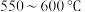 时,所得固体产物可表示为
时,所得固体产物可表示为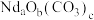 ,通过以上实验数据确定该产物中
,通过以上实验数据确定该产物中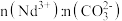 的比值
的比值_______ (写出计算过程)。
 )可制备半导体材料铁酸铋和光学材料氧化钕。
)可制备半导体材料铁酸铋和光学材料氧化钕。(1)钕铁硼在空气中焙烧转化为
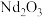 、
、 等(忽略硼的化合物),用
等(忽略硼的化合物),用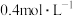 盐酸酸浸后过滤得到
盐酸酸浸后过滤得到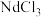 溶液和含铁滤渣。Nd、Fe浸出率(
溶液和含铁滤渣。Nd、Fe浸出率( )随浸取时间变化如图所示。
)随浸取时间变化如图所示。
②浸出初期Fe浸出率先上升后下降的原因是
(2)含铁滤渣用硫酸溶解,经萃取、反萃取提纯后,用于制备铁酸铋。
①用含有机胺(
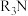 )的有机溶剂作为萃取剂提纯一定浓度的
)的有机溶剂作为萃取剂提纯一定浓度的 溶液,原理为:
溶液,原理为: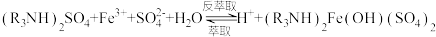 (有机层)
(有机层)已知:

其他条件不变,水层初始pH在0.2~0.8范围内,随水层pH增大,有机层中Fe元素含量迅速增多的原因是
②反萃取后,
 经转化可得到铁酸铋。铁酸铋晶胞如图所示(图中有4个Fe原子位于晶胞体对角线上,O原子未画出),其中原子数目比
经转化可得到铁酸铋。铁酸铋晶胞如图所示(图中有4个Fe原子位于晶胞体对角线上,O原子未画出),其中原子数目比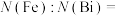

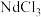 溶液通过沉钕、焙烧得到
溶液通过沉钕、焙烧得到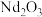 。
。①向
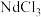 溶液中加入
溶液中加入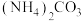 溶液,
溶液,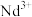 可转化为
可转化为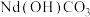 沉淀。该反应的离子方程式为
沉淀。该反应的离子方程式为②将
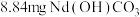 (摩尔质量为
(摩尔质量为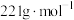 )在氮气氛围中焙烧,剩余固体质量随温度变化曲线如图所示。
)在氮气氛围中焙烧,剩余固体质量随温度变化曲线如图所示。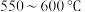 时,所得固体产物可表示为
时,所得固体产物可表示为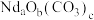 ,通过以上实验数据确定该产物中
,通过以上实验数据确定该产物中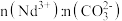 的比值
的比值
您最近一年使用:0次
真题
10 . 鹰爪甲素(如图)可从治疗疟疾的有效药物鹰爪根中分离得到。下列说法错误的是
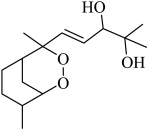
| A.有5个手性碳 | B.在 条件下干燥样品 条件下干燥样品 |
| C.同分异构体的结构中不可能含有苯环 | D.红外光谱中出现了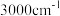 以上的吸收峰 以上的吸收峰 |
您最近一年使用:0次