名校
解题方法
1 . “类比”是预测物质结构、性质与化学反应的重要方法之一,下列有关类比合理的是
| A.H2O的分子空间结构呈V形,则H2S的分子空间结构也呈V形 |
| B.MgCl2溶液与过量的NaOH溶液反应生成Mg(OH)2沉淀,则AlCl3溶液与与过量的NaOH溶液反应生成Al(OH)3沉淀 |
| C.Na与H2O反应生成NaOH和H2,则Fe与H2O反应生成Fe(OH)2和H2 |
| D.镁、铝、稀硫酸组成原电池时镁作负极,则镁、铝、NaOH溶液组成原电池时镁也作负极 |
您最近一年使用:0次
2023-03-15更新
|
694次组卷
|
5卷引用:浙江省宁波市效实中学2023-2024学年高一下学期学业水平模拟考试化学试卷
名校
解题方法
2 . 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是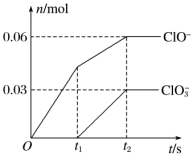
| A.苛性钾溶液中KOH的质量是4.94g |
B.氧化性ClO-<ClO |
| C.反应中转移电子的物质的量是0.21mol |
D.在酸性条件下ClO-和ClO 可生成Cl2 可生成Cl2 |
您最近一年使用:0次
2023-01-13更新
|
387次组卷
|
2卷引用:浙江省宁波市效实中学2023-2024学年高一下学期学业水平模拟考试化学试卷
名校
解题方法
3 . 已知:还原性 ,某溶液中含有等物质的量的
,某溶液中含有等物质的量的 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种离子,为了确定其组成,某同学进行了如下实验:
中的几种离子,为了确定其组成,某同学进行了如下实验:
①取少量溶液,滴入酸性高锰酸钾溶液,发现高锰酸钾溶液褪色
②取①中溶液,加入KSCN溶液,溶液呈红色;加入氢氧化钠固体并加热,产生能使湿润的红色石蕊试纸变蓝的气体
③取少量溶液,加入足量盐酸酸化的氯化钡溶液,产生白色沉淀
下列说法不正确的是
 ,某溶液中含有等物质的量的
,某溶液中含有等物质的量的 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种离子,为了确定其组成,某同学进行了如下实验:
中的几种离子,为了确定其组成,某同学进行了如下实验:①取少量溶液,滴入酸性高锰酸钾溶液,发现高锰酸钾溶液褪色
②取①中溶液,加入KSCN溶液,溶液呈红色;加入氢氧化钠固体并加热,产生能使湿润的红色石蕊试纸变蓝的气体
③取少量溶液,加入足量盐酸酸化的氯化钡溶液,产生白色沉淀
下列说法不正确的是
A.溶液中肯定存在 、 、 、 、 |
B.溶液中不可能同时存在 、 、 |
C.溶液中可能同时存在 、 、 |
D.溶液中可能存在 、 、 |
您最近一年使用:0次
2022-06-26更新
|
1331次组卷
|
5卷引用:浙江省宁波市效实中学2023-2024学年高一下学期学业水平模拟考试化学试卷
名校
解题方法
4 . 将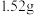 铜镁合金完全溶解于
铜镁合金完全溶解于 的浓硝酸中,得到
的浓硝酸中,得到 和
和 的混合气体
的混合气体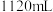 (标准状况),向反应后的溶液中加入
(标准状况),向反应后的溶液中加入 溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:
溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:
(1) 的浓硝酸中含有
的浓硝酸中含有 的物质的量为
的物质的量为_______  。
。
(2)该合金含铜_______ g。
(3)混合气体中, 和
和 的物质的量之比为
的物质的量之比为_______ 。
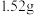 铜镁合金完全溶解于
铜镁合金完全溶解于 的浓硝酸中,得到
的浓硝酸中,得到 和
和 的混合气体
的混合气体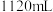 (标准状况),向反应后的溶液中加入
(标准状况),向反应后的溶液中加入 溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:
溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:(1)
 的浓硝酸中含有
的浓硝酸中含有 的物质的量为
的物质的量为 。
。(2)该合金含铜
(3)混合气体中,
 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2022-06-24更新
|
1661次组卷
|
3卷引用:浙江省宁波市效实中学2023-2024学年高一下学期学业水平模拟考试化学试卷
名校
解题方法
5 . 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下发生反应SO2(g)+NO2(g)  SO3(g)+NO(g),正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
SO3(g)+NO(g),正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
②SO2浓度:a点小于c点
③反应物的总能量高于生成物的总能量
④Δt1=Δt2,ab段NO2的消耗量小于bc段NO2的消耗量
⑤混合物颜色不再变化,说明反应达到平衡
⑥体系压强不再变化,说明反应达到平衡
⑦逆反应速率图象在此时间段内和上图趋势相同
⑧达到平衡后,改变容器体积增大压强,逆反应速率可能先增大后减小
 SO3(g)+NO(g),正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
SO3(g)+NO(g),正反应速率随时间变化的示意图如下图,下列结论中正确的个数为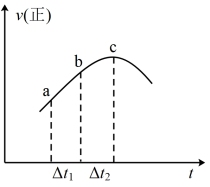
②SO2浓度:a点小于c点
③反应物的总能量高于生成物的总能量
④Δt1=Δt2,ab段NO2的消耗量小于bc段NO2的消耗量
⑤混合物颜色不再变化,说明反应达到平衡
⑥体系压强不再变化,说明反应达到平衡
⑦逆反应速率图象在此时间段内和上图趋势相同
⑧达到平衡后,改变容器体积增大压强,逆反应速率可能先增大后减小
| A.4个 | B.5个 | C.6个 | D.7个 |
您最近一年使用:0次
2022-04-26更新
|
2865次组卷
|
7卷引用:浙江省宁波市效实中学2023-2024学年高一下学期学业水平模拟考试化学试卷
浙江省宁波市效实中学2023-2024学年高一下学期学业水平模拟考试化学试卷浙江省杭州学军中学2021-2022学年高一下学期期中考试化学试题(已下线)高中化学-高一下-16湖北省武汉市洪山高级中学2022-2023学年高二上学期开学考试化学试题(已下线)【知识图鉴】单元讲练测必修第二册第六单元03巩固练山西省晋城一中2022-2023学年高一下学期第三次调研考试化学试题江西省宜春市丰城市第九中学2023-2024学年高一上学期12月月考化学试题
名校
6 . 常温下X为一种常见气体,a、b、c是中学化学常见物质,均含有同种元素,转化关系如图所示,下列说法正确的是
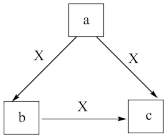
A.若a、b、c均为化合物,且a的焰色试验为黄色,则a只能为 |
B.若a为简单气态氢化物,则X可能为 |
C.若X为 ,a为非金属单质,则a可能是S ,a为非金属单质,则a可能是S |
D.若a为单质 ,则X可能是 ,则X可能是 |
您最近一年使用:0次
2022-01-25更新
|
840次组卷
|
3卷引用:浙江省宁波市效实中学2023-2024学年高一下学期学业水平模拟考试化学试卷
名校
解题方法
7 . 有机物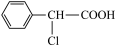 有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)
有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)
| A.13种 | B.16种 | C.9种 | D.19种 |
您最近一年使用:0次
2021-01-05更新
|
1701次组卷
|
21卷引用:2018届高三一轮复习化学:微考点66-有机物的结构与同分异构体
2018届高三一轮复习化学:微考点66-有机物的结构与同分异构体2015-2016学年山西省榆社中学高二下学期期末化学试卷2017届重庆市巴蜀中学高三上学期开学考试化学试卷黑龙江省牡丹江市第一高级中学2018届高三上学期期末考试化学试题【全国百强校】陕西省西安市长安区第一中学2017-2018学年高一下学期第二次月考化学试题黑龙江省鸡西虎林市东方红林业局中学2017-2018学年高二下学期末考试化学试题【校级联考】吉林省长春市九台区师范高中、实验高中2018-2019学年高二下学期期中考试化学试题江西省吉安市吉水中学2019届高三10月月考化学试题江西省南昌市第十中学2020届高三上学期第一次月考化学试题湖南省湘潭市第一中学2020-2021学年高二上学期期中考试化学试题吉林长春市第十一中学2021届高三上学期第二学程考试化学试题高二选择性必修3(人教版2019)第一章 有机化合物的结构特点与研究方法 第一节 综合训练(已下线)专题07 有机(同分异构判断、官能团性质判断、原子共平面判断)-2021年高考化学必做热点专题江西省景德镇一中2020-2021学年高一下学期期中考试化学(1班)试题黑龙江省哈尔滨市宾县一中2020-2021学年高二下学期第二次月考化学试题重庆市江津中学2021届高三高考全真模拟考试化学试题陕西省西安市铁一中滨河高级中学2021-2022学年高三上学期第三次模拟考试理综化学试题吉林省长春市十一高中2021-2022学年高二上学期第三学程考试化学试题(已下线)专题讲座(十一) 同分异构体的书写与数目判断(练)-2023年高考化学一轮复习讲练测(全国通用)陕西省延安市子长市中学2020-2021学年高二下学期期中考试化学试题黑龙江省富锦市第一中学2022-2023学年高二下学期第二次考试化学试题
名校
解题方法
8 . 非线性光学晶体在信息、激光技术、医疗、国防等领域具有重要应用价值。我国科学家利用Cs2CO3、XO2(X=Si、Ge)和H3BO3首次合成了组成为CsXB3O7的非线性光学晶体。回答下列问题:
(1)C、O、Si三种元素电负性由大到小的顺序为__ ;第一电离能I1(Si)__ I1(Ge)(填>或<)。
(2)基态Ge原子核外电子排布式为__ ;SiO2、GeO2具有类似的晶体结构,其中熔点较高的是__ 。
(3)如图为H3BO3晶体的片层结构,其中B的杂化方式为__ ;硼酸在热水中比在冷水中溶解度显著增大的主要原因是__ 。
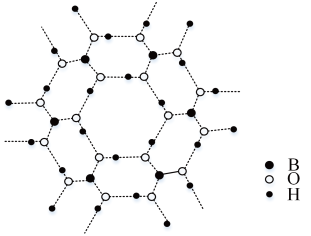
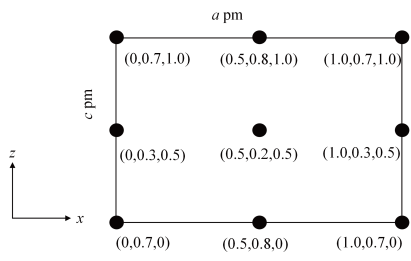
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7属正交晶系(长方体形),晶胞参数为apm、bpm和cpm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为__ ;CsSiB3O7的摩尔质量为Mg.mol-1,设NA为阿伏加 德罗常数的值,则CsSiB3O7晶体的密度为__ g·cm-3(用代数式表示)。
(1)C、O、Si三种元素电负性由大到小的顺序为
(2)基态Ge原子核外电子排布式为
(3)如图为H3BO3晶体的片层结构,其中B的杂化方式为

(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7属正交晶系(长方体形),晶胞参数为apm、bpm和cpm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为

您最近一年使用:0次
2020-03-12更新
|
388次组卷
|
12卷引用:山东省2020年普通高中学业水平等级考试模拟试题
山东省2020年普通高中学业水平等级考试模拟试题江苏省徐州一中2019-2020学年高二上学期期末调研测试化学试题【省级联考】山东省2020届新高考模拟统考化学试题山东省菏泽市菏泽第一中学2020届高三下学期在线考试化学试题河南省洛阳市2020届高三上学期期末模拟考试化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编(已下线)专题讲座(十一) 晶胞参数、坐标参数的分析与应用(精讲)-2021年高考化学一轮复习讲练测广东省河源中学2021届高三上学期第二次质量检测化学试题(鲁科版2019)选择性必修2 第3章 不同聚集状态的物质与性质 章末综合检测卷广东省深圳市龙岗区2020-2021学年高三第一次调研考试化学试题(已下线)押山东卷第17题 物质结构与性质综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)
名校
解题方法
9 . 碳和硅均为元素周期表中第Ⅳ A族的元素,其单质和化合物有着重要应用。
(1)石墨烯是只有一个碳原子直径厚度的单层石墨,最早是由科学家用机械剥离的方法从石墨中分离出来,其部分性能优于传统的硅材料,具有广泛的应用前景。
①写出基态碳原子的电子排布式________ 。石墨烯中C的杂化类型为________ 。
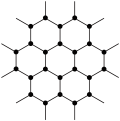
②下图为单层石墨烯的结构示意图。12 g的石墨烯中由C原子连接成的六元环的物质的量约为________ mol。
③石墨烯加氢制得的石墨烷,可用 表示。下列有关叙述正确的是
表示。下列有关叙述正确的是________ 。
a.石墨烷属于烷烃 b.石墨烷难溶于水
c.石墨烷中所有碳原子共平面 d.石墨烷可以发生加成反应
④石墨烯可由加热 晶体脱除
晶体脱除 的方法制得。该过程属于
的方法制得。该过程属于________ 。
a.物理变化 b.分解反应 c.氧化还原反应
(2) 的晶体结构与晶体硅类似。
的晶体结构与晶体硅类似。 的晶体类型为
的晶体类型为________ ,晶体中 原子与
原子与 键的数目之比为
键的数目之比为________ 。
(3) 与
与 空间构型相似,但性质不同:前者不易与水反应,但后者与水剧烈反应,生成两种酸和一种气体,写出该反应的化学方程式:
空间构型相似,但性质不同:前者不易与水反应,但后者与水剧烈反应,生成两种酸和一种气体,写出该反应的化学方程式:__________________________ 。
(1)石墨烯是只有一个碳原子直径厚度的单层石墨,最早是由科学家用机械剥离的方法从石墨中分离出来,其部分性能优于传统的硅材料,具有广泛的应用前景。
①写出基态碳原子的电子排布式
②下图为单层石墨烯的结构示意图。12 g的石墨烯中由C原子连接成的六元环的物质的量约为

③石墨烯加氢制得的石墨烷,可用
 表示。下列有关叙述正确的是
表示。下列有关叙述正确的是a.石墨烷属于烷烃 b.石墨烷难溶于水
c.石墨烷中所有碳原子共平面 d.石墨烷可以发生加成反应
④石墨烯可由加热
 晶体脱除
晶体脱除 的方法制得。该过程属于
的方法制得。该过程属于a.物理变化 b.分解反应 c.氧化还原反应
(2)
 的晶体结构与晶体硅类似。
的晶体结构与晶体硅类似。 的晶体类型为
的晶体类型为 原子与
原子与 键的数目之比为
键的数目之比为(3)
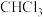 与
与 空间构型相似,但性质不同:前者不易与水反应,但后者与水剧烈反应,生成两种酸和一种气体,写出该反应的化学方程式:
空间构型相似,但性质不同:前者不易与水反应,但后者与水剧烈反应,生成两种酸和一种气体,写出该反应的化学方程式:
您最近一年使用:0次
2020-01-10更新
|
1040次组卷
|
6卷引用:2020年天津市学业水平等级考适应性测试化学试题
解题方法
10 . T1、T2两种温度下BaSO4在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:
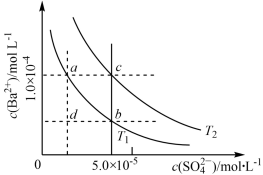
(1)T1____ (填“>”“<”或“=”)T2,T2时Ksp(BaSO4)=______ 。
(2)根据T1温度时BaSO4的沉淀溶解平衡曲线,判断下列说法正确的是____ (填序号)。
A.加入Na2SO4可由a点变为b点
B.在T1曲线上方区域(不含曲线)的任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能由d点变为T1曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
(3)沉淀的生成、溶解和转化在无机物制备和提纯及科研等领域有着广泛应用。已知25 ℃时,Ksp(BaSO4)=1×10-10。
①医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸的酸性较强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于胃酸的原因是________ (用沉淀溶解平衡原理解释)。万一误服了少量BaCl2,应尽快用大量0.5 mol/L Na2SO4溶液洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为____ mol/L。
②长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为_______________________ 。

(1)T1
(2)根据T1温度时BaSO4的沉淀溶解平衡曲线,判断下列说法正确的是
A.加入Na2SO4可由a点变为b点
B.在T1曲线上方区域(不含曲线)的任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能由d点变为T1曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
(3)沉淀的生成、溶解和转化在无机物制备和提纯及科研等领域有着广泛应用。已知25 ℃时,Ksp(BaSO4)=1×10-10。
①医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸的酸性较强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于胃酸的原因是
②长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为
您最近一年使用:0次
2019-08-13更新
|
226次组卷
|
4卷引用:2018届高三一轮复习化学:微考点64-沉淀溶解平衡
2018届高三一轮复习化学:微考点64-沉淀溶解平衡(已下线)2019年1月7日 《每日一题》人教选修4-沉淀的生成与溶解新疆维吾尔自治区且末县第二中学2018-2019学年高二上学期期末考试化学试题(已下线)3.4.2 沉淀溶解平衡原理的应用(重点练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)



