1 . 钛在医疗领域的使用非常广泛,如制人造关节、头盖、主动心瓣等。TiCl4是制备金属钛的重要中间体。某小组同学利用如图装置在实验室制备TiCl4(夹持装置略去)。
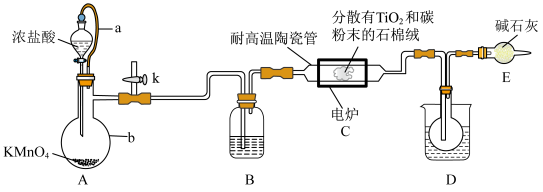
已知:HCl与TiO2不发生反应;装置C中除生成TiCl4外,同时还生成一种有毒气态氧化物和少量CCl4。其它相关信息如表所示:
请回答下列问题:
(1)装置A中导管a的作用为_______ ,装置B中所盛试剂为_______ ,装置C中生成TiCl4的化学方程式为_______ 。
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性 d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:_______ 。
_______→_______→b→_______→_______→_______
(3)下列说法不正确的是_______ 。
A.通入氯气之前,必须先从k处通入氮气,否则实验会失败
B.石棉绒载体是为了增大气体与TiO2、碳粉的接触面积,以加快反应速率
C.装置D中的烧杯中可加入冰水,便于收集到纯的液态TiCl4
D.装置E可防止空气中的水蒸气进入装置D的圆底烧瓶中使TiCl4变质
E.该装置有缺陷,通过装置E后的气体不可直接排放到空气中
(4)TiCl4可制备纳米TiO2:以N2为载体,用TiCl4和水蒸气反应生成Ti(OH)4。再控制温度生成纳米xTiO2•yH2O。测定产物xTiO2•yH2O组成的方法如下:
步骤一:取样品2.100g用稀硫酸充分溶解得到TiOSO4,再用足量铝将TiO2+还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得到待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用0.1000mol•L-1的NH4Fe(SO4)2标准溶液滴定,将Ti3+氧化为TiO2+,三次滴定消耗标准溶液的平均值为24.00mL。通过分析、计算,该样品的组成为_______ 。(填写化学式)

已知:HCl与TiO2不发生反应;装置C中除生成TiCl4外,同时还生成一种有毒气态氧化物和少量CCl4。其它相关信息如表所示:
| 熔点/℃ | 沸点/℃ | 密度/(g•cm-3) | 水溶性 | |
| TiCl4 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
| CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
(1)装置A中导管a的作用为
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性 d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:
_______→_______→b→_______→_______→_______
(3)下列说法不正确的是
A.通入氯气之前,必须先从k处通入氮气,否则实验会失败
B.石棉绒载体是为了增大气体与TiO2、碳粉的接触面积,以加快反应速率
C.装置D中的烧杯中可加入冰水,便于收集到纯的液态TiCl4
D.装置E可防止空气中的水蒸气进入装置D的圆底烧瓶中使TiCl4变质
E.该装置有缺陷,通过装置E后的气体不可直接排放到空气中
(4)TiCl4可制备纳米TiO2:以N2为载体,用TiCl4和水蒸气反应生成Ti(OH)4。再控制温度生成纳米xTiO2•yH2O。测定产物xTiO2•yH2O组成的方法如下:
步骤一:取样品2.100g用稀硫酸充分溶解得到TiOSO4,再用足量铝将TiO2+还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得到待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用0.1000mol•L-1的NH4Fe(SO4)2标准溶液滴定,将Ti3+氧化为TiO2+,三次滴定消耗标准溶液的平均值为24.00mL。通过分析、计算,该样品的组成为
您最近一年使用:0次
2023-09-17更新
|
188次组卷
|
2卷引用:河南省南阳市第一中学校2022-2023学年高三上学期10月月考化学试题
2 . 富马酸亚铁(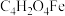 相对分子质量为170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和
相对分子质量为170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和 制备富马酸亚铁,并对其纯度进行测定,过程如下:
制备富马酸亚铁,并对其纯度进行测定,过程如下:
步骤Ⅰ 富马酸亚铁晶体的制备

步骤Ⅱ 产品纯度的测定
取0.400g样品置于250mL锥形瓶中,加入15.00mL硫酸,加热溶解后冷却,再加入50.00mL新煮沸过的冷水和2滴邻二氮菲指示液,此时溶液呈红色;立即用0.1000 的硫酸铈铵
的硫酸铈铵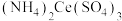 标准液滴定(还原产物为
标准液滴定(还原产物为 ),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗22.00mL标准液。根据以上两个实验步骤,回答下列问题:
),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗22.00mL标准液。根据以上两个实验步骤,回答下列问题:
(1)合成富马酸亚铁时使用如图所示装置(加热和夹持装置略去)。
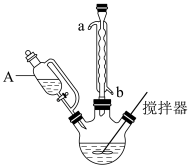
仪器A的名称是_______ ,球形冷凝管的作用为_______ 。
(2)步骤Ⅱ中硫酸铈铵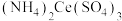 应装入
应装入_______ (填“酸式”或“碱式”)滴定管。
(3)步骤Ⅰ中调pH最好选用的酸为_______ 。
a.盐酸 b.硫酸 c.硝酸
步骤Ⅰ中调pH为6.6的目的是_______ 。合成富马酸亚铁的化学方程式为_______ 。
(4)根据上述实验数据,测得产品的纯度是_______ %(保留三位有效数字)。
(5)下列操作会导致测定纯度偏高的是_______ 。
a.加入的冷水没有煮沸过
b.滴定终点读数时仰视刻度线
c.滴定速度过慢,样品部分变质
d.溶液变为浅蓝色立即读数,很快溶液颜色恢复
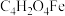 相对分子质量为170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和
相对分子质量为170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和 制备富马酸亚铁,并对其纯度进行测定,过程如下:
制备富马酸亚铁,并对其纯度进行测定,过程如下:步骤Ⅰ 富马酸亚铁晶体的制备

步骤Ⅱ 产品纯度的测定
取0.400g样品置于250mL锥形瓶中,加入15.00mL硫酸,加热溶解后冷却,再加入50.00mL新煮沸过的冷水和2滴邻二氮菲指示液,此时溶液呈红色;立即用0.1000
 的硫酸铈铵
的硫酸铈铵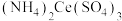 标准液滴定(还原产物为
标准液滴定(还原产物为 ),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗22.00mL标准液。根据以上两个实验步骤,回答下列问题:
),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗22.00mL标准液。根据以上两个实验步骤,回答下列问题:(1)合成富马酸亚铁时使用如图所示装置(加热和夹持装置略去)。

仪器A的名称是
(2)步骤Ⅱ中硫酸铈铵
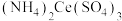 应装入
应装入(3)步骤Ⅰ中调pH最好选用的酸为
a.盐酸 b.硫酸 c.硝酸
步骤Ⅰ中调pH为6.6的目的是
(4)根据上述实验数据,测得产品的纯度是
(5)下列操作会导致测定纯度偏高的是
a.加入的冷水没有煮沸过
b.滴定终点读数时仰视刻度线
c.滴定速度过慢,样品部分变质
d.溶液变为浅蓝色立即读数,很快溶液颜色恢复
您最近一年使用:0次
名校
3 . 氯碱工业的产物可用于制取“84”消毒液的主要成份次氯酸钠。
I.常温下,将 缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入
缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入 的氢氧化钠溶液,整个过程中
的氢氧化钠溶液,整个过程中 变化如图所示,回答下列问题:
变化如图所示,回答下列问题:
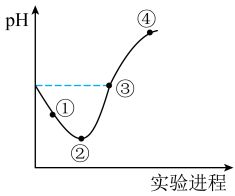
(1)在新制氯水中,下列关系正确的是___________(选填编号)。
(2)③点所示溶液中: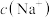
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”,下同);
”,下同);
(3)比较水的电离程度:曲线③点处___________ 曲线②点处。
II.探究发现 溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
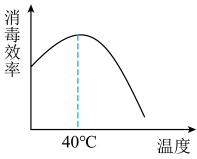
(4)试从水解平衡角度和物质变化的相关知识解释40℃前后变化趋势不同的可能原因_______ 。
III.氯碱工厂的烧碱产品常含有碳酸钠、氯化钠,可用“中和滴定氯化钡法”测定其中 的含量。
的含量。
其实验步骤为:称取工业烧碱 ,配成
,配成 溶液,取出
溶液,取出 ,先加入
,先加入 溶液(过量),然后滴入酚酞指示剂,再用
溶液(过量),然后滴入酚酞指示剂,再用 的盐酸滴定至终点,平均消耗盐酸
的盐酸滴定至终点,平均消耗盐酸 。(已知:
。(已知: 溶解时的
溶解时的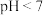 )
)
(5)上述实验步骤中需要用到的全部定量仪器有:___________ 。
(6)计算该样品中 的质量分数为
的质量分数为___________ 。(用小数表示,保留至小数点后第3位)
(7)某次检测发现,实验值明显高于理论值,原因可能是___________。(选填编号)
I.常温下,将
 缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入
缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入 的氢氧化钠溶液,整个过程中
的氢氧化钠溶液,整个过程中 变化如图所示,回答下列问题:
变化如图所示,回答下列问题:
(1)在新制氯水中,下列关系正确的是___________(选填编号)。
A.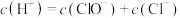 | B. |
C.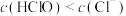 | D.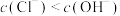 |
(2)③点所示溶液中:
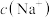
 (填“
(填“ ”“
”“ ”或“
”或“ ”,下同);
”,下同);(3)比较水的电离程度:曲线③点处
II.探究发现
 溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
(4)试从水解平衡角度和物质变化的相关知识解释40℃前后变化趋势不同的可能原因
III.氯碱工厂的烧碱产品常含有碳酸钠、氯化钠,可用“中和滴定氯化钡法”测定其中
 的含量。
的含量。其实验步骤为:称取工业烧碱
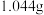 ,配成
,配成 溶液,取出
溶液,取出 ,先加入
,先加入 溶液(过量),然后滴入酚酞指示剂,再用
溶液(过量),然后滴入酚酞指示剂,再用 的盐酸滴定至终点,平均消耗盐酸
的盐酸滴定至终点,平均消耗盐酸 。(已知:
。(已知: 溶解时的
溶解时的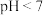 )
)(5)上述实验步骤中需要用到的全部定量仪器有:
(6)计算该样品中
 的质量分数为
的质量分数为(7)某次检测发现,实验值明显高于理论值,原因可能是___________。(选填编号)
| A.工业烧碱已发生潮解 | B.滴定时往锥形瓶中加水 |
| C.配制的待测液敞口放置时间过长 | D.滴定管水洗后未用标准盐酸润洗 |
您最近一年使用:0次
名校
解题方法
4 . 已知 在
在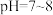 时溶解度最小。某工厂利用钒铬渣提取液(主要成分为
时溶解度最小。某工厂利用钒铬渣提取液(主要成分为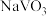 和
和 )制备
)制备 和
和 晶体,流程如下:
晶体,流程如下:
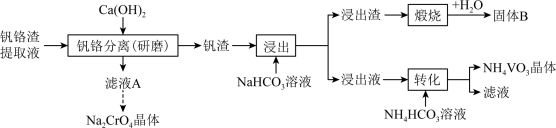
不同温度下相关物质的溶解度
(1)关于“钒铬分离”过程,下列说法正确的是_______。
(2)从滤液A中获取 晶体时,应采用的结晶方法为
晶体时,应采用的结晶方法为_______ ;残留的含铬废水不能直接排放,处理时需要经过“酸化→还原→沉降”三个步骤用 溶液还原时,还原产物为
溶液还原时,还原产物为 ,则反应的离子方程式
,则反应的离子方程式_______ 。
(3)钒渣成份是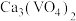 ,“浸出”过程中生成
,“浸出”过程中生成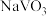 的离子方程式为
的离子方程式为_______ 。
(4)“转化”过程中选用 溶液不选用
溶液不选用 溶液的可能原因为
溶液的可能原因为_______ 。(写一条原因即可)
(5)该流程中可循环利用的物质有_______ 。
(6)研究表明 固体(固体的组成用
固体(固体的组成用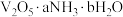 表示)热分解得到
表示)热分解得到 的过程可分为四步,每一步产生
的过程可分为四步,每一步产生 和
和 的物质的量之比依次为2∶1、3∶1、3∶2、3∶2,取
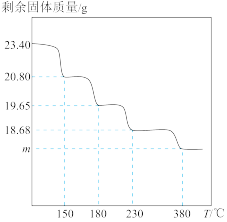
的物质的量之比依次为2∶1、3∶1、3∶2、3∶2,取 固体进行热重分析,剩余固体质量与温度关系如图,
固体进行热重分析,剩余固体质量与温度关系如图, 时剩余固体的组成可表示为:
时剩余固体的组成可表示为:_______ 。
 在
在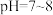 时溶解度最小。某工厂利用钒铬渣提取液(主要成分为
时溶解度最小。某工厂利用钒铬渣提取液(主要成分为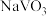 和
和 )制备
)制备 和
和 晶体,流程如下:
晶体,流程如下:
不同温度下相关物质的溶解度
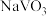 |  | 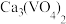 | 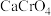 | |
 | 19.3 | 84.0 | 0.1 | 5.5 |
 | 22.5 | 96.5 | 0.09 | 2.49 |
 | 26.3 | 102 | 0.09 | 1.3 |
A.研磨可防止生成的沉淀覆在 表面,提高 表面,提高 利用率 利用率 |
| B.研磨减小了所得钒渣的粒径,提高了后续步骤中钒渣的浸出率 |
C.相对于 、 、 ,工业上更宜选用 ,工业上更宜选用 |
| D.该过程发生了氧化还原反应 |
 晶体时,应采用的结晶方法为
晶体时,应采用的结晶方法为 溶液还原时,还原产物为
溶液还原时,还原产物为 ,则反应的离子方程式
,则反应的离子方程式(3)钒渣成份是
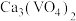 ,“浸出”过程中生成
,“浸出”过程中生成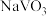 的离子方程式为
的离子方程式为(4)“转化”过程中选用
 溶液不选用
溶液不选用 溶液的可能原因为
溶液的可能原因为
(5)该流程中可循环利用的物质有
(6)研究表明
 固体(固体的组成用
固体(固体的组成用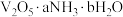 表示)热分解得到
表示)热分解得到 的过程可分为四步,每一步产生
的过程可分为四步,每一步产生 和
和 的物质的量之比依次为2∶1、3∶1、3∶2、3∶2,取
的物质的量之比依次为2∶1、3∶1、3∶2、3∶2,取 固体进行热重分析,剩余固体质量与温度关系如图,
固体进行热重分析,剩余固体质量与温度关系如图, 时剩余固体的组成可表示为:
时剩余固体的组成可表示为:
您最近一年使用:0次
解题方法
5 . 铝、铁、硅的单质及化合物在工业生产中具有广泛应用,工业上常用某矿石(主要成分有 、
、 、FeO、
、FeO、 等)来制备绿矾(
等)来制备绿矾( )和氧化铝,其工艺流程如图:
)和氧化铝,其工艺流程如图:
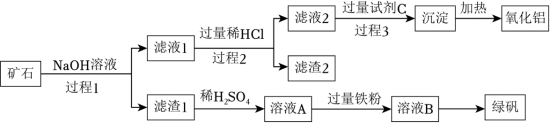
回答下列问题:
(1)过程1中能加快矿石与NaOH溶液反应速率的措施是___________ 。(答一条)
(2)滤渣1的主要成分是___________ ,举例说明滤渣2的用途___________ 。
(3)向溶液A中加入过量铁粉发生反应的离子方程式为:___________ 。
(4)写出由滤液1生成滤液2的离子方程式___________ 。
(5)用来配制试剂C的物质的电子式为:___________ 。
(6)绿矾晶体易被空气中的氧气氧化变质,宜密封保存放置。为探究制备的绿矾样品是否变质,具体的实验操作为___________ 。
 、
、 、FeO、
、FeO、 等)来制备绿矾(
等)来制备绿矾( )和氧化铝,其工艺流程如图:
)和氧化铝,其工艺流程如图:
回答下列问题:
(1)过程1中能加快矿石与NaOH溶液反应速率的措施是
(2)滤渣1的主要成分是
(3)向溶液A中加入过量铁粉发生反应的离子方程式为:
(4)写出由滤液1生成滤液2的离子方程式
(5)用来配制试剂C的物质的电子式为:
(6)绿矾晶体易被空气中的氧气氧化变质,宜密封保存放置。为探究制备的绿矾样品是否变质,具体的实验操作为
您最近一年使用:0次
名校
解题方法
6 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
I.制备K2FeO4
装置如图所示,夹持、加热等装置略。
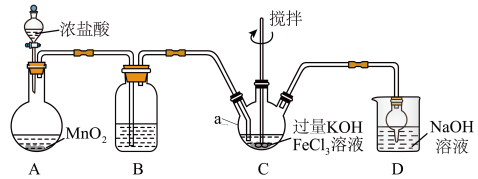
(1)仪器a的名称是______ ,装置B中除杂质所用试剂是______ ,装置D的作用是_____ 。
(2)A中发生反应的化学方程式为______ 。
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为_____ ,反应中KOH必须过量的原因是______ 。
(4)写出C中总反应的离子方程式:______ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
II.K2FeO4产品纯度的测定
准确称取1.20g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和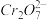 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
(5)根据以上数据,样品中K2FeO4的质量分数为______ 。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果______ (填“偏高”“偏低”或“无影响”)。
I.制备K2FeO4
装置如图所示,夹持、加热等装置略。

(1)仪器a的名称是
(2)A中发生反应的化学方程式为
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为
(4)写出C中总反应的离子方程式:
II.K2FeO4产品纯度的测定
准确称取1.20g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和
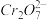 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。(5)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次
2023-01-11更新
|
710次组卷
|
8卷引用:辽宁省实验中学、东北育才学校、鞍山一中、大连八中、大连二十四中五校联考2021-2022学年高三上学期期末联考化学试题
辽宁省实验中学、东北育才学校、鞍山一中、大连八中、大连二十四中五校联考2021-2022学年高三上学期期末联考化学试题(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)2019年四川省绵阳市高三第二次诊断性考试理综化学试题2020届高三《新题速递·化学》1月第02期(考点11-13)【全国百强校】安徽省六安市第一中学2020届高三下学期自测(二)化学试题天津市静海一中20223-2023学年高三上学期期末定时测验化学试题(已下线)专题十八化学实验综合题解题策略(已下线)实验综合题
名校
7 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由实验现象可推知:___________ 。
为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。
(2)将补全下列实验操作步骤正确排序da___________ e(填标号);重复上述操作步骤,直至A恒重,记为m3g。
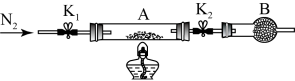
a、点燃酒精灯,加热 b、熄灭酒精灯 c、关闭K1和K2 d、打开K1和K2,缓缓通入N2 e、称量A f、冷却至室温
(3)缓缓通入N2的目的是___________ 。
为探究硫酸亚铁的分解产物,将(2)已恒重的装置A(取出ag后)接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
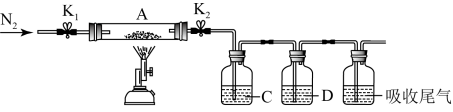
(4)①C、D中的溶液依次为BaCl2、品红。C、D中可观察到的现象分别为___________ 、___________ 。
②写出硫酸亚铁高温分解反应的化学方程式___________ 。
(5)为了测定A中样品的纯度,将取出ag样品溶于水,配制成500mL溶液,用浓度为cmol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
在滴定的过程中,当___________ 即为滴定终点。
(6)上表中第一次实验中记录数据明显大于后两次,其原因可能是___________(填字母)。
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由实验现象可推知:
为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。
(2)将补全下列实验操作步骤正确排序da

a、点燃酒精灯,加热 b、熄灭酒精灯 c、关闭K1和K2 d、打开K1和K2,缓缓通入N2 e、称量A f、冷却至室温
(3)缓缓通入N2的目的是
为探究硫酸亚铁的分解产物,将(2)已恒重的装置A(取出ag后)接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

(4)①C、D中的溶液依次为BaCl2、品红。C、D中可观察到的现象分别为
②写出硫酸亚铁高温分解反应的化学方程式
(5)为了测定A中样品的纯度,将取出ag样品溶于水,配制成500mL溶液,用浓度为cmol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
(6)上表中第一次实验中记录数据明显大于后两次,其原因可能是___________(填字母)。
| A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积 |
| B.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗 |
| D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低 |
您最近一年使用:0次
2022-12-10更新
|
99次组卷
|
2卷引用:上海市奉贤区致远高级中学2021-2022学年高二上学期期末教学评估(等级考)化学试题
名校
解题方法
8 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当易吸收空气中 而变质。
而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入_______ 溶液,充分振荡后有白色沉淀,证明 已经变质。
已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取 样品,并设计用下图装置来测定过氧化钠的质量分数。
样品,并设计用下图装置来测定过氧化钠的质量分数。
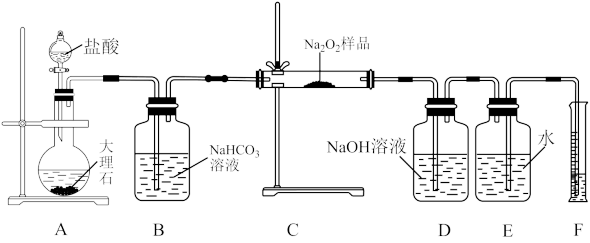
①A中发生反应离子方程式为_______ 。
②将仪器连接好以后,必须进行的第一步操作是_______ 。
③B装置出来的气体是否需要干燥_______ 。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_______ ,_______ 。
⑤D中 溶液的作用
溶液的作用_______ 。
⑥实验完成后E到F之间导管内残留水的体积会使测量结果_______ (填“偏大”、“偏小”或“不影响”)
 而变质。
而变质。(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
 已经变质。
已经变质。(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取
 样品,并设计用下图装置来测定过氧化钠的质量分数。
样品,并设计用下图装置来测定过氧化钠的质量分数。
①A中发生反应离子方程式为
②将仪器连接好以后,必须进行的第一步操作是
③B装置出来的气体是否需要干燥
④写出装置C中发生的所有反应的化学方程式
⑤D中
 溶液的作用
溶液的作用⑥实验完成后E到F之间导管内残留水的体积会使测量结果
您最近一年使用:0次
2022-11-17更新
|
377次组卷
|
2卷引用:广东省广州市铁一中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
9 .  是一种重要的氧化剂与供氧剂。
是一种重要的氧化剂与供氧剂。
(一)研究 与水的反应。取一定量
与水的反应。取一定量 ,加入足量的水,充分反应。
,加入足量的水,充分反应。
(1)反应的离子方程式是_______ 。
(2)收集并测量生成 的体积,发现体积小于理论计算值。某小组研究产生这一差异的原因,进行如下实验。
的体积,发现体积小于理论计算值。某小组研究产生这一差异的原因,进行如下实验。
查阅资料:
a.过氧化钠与水反应的过程中还可能存在以下两个复分解反应:
i.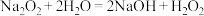 ii.
ii.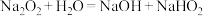
b.与 类似,
类似,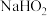 也能在
也能在 催化的条件下分解生成
催化的条件下分解生成
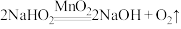
依据资料设计如下实验:取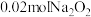 与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量
与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量 ,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化图所示。
,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化图所示。
已知:溶液中 越大,溶液pH越大
越大,溶液pH越大
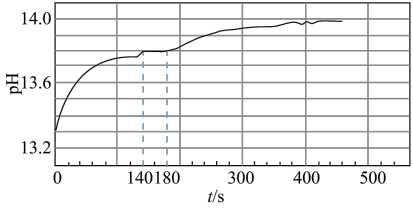
①小组同学根据pH的变化判断反应过程中一定发生反应ⅱ,判断的理由是_______ 。
②根据140s-180s的pH算出溶液中 为0.6mol/L,则此时段内溶液中
为0.6mol/L,则此时段内溶液中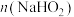 为
为_______ 。
③由上述实验得出的结论是_______ 。
(二) 空气中容易变质。某小组结合(一)的研究设计如下实验测定某久置ag的
空气中容易变质。某小组结合(一)的研究设计如下实验测定某久置ag的 的纯度。
的纯度。
(3)向反应容器中加入一定质量的样品,加入少量 ,再加入足量的水,收集产生的气体并测量体积为VmL(折合到标准状况),计算过氧化钠的纯度
,再加入足量的水,收集产生的气体并测量体积为VmL(折合到标准状况),计算过氧化钠的纯度_______ 。
(4)与水类似,硫酸也能与过氧化钠发生类似反应,若用过量硫酸溶液替代上述方案中的一定量的水,其他测定条件不变,则测量结果会_______ (填“偏大”、“偏小”或“不变”)。
 是一种重要的氧化剂与供氧剂。
是一种重要的氧化剂与供氧剂。(一)研究
 与水的反应。取一定量
与水的反应。取一定量 ,加入足量的水,充分反应。
,加入足量的水,充分反应。(1)反应的离子方程式是
(2)收集并测量生成
 的体积,发现体积小于理论计算值。某小组研究产生这一差异的原因,进行如下实验。
的体积,发现体积小于理论计算值。某小组研究产生这一差异的原因,进行如下实验。查阅资料:
a.过氧化钠与水反应的过程中还可能存在以下两个复分解反应:
i.
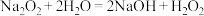 ii.
ii.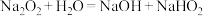
b.与
 类似,
类似,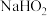 也能在
也能在 催化的条件下分解生成
催化的条件下分解生成
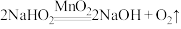
依据资料设计如下实验:取
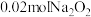 与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量
与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量 ,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化图所示。
,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化图所示。已知:溶液中
 越大,溶液pH越大
越大,溶液pH越大
①小组同学根据pH的变化判断反应过程中一定发生反应ⅱ,判断的理由是
②根据140s-180s的pH算出溶液中
 为0.6mol/L,则此时段内溶液中
为0.6mol/L,则此时段内溶液中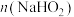 为
为③由上述实验得出的结论是
(二)
 空气中容易变质。某小组结合(一)的研究设计如下实验测定某久置ag的
空气中容易变质。某小组结合(一)的研究设计如下实验测定某久置ag的 的纯度。
的纯度。(3)向反应容器中加入一定质量的样品,加入少量
 ,再加入足量的水,收集产生的气体并测量体积为VmL(折合到标准状况),计算过氧化钠的纯度
,再加入足量的水,收集产生的气体并测量体积为VmL(折合到标准状况),计算过氧化钠的纯度(4)与水类似,硫酸也能与过氧化钠发生类似反应,若用过量硫酸溶液替代上述方案中的一定量的水,其他测定条件不变,则测量结果会
您最近一年使用:0次
名校
解题方法
10 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)
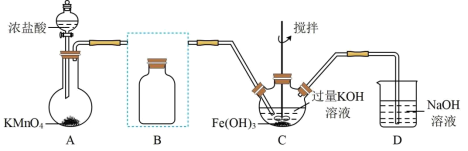
(1)写出A中产生氯气的离子方程式:_______
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:_______
(3)在C中发生的2个反应的离子方程式:_______ ;_______
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
(4)由方案Ⅰ中溶液变红可知a中含有_______ 离子,根据方案Ⅱ得出:氧化性Cl2_______  (填“>”或“<”)
(填“>”或“<”)
(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______
①完成并配平上述离子方程式_______ 。
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。(计算结果保留到0.1%)
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)

(1)写出A中产生氯气的离子方程式:
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:
(3)在C中发生的2个反应的离子方程式:
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶解,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
 (填“>”或“<”)
(填“>”或“<”)(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO
 +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______①完成并配平上述离子方程式
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为
您最近一年使用:0次



