名校
解题方法
1 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。下图是氯元素的化合价与部分物质类别的对应关系。
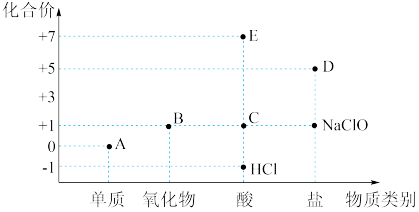
回答下列问题:
(1)已知D可用于实验室制 ,焰色试验时其火焰呈现紫色。A、B、C、D四种物质中,属于电解质的是
,焰色试验时其火焰呈现紫色。A、B、C、D四种物质中,属于电解质的是___________ (填化学式)。
(2)将E滴入碳酸氢钠溶液中,有大量气泡产生,该反应的离子方程式为___________ 。
(3)取10mL某84消毒液(有效成分NaClO含量为14.9g/L),加水稀释,配制成100mL稀溶液。
①配制过程中使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、___________ 。
②稀释后的溶液中,NaClO的物质的量浓度为___________  。
。
(4)工业上“侯氏制碱法”以NaCl、 、
、 ,及水等为原料制备纯碱,生产纯碱的工艺流程示意图如下:
,及水等为原料制备纯碱,生产纯碱的工艺流程示意图如下:
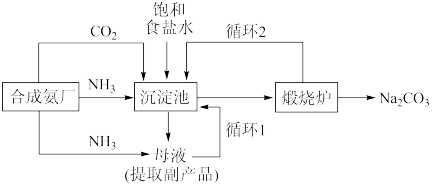
①实验室分离出沉淀的操作名称是___________ ;煅烧炉里进行的化学反应方程式为:___________ 。
②检验产品 中是否含有氯离子,需要的试剂有
中是否含有氯离子,需要的试剂有___________ 。

回答下列问题:
(1)已知D可用于实验室制
 ,焰色试验时其火焰呈现紫色。A、B、C、D四种物质中,属于电解质的是
,焰色试验时其火焰呈现紫色。A、B、C、D四种物质中,属于电解质的是(2)将E滴入碳酸氢钠溶液中,有大量气泡产生,该反应的离子方程式为
(3)取10mL某84消毒液(有效成分NaClO含量为14.9g/L),加水稀释,配制成100mL稀溶液。
①配制过程中使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、
②稀释后的溶液中,NaClO的物质的量浓度为
 。
。(4)工业上“侯氏制碱法”以NaCl、
 、
、 ,及水等为原料制备纯碱,生产纯碱的工艺流程示意图如下:
,及水等为原料制备纯碱,生产纯碱的工艺流程示意图如下:
①实验室分离出沉淀的操作名称是
②检验产品
 中是否含有氯离子,需要的试剂有
中是否含有氯离子,需要的试剂有
您最近一年使用:0次
名校
解题方法
2 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。下图是氯元素的化合价与部分物质类别的对应关系。
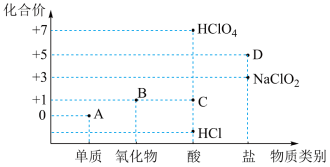
(1)已知D可用于实验室制 ,其阳离子为
,其阳离子为 。A、B、C、D四种物质中,属于电解质的是
。A、B、C、D四种物质中,属于电解质的是_______ (填化学式)。
(2)B溶于氢氧化钠溶液,可生成“84”消毒液的有效成分,则B属于_______ (填“酸性”或“碱性”)氧化物。
(3)D在400℃时分解只生成两种盐,其中一种是无氧酸盐;另一种盐M的阴阳离子个数比为1:1,则D分解的化学方程式为_______ 。
(4)浓HCl与D可制得单质A,请写出相应的化学方程式并用双线桥法表示电子转移的方向与数目_______ 。
(5) 是一种高效的消毒剂和漂白剂。工业用Mathieson法制备
是一种高效的消毒剂和漂白剂。工业用Mathieson法制备 的流程如下:
的流程如下:
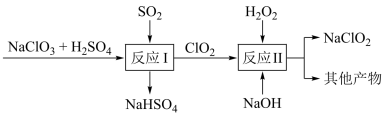
反应I中氧化剂与氧化产物的物质的量之比为_______ ;反应II的离子方程式是_______ 。

(1)已知D可用于实验室制
 ,其阳离子为
,其阳离子为 。A、B、C、D四种物质中,属于电解质的是
。A、B、C、D四种物质中,属于电解质的是(2)B溶于氢氧化钠溶液,可生成“84”消毒液的有效成分,则B属于
(3)D在400℃时分解只生成两种盐,其中一种是无氧酸盐;另一种盐M的阴阳离子个数比为1:1,则D分解的化学方程式为
(4)浓HCl与D可制得单质A,请写出相应的化学方程式并用双线桥法表示电子转移的方向与数目
(5)
 是一种高效的消毒剂和漂白剂。工业用Mathieson法制备
是一种高效的消毒剂和漂白剂。工业用Mathieson法制备 的流程如下:
的流程如下:
反应I中氧化剂与氧化产物的物质的量之比为
您最近一年使用:0次
名校
3 . 燃油汽车尾气中NO和CO的排放,是大气污染的主要原因之一。NSR系统( ,storage and reduction)是一种有效降低
,storage and reduction)是一种有效降低 排放的策略。
排放的策略。
Ⅰ.NSR系统热力学分析
(1)NSR系统中工作原理的方程式为 。298K,101kPa下,该反应的
。298K,101kPa下,该反应的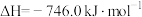 ,
,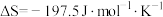 ,该反应在热力学上趋势很大,其原因是
,该反应在热力学上趋势很大,其原因是_______ 。
Ⅱ.密闭容器中NSR系统平衡研究
(2)温度 ℃时,在2L的密闭容器中,充入CO、NO各0.4mol,分别对比三种催化剂(Ⅰ、Ⅱ、Ⅲ)对NSR系统中反应的催化效果,结果如图所示:
℃时,在2L的密闭容器中,充入CO、NO各0.4mol,分别对比三种催化剂(Ⅰ、Ⅱ、Ⅲ)对NSR系统中反应的催化效果,结果如图所示:
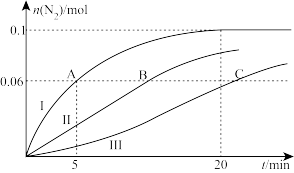
①反应开始到A点,用NO浓度变化表示的平均反应速率为_______  。
。
②B点所在体系达平衡时,放出的热量为_______ kJ。
③C点所在体系达平衡后,继续加入0.2mol NO、0.2mol CO、0.3mol 、0.2mol
、0.2mol  ,再次平衡时的
,再次平衡时的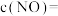
_______  。
。
Ⅲ.NSR系统机理研究
重庆一中某探究性学习小组模拟NSB系统中“吸附、储存、释放、还产物原”四个阶段的全过程。先控制气流(成分为NO、 )通过NSR反应器,待出口处浓度稳定后,通入还原性气体(CO等)。总反应为
)通过NSR反应器,待出口处浓度稳定后,通入还原性气体(CO等)。总反应为 。四个阶段与出口处浓度的时间对应关系如图所示,回答下列问题:
。四个阶段与出口处浓度的时间对应关系如图所示,回答下列问题:
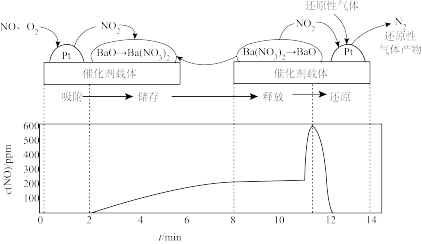
(3)吸附阶段:2min前,出口处的 浓度接近于0,原因是
浓度接近于0,原因是_______ 。
(4)释放阶段:写出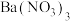 释放出
释放出 的化学反应方程式:
的化学反应方程式:_______ 。
(5)还原阶段:
①通入的还原性气体成分为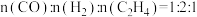 ,与
,与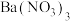 中释放的
中释放的 反应后,气体成分为
反应后,气体成分为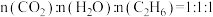 [
[ 未测定],则反应的
未测定],则反应的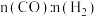

_______ 。
②有研究表明,还原性气体中若混有 ,会导致催化剂中毒,活性下降,从氧化还原反应原理和催化剂循环再生的角度分析可能原因:
,会导致催化剂中毒,活性下降,从氧化还原反应原理和催化剂循环再生的角度分析可能原因:_______ 。
 ,storage and reduction)是一种有效降低
,storage and reduction)是一种有效降低 排放的策略。
排放的策略。Ⅰ.NSR系统热力学分析
(1)NSR系统中工作原理的方程式为
 。298K,101kPa下,该反应的
。298K,101kPa下,该反应的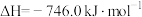 ,
,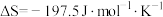 ,该反应在热力学上趋势很大,其原因是
,该反应在热力学上趋势很大,其原因是Ⅱ.密闭容器中NSR系统平衡研究
(2)温度
 ℃时,在2L的密闭容器中,充入CO、NO各0.4mol,分别对比三种催化剂(Ⅰ、Ⅱ、Ⅲ)对NSR系统中反应的催化效果,结果如图所示:
℃时,在2L的密闭容器中,充入CO、NO各0.4mol,分别对比三种催化剂(Ⅰ、Ⅱ、Ⅲ)对NSR系统中反应的催化效果,结果如图所示:
①反应开始到A点,用NO浓度变化表示的平均反应速率为
 。
。②B点所在体系达平衡时,放出的热量为
③C点所在体系达平衡后,继续加入0.2mol NO、0.2mol CO、0.3mol
 、0.2mol
、0.2mol  ,再次平衡时的
,再次平衡时的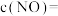
 。
。Ⅲ.NSR系统机理研究
重庆一中某探究性学习小组模拟NSB系统中“吸附、储存、释放、还产物原”四个阶段的全过程。先控制气流(成分为NO、
 )通过NSR反应器,待出口处浓度稳定后,通入还原性气体(CO等)。总反应为
)通过NSR反应器,待出口处浓度稳定后,通入还原性气体(CO等)。总反应为 。四个阶段与出口处浓度的时间对应关系如图所示,回答下列问题:
。四个阶段与出口处浓度的时间对应关系如图所示,回答下列问题:
(3)吸附阶段:2min前,出口处的
 浓度接近于0,原因是
浓度接近于0,原因是(4)释放阶段:写出
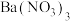 释放出
释放出 的化学反应方程式:
的化学反应方程式:(5)还原阶段:
①通入的还原性气体成分为
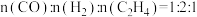 ,与
,与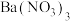 中释放的
中释放的 反应后,气体成分为
反应后,气体成分为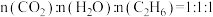 [
[ 未测定],则反应的
未测定],则反应的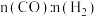

②有研究表明,还原性气体中若混有
 ,会导致催化剂中毒,活性下降,从氧化还原反应原理和催化剂循环再生的角度分析可能原因:
,会导致催化剂中毒,活性下降,从氧化还原反应原理和催化剂循环再生的角度分析可能原因:
您最近一年使用:0次
4 . 氨元素是动植物生长不可缺少的元素,图1是自然界中氨元素的循环示意图,图2是氨元素的常见化合价与部分物质类别的对应关系。回答下列问题:
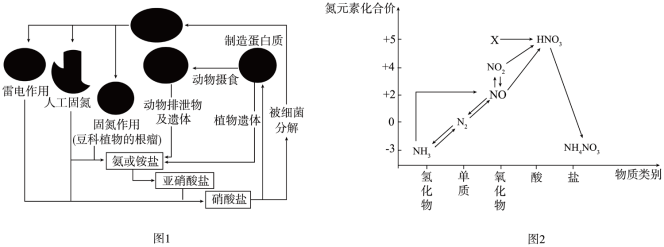
(1)图1中属于固氮过程的是_______ (写两种即可)。
(2) 可以将
可以将 还原为Fe,自身被氧化为
还原为Fe,自身被氧化为 。某学习小组欲制备氨气以还原氧化铁。
。某学习小组欲制备氨气以还原氧化铁。
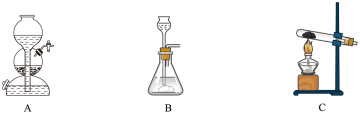
①下列各装置中常用于实验室制备氨气的是_______ (填字母),利用该装置制备氨气的化学方程式为_______ 。
② 还原
还原 并检验有水生成的实验装置如图所示:
并检验有水生成的实验装置如图所示:
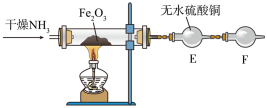
写出氨气与氧化铁反应的化学方程式:_______ 。干燥管F中装有无水氯化钙,其作用是_______ 。
(3)图2中物质X的化学式是_______ ,其与水反应生成 。某硝酸和硫酸的混合溶液200mL,其中硫酸的浓度为
。某硝酸和硫酸的混合溶液200mL,其中硫酸的浓度为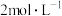 ,硝酸的浓度为
,硝酸的浓度为 ,现向其中加入9.6g铜粉,充分反应生成气体的化学式为
,现向其中加入9.6g铜粉,充分反应生成气体的化学式为_______ (假设只生成一种气体),最多可收集到标准状况下的该气体的体积为_______ L。

(1)图1中属于固氮过程的是
(2)
 可以将
可以将 还原为Fe,自身被氧化为
还原为Fe,自身被氧化为 。某学习小组欲制备氨气以还原氧化铁。
。某学习小组欲制备氨气以还原氧化铁。①下列各装置中常用于实验室制备氨气的是

②
 还原
还原 并检验有水生成的实验装置如图所示:
并检验有水生成的实验装置如图所示:
写出氨气与氧化铁反应的化学方程式:
(3)图2中物质X的化学式是
 。某硝酸和硫酸的混合溶液200mL,其中硫酸的浓度为
。某硝酸和硫酸的混合溶液200mL,其中硫酸的浓度为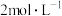 ,硝酸的浓度为
,硝酸的浓度为 ,现向其中加入9.6g铜粉,充分反应生成气体的化学式为
,现向其中加入9.6g铜粉,充分反应生成气体的化学式为
您最近一年使用:0次
名校
5 . 氯、氮、硫等及其化合物性质研究。如图是氮、硫元素的各种价态与物质类别的对应关系:

(1)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。写出SO2吸收Br2反应的化学方程式为____ 。
(2)氮氧化物的治理是当前生态环境保护中的重要课题之一。
①从原理上看,NH3可用于治理NO2,该反应在催化剂条件下可实现,写出化学方程式____ 。
②次氯酸盐也可用于脱除NO,主要过程如下:
a.NO+HClO=NO2+HCl b.NO+NO2+H2O 2HNO2 c.HClO+HNO2=HNO3+HCl
2HNO2 c.HClO+HNO2=HNO3+HCl
下列分析正确的是___ 。
A.NO2单独存在不能被次氯酸盐脱除
B.烟气中含有的少量的O2能提高NO的脱除率
C.脱除过程中,次氯酸盐溶液的酸性增强
③电解氧化吸收法:其原理如图所示:
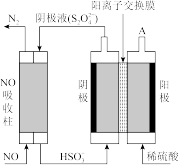
从A口中出来的物质的是____ 。写出电解池阴极的电极反应式____ 。
(3)一种新型催化剂能使NO和CO发生反应2NO+2CO 2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:
2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:
①上述实验中a=____ ,b=____ 。
②上述实验中,能验证温度对化学反应速率影响规律的一组实验是____ (填实验编号)。

(1)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。写出SO2吸收Br2反应的化学方程式为
(2)氮氧化物的治理是当前生态环境保护中的重要课题之一。
①从原理上看,NH3可用于治理NO2,该反应在催化剂条件下可实现,写出化学方程式
②次氯酸盐也可用于脱除NO,主要过程如下:
a.NO+HClO=NO2+HCl b.NO+NO2+H2O
 2HNO2 c.HClO+HNO2=HNO3+HCl
2HNO2 c.HClO+HNO2=HNO3+HCl下列分析正确的是
A.NO2单独存在不能被次氯酸盐脱除
B.烟气中含有的少量的O2能提高NO的脱除率
C.脱除过程中,次氯酸盐溶液的酸性增强
③电解氧化吸收法:其原理如图所示:

从A口中出来的物质的是
(3)一种新型催化剂能使NO和CO发生反应2NO+2CO
 2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:
2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:| 实验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| I | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| II | 280 | 1.20×10-3 | b | 124 |
| III | 350 | a | 5.80×10-3 | 82 |
②上述实验中,能验证温度对化学反应速率影响规律的一组实验是
您最近一年使用:0次
6 . 目前世界各国都规划了碳达峰、碳中和的时间节点,以CO2为碳源,将其转化为能源物质。选择性加氢合成CH3OH,合成过程中发生下列反应:
反应i:CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H1=-akJ‧mol-1
反应ii:CO(g)+2H2(g)⇌CH3OH(g) ∆H2
反应iii:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H3=-bkJ‧mol-1
回答下列问题:
(1)根据盖斯定律,∆H2=。___________ kJ‧mol-1(用含a,b的代数式表示)。
(2)在一绝热、刚性容器中,只发生反应iii。下列说法表明反应已达到平衡状态的是___________(填序号)。
(3)中科院兰州化物所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,反应过程如图所示。催化剂中添加助剂Na、K、Cu(也起催化作用)后可改变反应的选择性。

在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表所示:
欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加Na助剂是否效果最好?_________ (填“是”或“否”),请叙述原因:___________ 。
(4)合成二甲醚反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H=-74kJ‧mol-1。该反应正反应的活化能___________ (填“>”“<”或“=”) 逆反应的活化能。
(5)在一定条件下,将1molCO和2molH2充入IL恒容密闭容器中:发生反应:CO(g)+2H2(g)⇌CH3OH(g) ∆H2,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
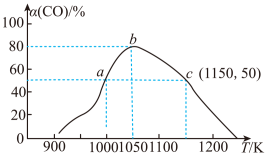
①温度为1000K时,反应开始至2min时,v(H2)=___________ mol‧L-1‧min-1
②CO的转化率随温度的升高先增大后变小的原因是___________ 。
(6)为实现CO2资源化利用,通过光电转化原理以CO2为原料制备甲酸产品(如图所示)。
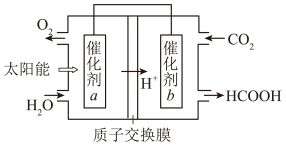
①光电转化过程中,阴极反应式为___________
②催化剂b附近生成lmolHCOOH时,标准状况下催化剂a附近理论上产生______ L气体。
反应i:CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H1=-akJ‧mol-1
反应ii:CO(g)+2H2(g)⇌CH3OH(g) ∆H2
反应iii:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H3=-bkJ‧mol-1
回答下列问题:
(1)根据盖斯定律,∆H2=。
(2)在一绝热、刚性容器中,只发生反应iii。下列说法表明反应已达到平衡状态的是___________(填序号)。
| A.混合气体的总物质的量不再变化 | B.n(CH3OH):n(H2O)=1:1 |
| C.v正(CH3OH)=3v逆(H2) | D.该反应的K不再变化 |

在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表所示:
| 助剂 | CO2转化率(%) | 各产物在所有产物中的占比 | ||
| C2H4 | C3H6 | 其他 | ||
| Na | 42.5 | 35.9 | 39.6 | 24.5 |
| K | 27.2 | 75.6 | 22.8 | 1.6 |
| Cu | 9.8 | 80.7 | 12.5 | 6.8 |
(4)合成二甲醚反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H=-74kJ‧mol-1。该反应正反应的活化能
(5)在一定条件下,将1molCO和2molH2充入IL恒容密闭容器中:发生反应:CO(g)+2H2(g)⇌CH3OH(g) ∆H2,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:

①温度为1000K时,反应开始至2min时,v(H2)=
②CO的转化率随温度的升高先增大后变小的原因是
(6)为实现CO2资源化利用,通过光电转化原理以CO2为原料制备甲酸产品(如图所示)。

①光电转化过程中,阴极反应式为
②催化剂b附近生成lmolHCOOH时,标准状况下催化剂a附近理论上产生
您最近一年使用:0次
名校
解题方法
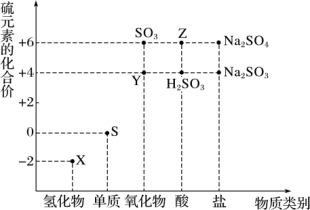
7 . “价一类”二维图是预测物质性质的重要思维工具。如图是硫元素的常见化合价与部分物质类别的对应关系:___ 、___ (用化学式表示)。
(2)Na2SO4的电离方程式为___ 。
(3)硫代硫酸钠(Na2S2O3)俗称海波。从类别的角度分析,其属于___ (填标号)。
A.盐 B.碱 C.酸 D.氧化物
从价态的角度分析,Na2S2O3___ (填标号)
A.只有氧化性 B.既有氧化性又有还原性 C.只有还原性
(4)Z的浓溶液可用铝质容器储存的原因是___ 。
(5)从物质的性质分析,Y不可用进行干燥___ (填标号)。
A.浓硫酸 B.碱石灰 C.P2O5固体
(6)写出Y通过化合反应一步生成Z的化学方程式:___ 。
(2)Na2SO4的电离方程式为
(3)硫代硫酸钠(Na2S2O3)俗称海波。从类别的角度分析,其属于
A.盐 B.碱 C.酸 D.氧化物
从价态的角度分析,Na2S2O3
A.只有氧化性 B.既有氧化性又有还原性 C.只有还原性
(4)Z的浓溶液可用铝质容器储存的原因是
(5)从物质的性质分析,Y不可用进行干燥
A.浓硫酸 B.碱石灰 C.P2O5固体
(6)写出Y通过化合反应一步生成Z的化学方程式:
您最近一年使用:0次
2021-05-10更新
|
841次组卷
|
3卷引用:第03讲 硫酸根离子的检验 含硫物质的转化(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)
(已下线)第03讲 硫酸根离子的检验 含硫物质的转化(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)江苏省海安市南莫中学2020-2021学年高一下学期期中考试化学试题黑龙江省双鸭山市第一中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
8 . 向1L含0.01molNaAlO2和 的溶液中缓慢通入二氧化碳,随
的溶液中缓慢通入二氧化碳,随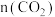 增大,先后发生三个不同的反应,当0.01mol < n(CO2)≤0.015mol 时发生的反应是: 2NaAlO2 + CO2 + 3H2O=2Al(OH)3↓+Na2CO3,下列对应关系正确的是( )
增大,先后发生三个不同的反应,当0.01mol < n(CO2)≤0.015mol 时发生的反应是: 2NaAlO2 + CO2 + 3H2O=2Al(OH)3↓+Na2CO3,下列对应关系正确的是( )
 的溶液中缓慢通入二氧化碳,随
的溶液中缓慢通入二氧化碳,随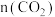 增大,先后发生三个不同的反应,当0.01mol < n(CO2)≤0.015mol 时发生的反应是: 2NaAlO2 + CO2 + 3H2O=2Al(OH)3↓+Na2CO3,下列对应关系正确的是( )
增大,先后发生三个不同的反应,当0.01mol < n(CO2)≤0.015mol 时发生的反应是: 2NaAlO2 + CO2 + 3H2O=2Al(OH)3↓+Na2CO3,下列对应关系正确的是( )| 选项 | 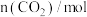 | 溶液中离子的物质的量浓度 |
| A | 0 |  |
| B | 0.01 |  |
| C | 0.015 | 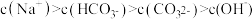 |
| D | 0.03 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-03-10更新
|
607次组卷
|
12卷引用:解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)安徽省亳州市2019-2020学年高三上学期期末教学质量检测化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)黑龙江省密山四中2020-2021学年高二下学期期末考试化学试题(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时43 粒子浓度大小比较-2022年高考化学一轮复习小题多维练(全国通用)第三章 第三节 盐类的水解 第2课时 影响盐类水解的因素 水解原理的应用天津市耀华中学2023-2024学年高二上学期12月月考化学试卷
名校
解题方法
9 . 利用元素的化合价推测物质的性质是化学研究的重要手段,氮元素的常见化合价与部分物质类别的对应关系如图所示。

(1)从氮元素化合价的角度分析,X、Y、Z、W中既具有氧化性又具有还原性的有______ (填化学式)。
(2) N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_______________ 。尾气中的NO用酸性NaClO溶液吸收,其原理是HClO氧化NO生成Cl−和NO3-,其离子方程式为______________________________________ 。
(3)将集满红棕色气体Z的试管倒置于盛有水的水槽中,观察到的现象为_______________________ 。
(4)W的稀溶液与铜单质发生反应的离子方程式为__________________________ 。
(5)已知NaNO2能被酸性KMnO4溶液氧化为NaNO3,则50mL0.01 mol·L-1 NaNO2溶液与10mL0.02 mol·L-1 KMnO4溶液恰好完全反应时,还原产物中Mn元素的化合价为__________________________ 。

(1)从氮元素化合价的角度分析,X、Y、Z、W中既具有氧化性又具有还原性的有
(2) N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为
(3)将集满红棕色气体Z的试管倒置于盛有水的水槽中,观察到的现象为
(4)W的稀溶液与铜单质发生反应的离子方程式为
(5)已知NaNO2能被酸性KMnO4溶液氧化为NaNO3,则50mL0.01 mol·L-1 NaNO2溶液与10mL0.02 mol·L-1 KMnO4溶液恰好完全反应时,还原产物中Mn元素的化合价为
您最近一年使用:0次
2020-01-09更新
|
485次组卷
|
6卷引用:广东省梅州兴宁市沐彬中学2021-2022学年高一下学期 3月月考化学试题
名校
解题方法
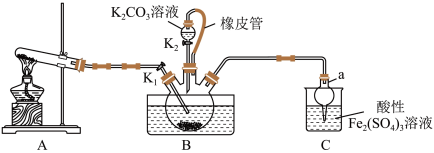
10 . 硫氰化钾(KSCN)是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图实验装置模拟工业制备 KSCN 并进行相关探究实验。___________ 。
(2)装置A用于实验室制备氨气,反应的化学方程式为___________ 。
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是___________ (写两点)。
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至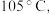 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是___________ 。
(5)尾气处理:装置C 中仪器a的名称是___________ ,酸性Fe₂(SO₄)₃溶液用于除去尾气中两种污染性气体,其中一种气体M能使酚酞溶液变红,另一种气体N能使溶液产生淡黄色沉淀,写出除去气体N的离子方程式___________ 。
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知 (白色)]:
(白色)]:___________ [可供选择的试剂: 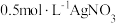 溶液、
溶液、 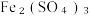 溶液、
溶液、 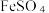 溶液、
溶液、  溶液]。
溶液]。

(2)装置A用于实验室制备氨气,反应的化学方程式为
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至
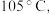 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是(5)尾气处理:装置C 中仪器a的名称是
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知
 (白色)]:
(白色)]: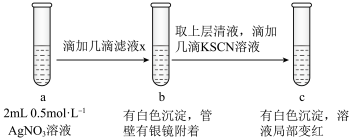
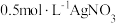 溶液、
溶液、 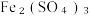 溶液、
溶液、 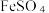 溶液、
溶液、  溶液]。
溶液]。
您最近一年使用:0次
2024-04-16更新
|
318次组卷
|
2卷引用:福建师范大学附属中学2021-2022学年高一下学期期末考试化学试题



