名校
1 . 小组同学探究盐溶液对反应 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与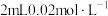 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
ii. (黄色)
(黄色)
iii.已知 对实验无影响
对实验无影响
下列说法不正确的是
 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与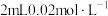 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。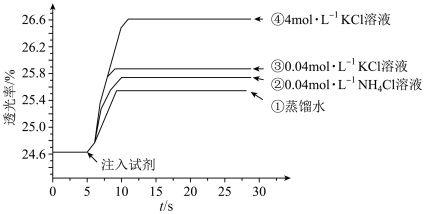
ii.
 (黄色)
(黄色)iii.已知
 对实验无影响
对实验无影响下列说法不正确的是
A.注入试剂①后溶液透光率增大,证明 逆向移动 逆向移动 |
B.透光率③比②高,可能是阳离子种类或溶液 不同导致的 不同导致的 |
C.透光率④比③高,可能发生了反应 |
D.若要证明试剂③中 对平衡体系有影响,还应使用 对平衡体系有影响,还应使用 的 的 溶液进行对照实验 溶液进行对照实验 |
您最近一年使用:0次
2023-11-21更新
|
366次组卷
|
7卷引用:北京市对外经济贸易大学附属中学2022-2023学年高二上学期期中考试化学试题
2 . I.大气的成分在工业上有重要的应用。
(1)在恒容密闭容器中,发生反应N2(g)+3H2(g) 2NH3(g),下列说法可以证明反应已达到平衡状态的是
2NH3(g),下列说法可以证明反应已达到平衡状态的是_______ (填序号)。
①单位时间内生成nmolN2的同时生成2nmolNH3
②1个N≡N键断裂的同时,有6个N-H键形成
③混合气体的密度不再改变的状态
④混合气体的压强不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
(2)为提高H2的转化率,实际生产中宜采取的措施是_______ (填字母)。
II.中国科学家首次实现了以二氧化碳为原料,不依赖植物光合作用,直接人工合成淀粉。已知CO2经催化加氢可以生成多种低碳有机物。
已知:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.5kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.5kJ•mol-1
②CO2(g)+H2(g) CO(g)+H2O(g) △H2=+40.9kJ•mol-1
CO(g)+H2O(g) △H2=+40.9kJ•mol-1
③CO(g)+2H2(g) CH3OH(g) △H3
CH3OH(g) △H3
回答下列问题:
(3)反应③的△H3为_______ 。
(4)一定温度下,在一体积固定的密闭容器中进行反应①,测得CO2的物质的量浓度随反应时间的变化如图所示,则反应进行的前5分钟内,v(H2)=_______ ;10min时,改变的外界条件可能是_______ 。

(5)已知一定温度下按照起始比 =2,在一密闭容器中进行反应③,保持总压为4MPa不变,达平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数Kp=
=2,在一密闭容器中进行反应③,保持总压为4MPa不变,达平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数Kp=_______ (各气体分压=平衡体系中各气体的体积分数×总压)。
(1)在恒容密闭容器中,发生反应N2(g)+3H2(g)
 2NH3(g),下列说法可以证明反应已达到平衡状态的是
2NH3(g),下列说法可以证明反应已达到平衡状态的是①单位时间内生成nmolN2的同时生成2nmolNH3
②1个N≡N键断裂的同时,有6个N-H键形成
③混合气体的密度不再改变的状态
④混合气体的压强不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
(2)为提高H2的转化率,实际生产中宜采取的措施是
| A.及时移出氨 | B.适当增大压强 | C.减小压强 | D.降低温度 |
II.中国科学家首次实现了以二氧化碳为原料,不依赖植物光合作用,直接人工合成淀粉。已知CO2经催化加氢可以生成多种低碳有机物。
已知:
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.5kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.5kJ•mol-1②CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+40.9kJ•mol-1
CO(g)+H2O(g) △H2=+40.9kJ•mol-1③CO(g)+2H2(g)
 CH3OH(g) △H3
CH3OH(g) △H3回答下列问题:
(3)反应③的△H3为
(4)一定温度下,在一体积固定的密闭容器中进行反应①,测得CO2的物质的量浓度随反应时间的变化如图所示,则反应进行的前5分钟内,v(H2)=

(5)已知一定温度下按照起始比
 =2,在一密闭容器中进行反应③,保持总压为4MPa不变,达平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数Kp=
=2,在一密闭容器中进行反应③,保持总压为4MPa不变,达平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数Kp=
您最近一年使用:0次
名校
解题方法
3 . 大力发展新能源汽车产业是我国兑现碳中和承诺的重要战略之一。随着这一产业的发展,如何处理废旧锂电池成为一个亟需解决的问题。某废弃的钴酸锂(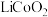 )电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
)电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:

已知: 与草酸根离子(
与草酸根离子( )结合生成较稳定的
)结合生成较稳定的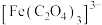 ,
,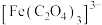 在强酸性条件下分解重新生成
在强酸性条件下分解重新生成 。
。
(1)操作①的名称为______ ;由此可推测,氧化铝______ (填“能”或“不能”)溶于氢氧化钠溶液。
(2)溶液②中所含主要溶质为LiCl、 ,请写出
,请写出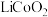 和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)
和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)______ 。
(3)将溶液中的 转化为
转化为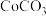 沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是
沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是__________________ 。
(4)为证明操作④获得的 沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入
沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入______ ,若无白色沉淀生成,则证明沉淀洗涤干净。
(5)取3.66 g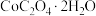 (相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为
(相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为______ (填化学式);在956℃条件下反应完全后,剩余固体相对最开始反应前失重59%,此时固体成分的化学式为 ,
,
______ 。
(6)某同学设计如图装置测定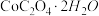 晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是______ (填选项)。

A. B中应装入浓硫酸,目的是除去水蒸气
B. 利用干燥管前后质量差可计算出结晶水的含量
C. 图中半透膜可让气体通过又可防止固体粉末进入导管
D. 反应结束后,应先停止加热,一段时间后再停止通空气
(7)溶液④中,铁元素主要以______ 离子形态存在,应加入______ 后再进行后续操作。
(8) 溶液在工业上常用于电路板的蚀刻,发生的反应为
溶液在工业上常用于电路板的蚀刻,发生的反应为 。某同学向含有
。某同学向含有 、
、 和
和 三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为
三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为______ (填选项)。
A. Fe B. Fe和Zn C. Fe和Cu D. Cu和Zn
(9)某a g混合粉末中含有铁、石墨、硫和碳酸氢铵,在空气中充分加热至完全反应后,重新称量剩余固体质量,仍为a g,则混合物中铁的质量分数为______ 。
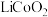 )电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
)电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
已知:
 与草酸根离子(
与草酸根离子( )结合生成较稳定的
)结合生成较稳定的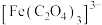 ,
,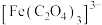 在强酸性条件下分解重新生成
在强酸性条件下分解重新生成 。
。(1)操作①的名称为
(2)溶液②中所含主要溶质为LiCl、
 ,请写出
,请写出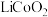 和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)
和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)(3)将溶液中的
 转化为
转化为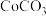 沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是
沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是(4)为证明操作④获得的
 沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入
沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入(5)取3.66 g
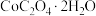 (相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为
(相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为 ,
,
(6)某同学设计如图装置测定
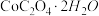 晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
A. B中应装入浓硫酸,目的是除去水蒸气
B. 利用干燥管前后质量差可计算出结晶水的含量
C. 图中半透膜可让气体通过又可防止固体粉末进入导管
D. 反应结束后,应先停止加热,一段时间后再停止通空气
(7)溶液④中,铁元素主要以
(8)
 溶液在工业上常用于电路板的蚀刻,发生的反应为
溶液在工业上常用于电路板的蚀刻,发生的反应为 。某同学向含有
。某同学向含有 、
、 和
和 三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为
三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为A. Fe B. Fe和Zn C. Fe和Cu D. Cu和Zn
(9)某a g混合粉末中含有铁、石墨、硫和碳酸氢铵,在空气中充分加热至完全反应后,重新称量剩余固体质量,仍为a g,则混合物中铁的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 室温下,通过下列实验探究NaHS溶液的性质。
实验1:向0.1 mol/L NaHS溶液中滴加几滴酚酞试剂,溶液变红
实验2:向0.1 mol/L NaHS溶液中通入过量氯气,无淡黄色沉淀产生
实验3:向0.1 mol/L NaHS溶液中加入等体积0.1 mol/L NaOH溶液充分混合
实验4:向0.1 mol/L NaHS溶液中滴加过量 溶液,产生黑色沉淀
溶液,产生黑色沉淀
下列有关说法正确的是
实验1:向0.1 mol/L NaHS溶液中滴加几滴酚酞试剂,溶液变红
实验2:向0.1 mol/L NaHS溶液中通入过量氯气,无淡黄色沉淀产生
实验3:向0.1 mol/L NaHS溶液中加入等体积0.1 mol/L NaOH溶液充分混合
实验4:向0.1 mol/L NaHS溶液中滴加过量
 溶液,产生黑色沉淀
溶液,产生黑色沉淀下列有关说法正确的是
A.实验1证明: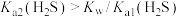 |
B.实验2证明: 不能被 不能被 氧化 氧化 |
C.实验3中所得溶液中: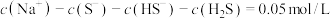 |
D.实验4反应静置后的上层清液中有 |
您最近一年使用:0次
2023-01-08更新
|
571次组卷
|
3卷引用:江苏省决胜新高考2023届高三上学期12月大联考化学试题
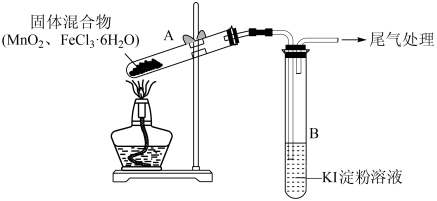
5 . 某学习小组通过如图所示装置探究 与
与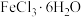 ,能否反应产生
,能否反应产生 ,已知
,已知 的升华温度为315℃。下列相关说法不正确的是
的升华温度为315℃。下列相关说法不正确的是
实验操作和现象:
 与
与 ,能否反应产生
,能否反应产生 ,已知
,已知 的升华温度为315℃。下列相关说法不正确的是
的升华温度为315℃。下列相关说法不正确的是
实验操作和现象:
| 操作 | 现象 |
| 点燃酒精灯,加热 | ⅰ.试管A中部分固体溶解,上方出现白雾,将固体产物分离得到 固体和 固体和 溶液 溶液ⅱ.稍后,试管A中产生黄色气体,管壁附着黄色液滴 ⅲ.试管B中溶液变蓝 |
A.为保证实验的严谨性,应另设置加热 的对照实验 的对照实验 |
| B.黄色气体中可能含有氯化氢、氯化铁和氯气 |
C.为进一步确认黄色气体是否含有 ,应在A、B间增加盛有 ,应在A、B间增加盛有 饱和溶液的洗气瓶 饱和溶液的洗气瓶 |
D.若实验证明A中产生 ,则其化学方程式为 ,则其化学方程式为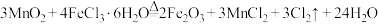 |
您最近一年使用:0次
2022-11-11更新
|
967次组卷
|
5卷引用:安徽省安庆市第二中学2022-2023学年高三上学期11月月考化学试题
安徽省安庆市第二中学2022-2023学年高三上学期11月月考化学试题 安徽省阜阳市江淮十校2022-2023学年高三上学期第二次联考化学试题(已下线)化学(山东B卷)-学易金卷:2023年高考第一次模拟考试卷湖南省娄底市第一中学2022-2023学年高三下学期开学摸底考试化学试题(已下线)T11-物质性质的探究
名校
6 . 某课外活动小组以CuSO4·5H2O和氨水为原料制备[Cu(NH3)4]SO4·H2O并进行探究。
已知:CuSO4+4NH3·H2O= [Cu(NH3)4]SO4+4H2O
[Cu(NH3)4]SO4=[Cu(NH3)4]2+ +SO
[Cu(NH3)4]2+ +4H+ =Cu2+ +4NH
(1)配制溶液:称取一定质量的CuSO4·5H2O晶体,放入锥形瓶中,溶解后滴加氨水。装置如图A所示(胶头滴管中吸有氨水)。

滴加氨水时,有浅蓝色沉淀Cu2(OH)2SO4生成;继续滴加氨水,沉淀消失,得到深蓝色的[Cu(NH3)4]SO4溶液。用离子方程式表示由浅蓝色沉淀得到深蓝色溶液的原理:_______
(2)制备晶体:将A中溶液转移至B中,析出[Cu(NH3)4]SO4·H2O晶体;将B中混合物转移至C的漏斗中,减压过滤,用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。
①晶体不采用加热烘干的原因是_______
②减压过滤时,抽气泵处于工作状态,活塞需关闭,使装置内产生负压。洗涤晶体时,应该在打开活塞的状态下,向漏斗中加入乙醇至浸没沉淀,原因是_______ 。
(3)废液回收:从含有[Cu(NH3)4]SO4、乙醇和氨水的废液中回收乙醇并获得CuSO4和(NH4)2SO4的混合溶液,应加入的试剂是_______ (填序号)
A.盐酸 B.硝酸 C.硫酸 D.氢氧化钠溶液。
已知硫酸铵溶液高温易分解,回收乙醇的实验方法为_______
A.蒸馏 B.减压蒸馏 C.萃取 D.分液
(4)用沉淀法测定晶体中SO 的含量。称取一定质量的[Cu(NH3)4]SO4·H2O晶体,加适量蒸馏水溶解,向其中滴加足量BaCl2溶液,搅拌,加热一段时间,过滤,洗涤,烘干,灼烧,称量沉淀的质量。下列有关说法正确的有_______。
的含量。称取一定质量的[Cu(NH3)4]SO4·H2O晶体,加适量蒸馏水溶解,向其中滴加足量BaCl2溶液,搅拌,加热一段时间,过滤,洗涤,烘干,灼烧,称量沉淀的质量。下列有关说法正确的有_______。
(5)新制的氨水中含氮元素的微粒有3种:NH3、NH3·H2O和NH ,其中NH3·H2O电离平衡受多种因素的影响。设计实验,控制变量,仅探究NH
,其中NH3·H2O电离平衡受多种因素的影响。设计实验,控制变量,仅探究NH 对NH3·H2O电离平衡的影响结果:
对NH3·H2O电离平衡的影响结果:
①限制试剂与仪器:0.1mol/L氨水、NH4Cl、CH3COONH4、NH4HCO3、(NH4)2CO3、量筒、烧杯、玻璃棒、药匙、天平、pH计、恒温水浴槽(可控制温度)。
②设计实验方案,拟定实验表格,完整体现实验方案。表格中“_______”处需测定的物理量为_______
③表中物理量“m(铵盐)/g”的铵盐应是_______
④按实验序号2所拟数据进行实验,忽略水电离的OH-,则一水合氮的电离度(平衡转化率)为_______ 。
已知:CuSO4+4NH3·H2O= [Cu(NH3)4]SO4+4H2O
[Cu(NH3)4]SO4=[Cu(NH3)4]2+ +SO

[Cu(NH3)4]2+ +4H+ =Cu2+ +4NH

(1)配制溶液:称取一定质量的CuSO4·5H2O晶体,放入锥形瓶中,溶解后滴加氨水。装置如图A所示(胶头滴管中吸有氨水)。

滴加氨水时,有浅蓝色沉淀Cu2(OH)2SO4生成;继续滴加氨水,沉淀消失,得到深蓝色的[Cu(NH3)4]SO4溶液。用离子方程式表示由浅蓝色沉淀得到深蓝色溶液的原理:
(2)制备晶体:将A中溶液转移至B中,析出[Cu(NH3)4]SO4·H2O晶体;将B中混合物转移至C的漏斗中,减压过滤,用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。
①晶体不采用加热烘干的原因是
②减压过滤时,抽气泵处于工作状态,活塞需关闭,使装置内产生负压。洗涤晶体时,应该在打开活塞的状态下,向漏斗中加入乙醇至浸没沉淀,原因是
(3)废液回收:从含有[Cu(NH3)4]SO4、乙醇和氨水的废液中回收乙醇并获得CuSO4和(NH4)2SO4的混合溶液,应加入的试剂是
A.盐酸 B.硝酸 C.硫酸 D.氢氧化钠溶液。
已知硫酸铵溶液高温易分解,回收乙醇的实验方法为
A.蒸馏 B.减压蒸馏 C.萃取 D.分液
(4)用沉淀法测定晶体中SO
 的含量。称取一定质量的[Cu(NH3)4]SO4·H2O晶体,加适量蒸馏水溶解,向其中滴加足量BaCl2溶液,搅拌,加热一段时间,过滤,洗涤,烘干,灼烧,称量沉淀的质量。下列有关说法正确的有_______。
的含量。称取一定质量的[Cu(NH3)4]SO4·H2O晶体,加适量蒸馏水溶解,向其中滴加足量BaCl2溶液,搅拌,加热一段时间,过滤,洗涤,烘干,灼烧,称量沉淀的质量。下列有关说法正确的有_______。| A.滴加足量BaCl2溶液能降低实验数值偏低的可能性 |
| B.检验沉淀已经洗净的方法为取少量最后一次洗涤液于试管中,向其中加入BaCl2溶液,无白色沉淀生成,证明沉淀已洗净 |
| C.洗涤后滤纸和固体一起灼烧,以免固体附着在滤纸上,造成损失。 |
| D.已知[Cu(NH3)4]2+ 为平面四边形结构,中心Cu2+不可能是sp3杂化 |
 ,其中NH3·H2O电离平衡受多种因素的影响。设计实验,控制变量,仅探究NH
,其中NH3·H2O电离平衡受多种因素的影响。设计实验,控制变量,仅探究NH 对NH3·H2O电离平衡的影响结果:
对NH3·H2O电离平衡的影响结果:①限制试剂与仪器:0.1mol/L氨水、NH4Cl、CH3COONH4、NH4HCO3、(NH4)2CO3、量筒、烧杯、玻璃棒、药匙、天平、pH计、恒温水浴槽(可控制温度)。
②设计实验方案,拟定实验表格,完整体现实验方案。表格中“_______”处需测定的物理量为
| 物理量 实验序号 | V(0.1mol/L氨水)/mL | m(铵盐)/g | t/℃ | _______ |
| 1 | 100 | 0 | 25 | b |
| 2 | 100 | a | 25 | c |
④按实验序号2所拟数据进行实验,忽略水电离的OH-,则一水合氮的电离度(平衡转化率)为
您最近一年使用:0次
2022-12-05更新
|
510次组卷
|
4卷引用:广东省四校2022-2023学年高三联考化学试题
名校
7 . 实验室以CuSO4·5H2O为原料制备[Cu(NH3)4]SO4·H2O并进行定量分析。
已知:CuSO4+4NH3·H2O=[Cu(NH3)4]SO4+4H2O、[Cu(NH3)4]2+ +4H+ =Cu2+ +4
(1)配制溶液:称取一定质量的CuSO4·5H2O晶体,放入锥形瓶中,溶解后滴加氨水。装置如图A所示(胶头滴管中吸有氨水)。

滴加氨水时,有浅蓝色沉淀Cu2(OH)2SO4生成;继续滴加氨水,沉淀消失,得到深蓝色的[Cu(NH3)4]SO4溶液。用离子方程式表示由浅蓝色沉淀得到深蓝色溶液的原理:_______ 。
(2)制备晶体:将A中溶液转移至B中,析出[Cu(NH3)4]SO4·H2O晶体;将B中混合物转移至C的漏斗中,减压过滤,用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。
①晶体不采用加热烘干的原因是_______ 。
②减压过滤时,抽气泵处于工作状态,活塞需关闭,使装置内产生负压。洗涤晶体时,为了使乙醇与晶体充分接触,提高洗涤的效果,应该在活塞_______ (填“打开”或“关闭”)的状态下,向漏斗中加入乙醇至浸没沉淀。
(3)废液回收:从含有[Cu(NH3)4]SO4、乙醇和一水合氨的废液中回收乙醇并获得CuSO4和(NH4)2SO4的混合溶液,应加入的试剂是_______ (填名称)。已知硫酸铵溶液高温易分解,回收乙醇的实验方法为_______ 。
(4)用沉淀法测定晶体中 的含量。称取一定质量的[Cu(NH3)4]SO4·H2O晶体,加适量蒸馏水溶解,向其中滴加足量BaCl2溶液,搅拌,加热一段时间,过滤,洗涤,灼烧烘干,称量沉淀的质量。下列有关说法正确的有
的含量。称取一定质量的[Cu(NH3)4]SO4·H2O晶体,加适量蒸馏水溶解,向其中滴加足量BaCl2溶液,搅拌,加热一段时间,过滤,洗涤,灼烧烘干,称量沉淀的质量。下列有关说法正确的有_______ 。
A.检验沉淀已经洗净的方法为取少量最后一次洗涤液于试管中,向其中加入BaCl2溶液,无白色沉淀生成,证明沉淀已洗净。
B.洗涤后滤纸和固体一起灼烧,以免固体附着在滤纸上,造成损失。
C.加热一段时间有助与减少硫酸钡沉淀吸附杂质。
(5)探究小组用滴定法测定原料中CuSO4·5H2O(相对分子质量为250)的含量。取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗b mL EDTA溶液。滴定反应如下:Cu2+ +H2Y2-=CuY2- +2H+。
写出计算CuSO4·5H2O质量分数的表达式:ω=_______ 。
已知:CuSO4+4NH3·H2O=[Cu(NH3)4]SO4+4H2O、[Cu(NH3)4]2+ +4H+ =Cu2+ +4

(1)配制溶液:称取一定质量的CuSO4·5H2O晶体,放入锥形瓶中,溶解后滴加氨水。装置如图A所示(胶头滴管中吸有氨水)。

滴加氨水时,有浅蓝色沉淀Cu2(OH)2SO4生成;继续滴加氨水,沉淀消失,得到深蓝色的[Cu(NH3)4]SO4溶液。用离子方程式表示由浅蓝色沉淀得到深蓝色溶液的原理:
(2)制备晶体:将A中溶液转移至B中,析出[Cu(NH3)4]SO4·H2O晶体;将B中混合物转移至C的漏斗中,减压过滤,用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。
①晶体不采用加热烘干的原因是
②减压过滤时,抽气泵处于工作状态,活塞需关闭,使装置内产生负压。洗涤晶体时,为了使乙醇与晶体充分接触,提高洗涤的效果,应该在活塞
(3)废液回收:从含有[Cu(NH3)4]SO4、乙醇和一水合氨的废液中回收乙醇并获得CuSO4和(NH4)2SO4的混合溶液,应加入的试剂是
(4)用沉淀法测定晶体中
 的含量。称取一定质量的[Cu(NH3)4]SO4·H2O晶体,加适量蒸馏水溶解,向其中滴加足量BaCl2溶液,搅拌,加热一段时间,过滤,洗涤,灼烧烘干,称量沉淀的质量。下列有关说法正确的有
的含量。称取一定质量的[Cu(NH3)4]SO4·H2O晶体,加适量蒸馏水溶解,向其中滴加足量BaCl2溶液,搅拌,加热一段时间,过滤,洗涤,灼烧烘干,称量沉淀的质量。下列有关说法正确的有A.检验沉淀已经洗净的方法为取少量最后一次洗涤液于试管中,向其中加入BaCl2溶液,无白色沉淀生成,证明沉淀已洗净。
B.洗涤后滤纸和固体一起灼烧,以免固体附着在滤纸上,造成损失。
C.加热一段时间有助与减少硫酸钡沉淀吸附杂质。
(5)探究小组用滴定法测定原料中CuSO4·5H2O(相对分子质量为250)的含量。取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗b mL EDTA溶液。滴定反应如下:Cu2+ +H2Y2-=CuY2- +2H+。
写出计算CuSO4·5H2O质量分数的表达式:ω=
您最近一年使用:0次
解题方法
8 . 化合物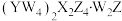 为无色柱状晶体,受热易分解,已知
为无色柱状晶体,受热易分解,已知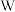 、
、 、
、 、
、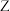 的原子序数依次增大,其和为22,
的原子序数依次增大,其和为22, 、
、 、
、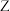 为同一周期相邻元素。可利用下图装置检验该化合物分解出的相同元素组成的不同产物。
为同一周期相邻元素。可利用下图装置检验该化合物分解出的相同元素组成的不同产物。
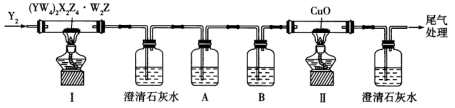
下列说法错误的是
 为无色柱状晶体,受热易分解,已知
为无色柱状晶体,受热易分解,已知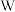 、
、 、
、 、
、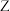 的原子序数依次增大,其和为22,
的原子序数依次增大,其和为22, 、
、 、
、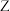 为同一周期相邻元素。可利用下图装置检验该化合物分解出的相同元素组成的不同产物。
为同一周期相邻元素。可利用下图装置检验该化合物分解出的相同元素组成的不同产物。
下列说法错误的是
A.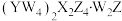 属于含有共价键的离子化合物 属于含有共价键的离子化合物 |
B. 、 、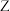 两种元素的简单氢化物的稳定性: 两种元素的简单氢化物的稳定性: |
C.反应开始前通入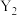 ,可以避免装置中的空气干扰产物的检验 ,可以避免装置中的空气干扰产物的检验 |
D.装置中两处澄清石灰水都变浑浊,证明分解产物中含有两种由 、 、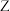 组成的物质 组成的物质 |
您最近一年使用:0次
解题方法
9 . I.空气污染问题日益引起全民关注。工业生产中产生的SO2、NO等为主要污染物。根据你所学化学知识完成下列问题:
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物。下列说法不正确的是____ (填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)SO2为重要的含硫化合物,是形成酸雨的主要污染物之一。在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用如图所示气体发生装置中的____ (填下列序号字母)。
a. b.
b.  c.
c.  d.
d.
(3)为研究SO2的性质,如图在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不换触纸条火准)。下列有关说法正确的是____ 。

II.硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需要处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中的二氧化硫的含量,采用以下方案:
实验步骤如图流程图所示:

(4)步骤①中反应的离子方程式为____ 。
(5)步骤②中Ba(OH)2是否足量的判断方法是____ 。
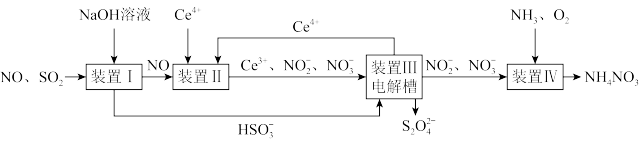
III.工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和中NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如图(Ce为铈元素)
请回答下列问题:
(6)装置II中的反应在酸性条件下进行,写出NO被氧化为NO 的离子方程式
的离子方程式____ 。
(7)已知进入装置IV的溶液中NO 的浓度为0.75mol/L,要使1m3该溶液中的NO
的浓度为0.75mol/L,要使1m3该溶液中的NO 完全转化为NH4NO3,需至少向装置IV中通入标准状况下的O2的体积为
完全转化为NH4NO3,需至少向装置IV中通入标准状况下的O2的体积为____ L。
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物。下列说法不正确的是
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)SO2为重要的含硫化合物,是形成酸雨的主要污染物之一。在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用如图所示气体发生装置中的
a.
 b.
b.  c.
c.  d.
d.
(3)为研究SO2的性质,如图在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不换触纸条火准)。下列有关说法正确的是

| A.蓝色石蕊试纸先变红后褪色 |
| B.湿润的品红试纸、蘸有KMnO4溶液的滤纸均褪色证明SO2具有漂白性 |
| C.湿润的淀粉KI一试纸未变蓝说明SO2的氧化性强于I2 |
| D.NaOH溶液可用于除去实验中多余的SO2 |
II.硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需要处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中的二氧化硫的含量,采用以下方案:
实验步骤如图流程图所示:

(4)步骤①中反应的离子方程式为
(5)步骤②中Ba(OH)2是否足量的判断方法是
III.工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和中NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如图(Ce为铈元素)

请回答下列问题:
(6)装置II中的反应在酸性条件下进行,写出NO被氧化为NO
 的离子方程式
的离子方程式(7)已知进入装置IV的溶液中NO
 的浓度为0.75mol/L,要使1m3该溶液中的NO
的浓度为0.75mol/L,要使1m3该溶液中的NO 完全转化为NH4NO3,需至少向装置IV中通入标准状况下的O2的体积为
完全转化为NH4NO3,需至少向装置IV中通入标准状况下的O2的体积为
您最近一年使用:0次
名校
10 . Ⅰ.将50mL 0.50mol/L盐酸和50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热。回答下列问题:
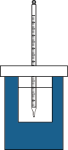
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_______ 。
(2)中和热测定实验中,下列说法不正确的是_______。
(3)他们记录的实验数据如下:
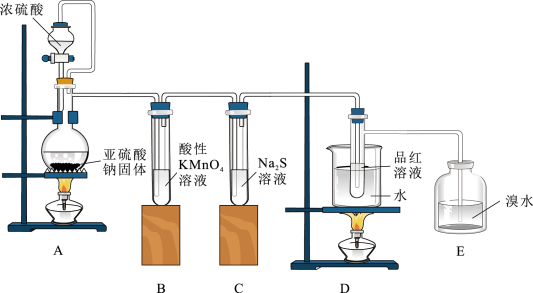
(已知: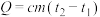 ,反应后溶液的比热容c为4.2kJ/(℃·kg),各物质的密度均为
,反应后溶液的比热容c为4.2kJ/(℃·kg),各物质的密度均为 )
)
①根据实验结果计算出NaOH溶液与HCl溶液反应的中和热
_______  。
。
②若实验过程中,内筒未加杯盖,求得的中和反应反应热数值_______ (填“偏大”“偏小”或“无影响”)。
③若用醋酸代替HCl做实验,对测定结果_______ (填“偏大”“偏小”或“无影响”)。
Ⅱ.某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
请回答下列问题:
(4)装置A中的烧瓶内固体不可选用_______(填字母)。
(5)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
B、D、E从左至右依次选择的装置顺序为_______ 。
(6)氯气和氨气在常温下混合就能发生反应,现象为产生白烟,则C中反应的化学方程式为_______ 。
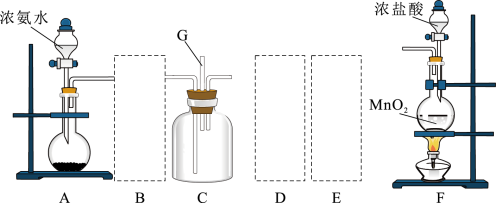
(7)某研究小组设计了一套制备及检验 部分性质的装置:
部分性质的装置:
实验过程中观察到装置B中的现象是_______ ,反应的离子方程式为_______ ,C装置证明 具有
具有_______ 性。
(8)E中的化学反应方程式为_______ 。
(9)D装置的作用是_______ 。

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)中和热测定实验中,下列说法不正确的是_______。
| A.改用60mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液进行反应,求出的中和热数值和原来不同 |
| B.酸碱混合时,量筒中NaOH溶液应分三次倒入小烧杯中 |
| C.所加NaOH溶液过量,目的是保证盐酸完全被中和 |
| D.装置中隔热层的作用是保温隔热、减少热量损失 |
| 实验用品 | 溶液温度 | 中和热 | |||
 |  |  | |||
| ① | 50mL  NaOH溶液 NaOH溶液 | 50mL  HCl 溶液 HCl 溶液 | 20℃ | 23.3℃ | |
| ② | 50mL  NaOH溶液 NaOH溶液 | 50mL  HCl 溶液 HCl 溶液 | 20℃ | 23.5℃ | |
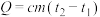 ,反应后溶液的比热容c为4.2kJ/(℃·kg),各物质的密度均为
,反应后溶液的比热容c为4.2kJ/(℃·kg),各物质的密度均为 )
)①根据实验结果计算出NaOH溶液与HCl溶液反应的中和热

 。
。②若实验过程中,内筒未加杯盖,求得的中和反应反应热数值
③若用醋酸代替HCl做实验,对测定结果
Ⅱ.某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。

请回答下列问题:
(4)装置A中的烧瓶内固体不可选用_______(填字母)。
| A.碱石灰 | B.烧碱 | C.生石灰 | D.五氧化二磷 |
| 备选装置 | ||
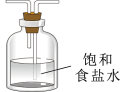 |  | 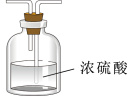 |
| Ⅰ | Ⅱ | Ⅲ |
(6)氯气和氨气在常温下混合就能发生反应,现象为产生白烟,则C中反应的化学方程式为
(7)某研究小组设计了一套制备及检验
 部分性质的装置:
部分性质的装置:
实验过程中观察到装置B中的现象是
 具有
具有(8)E中的化学反应方程式为
(9)D装置的作用是
您最近一年使用:0次
2022-05-18更新
|
530次组卷
|
2卷引用:黑龙江省哈尔滨市第六中学2021-2022学年高一下学期期中考试(选考)化学试题



