名校
1 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)在 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取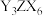 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:_______ 。
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性: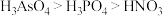
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。

利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是_______ (填编号)。
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在
 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取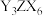 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
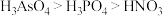
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近一年使用:0次
2022-07-29更新
|
1157次组卷
|
3卷引用:湖北省华中师范大学第一附属中学2021-2022学年高一上学期期末考试化学试题
湖北省华中师范大学第一附属中学2021-2022学年高一上学期期末考试化学试题浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题(已下线)第四章《物质结构 元素周期律》能力提升单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)
解题方法
2 . 已知A、B、C、D、E、F是原子序数依次增大的六种短周期主族元素,A与B能形成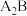 和
和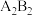 两种常见共价化合物,A与C位于相邻主族,B与E位于同一主族,D是同周期中简单离子半径最小的元素。回答下列问题:
两种常见共价化合物,A与C位于相邻主族,B与E位于同一主族,D是同周期中简单离子半径最小的元素。回答下列问题:
(1)C在元素周期表中的位置是_______ 。
(2)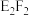 的电子式为
的电子式为_______ 。
(3)D的最高价氧化物对应的水化物与F的最高价氧化物对应的水化物反应的离子方程式为_______ 。
(4)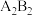 和
和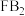 是市场上较好的消毒剂,等质量的
是市场上较好的消毒剂,等质量的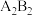 和
和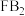 分别与足量二氧化硫反应时,消耗二氧化硫的质量之比为
分别与足量二氧化硫反应时,消耗二氧化硫的质量之比为_______ 。
(5)已知W、X、Y、Z四种物质中均含有上述元素中的某一种,M、X为单质,其余均为化合物,它们之间存在如图所示的转化关系(反应条件略)。
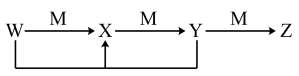
①Z的化学式为_______ 。
②上述五种物质所含的元素中,原子半径最大的是_______ (填元素符号)。
③C元素形成的单质与M在海水中可以形成原电池,其正极的电极反应式为_______ 。
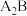 和
和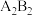 两种常见共价化合物,A与C位于相邻主族,B与E位于同一主族,D是同周期中简单离子半径最小的元素。回答下列问题:
两种常见共价化合物,A与C位于相邻主族,B与E位于同一主族,D是同周期中简单离子半径最小的元素。回答下列问题:(1)C在元素周期表中的位置是
(2)
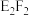 的电子式为
的电子式为(3)D的最高价氧化物对应的水化物与F的最高价氧化物对应的水化物反应的离子方程式为
(4)
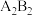 和
和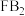 是市场上较好的消毒剂,等质量的
是市场上较好的消毒剂,等质量的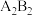 和
和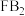 分别与足量二氧化硫反应时,消耗二氧化硫的质量之比为
分别与足量二氧化硫反应时,消耗二氧化硫的质量之比为(5)已知W、X、Y、Z四种物质中均含有上述元素中的某一种,M、X为单质,其余均为化合物,它们之间存在如图所示的转化关系(反应条件略)。

①Z的化学式为
②上述五种物质所含的元素中,原子半径最大的是
③C元素形成的单质与M在海水中可以形成原电池,其正极的电极反应式为
您最近一年使用:0次
名校
3 . 六氟锑酸钠(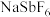 )是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等.中南大学的杨天足教授提出了一种在水溶液中由锑白(主要含
)是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等.中南大学的杨天足教授提出了一种在水溶液中由锑白(主要含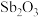 、
、 和
和 、
、 、
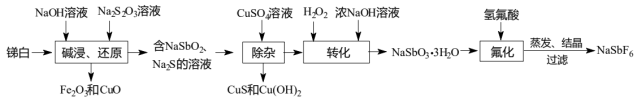
、 等)合成六氟锑酸钠的工艺流程如图所示:
等)合成六氟锑酸钠的工艺流程如图所示:
已知:①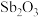 的性质与
的性质与 类似;②
类似;② 可溶于Na2S溶液;③
可溶于Na2S溶液;③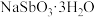 晶体难溶于水。请回答下列问题:
晶体难溶于水。请回答下列问题:
(1)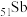 在元素周期表中的位置是
在元素周期表中的位置是_______ ,属于______ 区元素
(2)“碱浸、还原”时,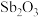 发生反应的离子方程式为
发生反应的离子方程式为_______ ;若 与
与 反应计量关系为2∶1,则氧化产物为
反应计量关系为2∶1,则氧化产物为_______
(3)“除杂”时,当溶液中出现蓝色沉淀,立即停止加入 溶液,测得此时溶液的
溶液,测得此时溶液的 ,则此时溶液中残留的
,则此时溶液中残留的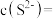
_______ [结果保留两位有效数字,常温下, ,
,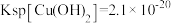 ]
]
(4)“转化”时控温约 的原因是
的原因是_______
(5)“氟化”中发生的反应化学方程式为_______ ,此过程不能选择玻璃仪器,是因为_______
(6)氟锑酸化学式为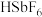 ,酸性比纯硫酸要强
,酸性比纯硫酸要强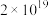 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成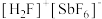 ,
,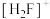 离子的空间构型为
离子的空间构型为_______
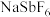 )是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等.中南大学的杨天足教授提出了一种在水溶液中由锑白(主要含
)是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等.中南大学的杨天足教授提出了一种在水溶液中由锑白(主要含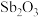 、
、 和
和 、
、 、
、 等)合成六氟锑酸钠的工艺流程如图所示:
等)合成六氟锑酸钠的工艺流程如图所示:
已知:①
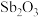 的性质与
的性质与 类似;②
类似;② 可溶于Na2S溶液;③
可溶于Na2S溶液;③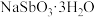 晶体难溶于水。请回答下列问题:
晶体难溶于水。请回答下列问题:(1)
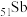 在元素周期表中的位置是
在元素周期表中的位置是(2)“碱浸、还原”时,
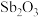 发生反应的离子方程式为
发生反应的离子方程式为 与
与 反应计量关系为2∶1,则氧化产物为
反应计量关系为2∶1,则氧化产物为(3)“除杂”时,当溶液中出现蓝色沉淀,立即停止加入
 溶液,测得此时溶液的
溶液,测得此时溶液的 ,则此时溶液中残留的
,则此时溶液中残留的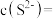
 ,
,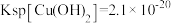 ]
](4)“转化”时控温约
 的原因是
的原因是(5)“氟化”中发生的反应化学方程式为
(6)氟锑酸化学式为
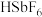 ,酸性比纯硫酸要强
,酸性比纯硫酸要强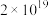 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成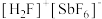 ,
,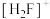 离子的空间构型为
离子的空间构型为
您最近一年使用:0次
2022-05-06更新
|
396次组卷
|
2卷引用:湖北省龙泉中学,宜昌一中,荆州中学等四校2021-2022学年高三下学期模拟联考化学试题
名校
4 . A、B、C、D、E、F、G为中学化学常见物质,它们之间有如图转化关系(反应条件已略去)。已知:A、C、D、E均含有同种非金属元素M,A为气态氢化物;G是一种紫红色的金属单质;B是空气的组成成分,在空气中占比约为21%。根据学知识,按要求回答下列问题:

Ⅰ.若A具有臭鸡蛋气味,且能与C反应生成一种淡黄色非金属单质,反应①为非氧化还原反应,反应②为E的浓溶液与G反应,则:
(1)M元素在元素周期表中的位置为_______ 。
(2)写出反应②的化学方程式:_______ ,该反应中体现了E的浓溶液的强氧化性和_______ 性。
(3)将C通入足量溴水中,发生反应的离子方程式为_______ ;将C通入少量品红溶液中可观察到的现象为_______ 。
Ⅱ.若光照条件下,E的浓溶液易分解得到B、D、F3种物质;大量排放汽车尾气中的C、D会导致光化学烟雾,已知:反应②为E的稀溶液与G反应。
(4)写出A+B→C+F的化学方程式:_______ 。
(5)常温下,将60mL C、D的混合气体与30mL B同时通入水中,充分反应后,剩余7.5mL气体,则60mL混合气体中C的体积分数可能为_______ (填标号)。
①15.00% ②25.00% ③41.25% ④68.75%

Ⅰ.若A具有臭鸡蛋气味,且能与C反应生成一种淡黄色非金属单质,反应①为非氧化还原反应,反应②为E的浓溶液与G反应,则:
(1)M元素在元素周期表中的位置为
(2)写出反应②的化学方程式:
(3)将C通入足量溴水中,发生反应的离子方程式为
Ⅱ.若光照条件下,E的浓溶液易分解得到B、D、F3种物质;大量排放汽车尾气中的C、D会导致光化学烟雾,已知:反应②为E的稀溶液与G反应。
(4)写出A+B→C+F的化学方程式:
(5)常温下,将60mL C、D的混合气体与30mL B同时通入水中,充分反应后,剩余7.5mL气体,则60mL混合气体中C的体积分数可能为
①15.00% ②25.00% ③41.25% ④68.75%
您最近一年使用:0次
2022-05-20更新
|
575次组卷
|
3卷引用:河南省安阳市2021-2022学年高一下学期阶段性考试(四)化学试题
河南省安阳市2021-2022学年高一下学期阶段性考试(四)化学试题河南省许平汝漯2021-2022学年高一下学期5月大联考化学试题(已下线)第15练 实验综合题与无机综合题-2022年【暑假分层作业】高一化学(人教版2019必修第二册)
名校
解题方法
5 . 镓是一种低熔点、高沸点的稀有金属,有“电子工业脊梁”的美誉,被广泛应用到光电子工业和微波通信工业。回答下列问题:
(1)镓 的原子结构示意图为
的原子结构示意图为 ,镓元素在元素周期表中的位置是
,镓元素在元素周期表中的位置是_______ 。
(2) 的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是
的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是_______ (填“共价化合物”或“离子化合物”)。
(3)已知 与
与 同周期,
同周期, 与N同主族。
与N同主族。
①用原子结构理论推测, 中
中 元素的化合价为
元素的化合价为_______ ;
②下列事实不能用元素周期律解释的是_______ (填标序号);
a.原子半径: b.热稳定性:
b.热稳定性: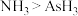
c.碱性: d.酸性:
d.酸性: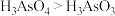
(4) 是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中。一种镍催化法生产
是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中。一种镍催化法生产 的工艺如图。
的工艺如图。

①“热转化”时 转化为
转化为 的化学方程式是
的化学方程式是_______ 。
②某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:
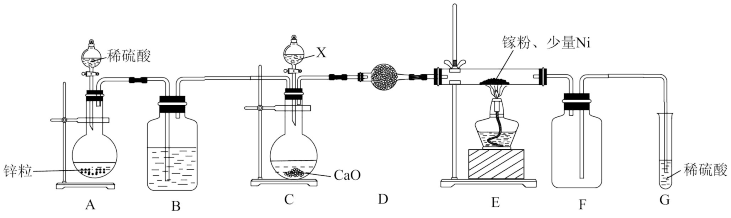
仪器X中的试剂是_______ ;加热前需先通入一段时间的 ,原因是
,原因是_______ ;装置G的作用是_______ 。
(1)镓
 的原子结构示意图为
的原子结构示意图为 ,镓元素在元素周期表中的位置是
,镓元素在元素周期表中的位置是(2)
 的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是
的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是(3)已知
 与
与 同周期,
同周期, 与N同主族。
与N同主族。①用原子结构理论推测,
 中
中 元素的化合价为
元素的化合价为②下列事实不能用元素周期律解释的是
a.原子半径:
 b.热稳定性:
b.热稳定性: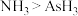
c.碱性:
 d.酸性:
d.酸性: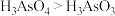
(4)
 是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中。一种镍催化法生产
是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中。一种镍催化法生产 的工艺如图。
的工艺如图。
①“热转化”时
 转化为
转化为 的化学方程式是
的化学方程式是②某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:

仪器X中的试剂是
 ,原因是
,原因是
您最近一年使用:0次
解题方法
6 . 上海有机化学研究所施世良课题组以Ni(cod)2为催化剂实现了叔醇的手性合成。
(1)Ni在元素周期表中的位置是_______ ,写出其基态原子的价电子排布式:_______ 。
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。
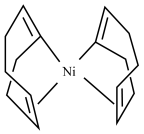
①与碳元素同周期且电负性大于碳的元素有_______ 种。
②Ni(cod)2分子内存在的作用力有_______ (填序号)。
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
③Ni(cod)2分子中碳原子的杂化方式为_______ 。
(3)葡萄糖(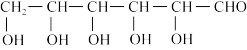 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 _______ 。
(4)下图三种叔醇的沸点从高到低的顺序及原因是_______ 。

(5)红银矿NiAs晶体结构如图所示:
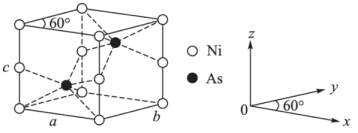
①Ni原子的配位数为_______ 。
②两个As原子的原子分数坐标依次为( ,
, ,
, )和
)和_______ 。
③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为_______ mol-1(用含m、n和p的代数式表示)。
(1)Ni在元素周期表中的位置是
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。

①与碳元素同周期且电负性大于碳的元素有
②Ni(cod)2分子内存在的作用力有
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
③Ni(cod)2分子中碳原子的杂化方式为
(3)葡萄糖(
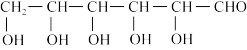 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 (4)下图三种叔醇的沸点从高到低的顺序及原因是

(5)红银矿NiAs晶体结构如图所示:

①Ni原子的配位数为
②两个As原子的原子分数坐标依次为(
 ,
, ,
, )和
)和③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为
您最近一年使用:0次
解题方法
7 . A、B、C、D、E、F为短周期元素,其中B的原子序数最小,它们的最高正价与原子半径关系如图所示,回答下列问题:

(1)B在元素周期表中的位置为_______ 。
(2)C与D可形成一种硬度很大的新型结构材料,其化学式为_______ 。
(3)同主族元素对应的单质或化合物在结构性质上体现相似性和递变性,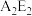 的电子式为
的电子式为_______ ;向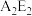 溶液中滴加稀盐酸,发生反应的化学方程式为
溶液中滴加稀盐酸,发生反应的化学方程式为_______ 。
(4)元素周期表中某一元素的性质与它左上方或右下方的另一元素的性质相似,称为对角线规则,则A的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物反应的离子方程式为_______ 。
(5)D与F能形成一种三角锥形分子,该物质常温下是一种有刺激性气味的液体,与水反应能生成一种单质气体和两种酸,其中一种酸常用于杀菌、消毒,该物质与水反应的化学方程式为_______ 。

(1)B在元素周期表中的位置为
(2)C与D可形成一种硬度很大的新型结构材料,其化学式为
(3)同主族元素对应的单质或化合物在结构性质上体现相似性和递变性,
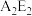 的电子式为
的电子式为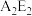 溶液中滴加稀盐酸,发生反应的化学方程式为
溶液中滴加稀盐酸,发生反应的化学方程式为(4)元素周期表中某一元素的性质与它左上方或右下方的另一元素的性质相似,称为对角线规则,则A的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物反应的离子方程式为
(5)D与F能形成一种三角锥形分子,该物质常温下是一种有刺激性气味的液体,与水反应能生成一种单质气体和两种酸,其中一种酸常用于杀菌、消毒,该物质与水反应的化学方程式为
您最近一年使用:0次
8 . Ⅰ.由硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、Al2O3和SiO2)得到绿矾(FeSO4·7H2O),然后制取透明氧化铁颜料的流程如下:

已知:①透明氧化铁又称纳米氧化铁,粒子直径微小(10~90 nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
②Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)FeS2的电子式为_______ 。
(2)“滤渣”中的主要成分是_______ 。
(3)流程中“ ”环节的目的是
”环节的目的是_______ 。
(4)“还原”过程中涉及的离子方程式为_______ 。
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以_______ 。
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:

称取3.47 g透明氧化铁,用稀硫酸溶解并定容至1 L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红的质量分数为_______ %(保留小数点后一位)。
Ⅱ.重晶石(BaSO4)作为原料制备金属钡及其他含钡化合物的方法如下图:

完成下列填空:
(7)Ba在元素周期表中的位置为_______ ,最外层电子的电子云形状是_______ 。图中涉及的第二周期元素电负性由大到小的顺序是_______ (用元素符号表示),可以判断其中两种元素非金属性强弱的反应是_______ (选填流程中的反应编号)。
(8)配平BaS与稀硝酸反应的化学方程式:_______
_______BaS+_______HNO3=_______Ba(NO3)2+_______S+_______NO↑+_______H2O

已知:①透明氧化铁又称纳米氧化铁,粒子直径微小(10~90 nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
②Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)FeS2的电子式为
(2)“滤渣”中的主要成分是
(3)流程中“
 ”环节的目的是
”环节的目的是(4)“还原”过程中涉及的离子方程式为
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:

称取3.47 g透明氧化铁,用稀硫酸溶解并定容至1 L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红的质量分数为
Ⅱ.重晶石(BaSO4)作为原料制备金属钡及其他含钡化合物的方法如下图:

完成下列填空:
(7)Ba在元素周期表中的位置为
(8)配平BaS与稀硝酸反应的化学方程式:
_______BaS+_______HNO3=_______Ba(NO3)2+_______S+_______NO↑+_______H2O
您最近一年使用:0次
名校
解题方法
9 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请回答下列问题。
(1)A在元素周期表中的位置为___________ ,画出基态B原子的轨道表示式___________ 。
(2)B的简单气态氢化物的沸点___________ (填“高于”或“低于”)PH3,原因是___________ 。
(3)A、B、C三种元素的电负性由高到低的排列次序为___________ (用元素符号表示)。
(4)已知元素A、B形成的 链状分子中所有的原子都满足8电子稳定结构,则其分子中
链状分子中所有的原子都满足8电子稳定结构,则其分子中 键与
键与 键数目之比为
键数目之比为___________ 。
(5)G元素可形成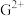 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是___________ 。
(6)短周期元素 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素 、
、 的电负性分别为1.5和3.0,预测它们形成的化合物是
的电负性分别为1.5和3.0,预测它们形成的化合物是___________ (填“离子”或“共价”)化合物。推测 的最高价氧化物对应的水化物
的最高价氧化物对应的水化物___________ (填“能”或“不能”)与 的最高价氧化物对应水化物发生反应。
的最高价氧化物对应水化物发生反应。
| A | 原子核外有6个电子 |
| B | 原子序数比 大1 大1 |
| C | 基态原子中 电子总数与p电子总数相等 电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子价层电子排布式为3s23p1 |
| F | 基态原子的最外层p 轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 生活中使用最多的一种金属,其高价氯化物的盐溶液常用于刻蚀铜制印刷电路板 |
(2)B的简单气态氢化物的沸点
(3)A、B、C三种元素的电负性由高到低的排列次序为
(4)已知元素A、B形成的
 链状分子中所有的原子都满足8电子稳定结构,则其分子中
链状分子中所有的原子都满足8电子稳定结构,则其分子中 键与
键与 键数目之比为
键数目之比为(5)G元素可形成
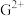 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是(6)短周期元素
 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素 、
、 的电负性分别为1.5和3.0,预测它们形成的化合物是
的电负性分别为1.5和3.0,预测它们形成的化合物是 的最高价氧化物对应的水化物
的最高价氧化物对应的水化物 的最高价氧化物对应水化物发生反应。
的最高价氧化物对应水化物发生反应。
您最近一年使用:0次
2022-07-25更新
|
981次组卷
|
3卷引用:陕西省西安市莲湖区2021-2022学年高二下学期期末质量检测化学(B卷)试题
名校
解题方法
10 . 回答下列问题
(1)乙醛酸是一种重要的化工中间体,可果用如下图所示的电化学装置合成。图中的双极膜中间层中的 解离为
解离为 和
和 ,并在直流电场作用下分别问两极迁移。
,并在直流电场作用下分别问两极迁移。
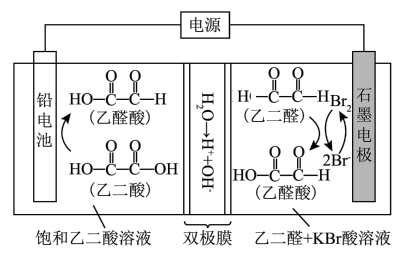
①阴极的电极反应式:___________ 。
②制得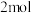 乙醛酸,理论上外电路中迁移了
乙醛酸,理论上外电路中迁移了___________ mol电子
(2)甲醇制烯烃是一项非石油路线烯烃生产技术,可减少我国对石油进口的依赖度。甲醇也可通过煤的液化过程获得,该过程是___________ (填“物理"或“化学")变化。
(3)甲醇制烯烃的反应有3CH3OH(g)=C3H6(g)+3H2O(g)、4CH3OH(g)=C4H8(g)+4H2O(g),烯烃产物之间存在如下转化关系:
反应Ⅰ:2C3H6(g) 3C2H4(g) ΔH1=+117 kJ·mol-1
3C2H4(g) ΔH1=+117 kJ·mol-1
反应Ⅱ:3C4H8(g) 4C3H6(g) ΔH2=+78 kJ·mol-1
4C3H6(g) ΔH2=+78 kJ·mol-1
反应Ⅲ:C4H8(g) 2C2H4(g) ΔH3
2C2H4(g) ΔH3
反应达平衡时,三种组分的物质的量分数x随温度T的变化关系如图所示。

①反应Ⅲ的ΔH3=___________ kJ·mol-1。
②图中曲线a代表的组分是___________ ,700K后,曲线a下降的原因是___________ 。
③图中P点坐标为(900,0.48),900 K时,反应III的物质的量分数平衡常数Kx=___________ (以物质的量分数代替浓度计算)。
(4)将0.1 mol CO2和0.3 mol H2充入0.5 L恒容密闭容器中,分别在两种不同催化剂Ⅰ、Ⅱ下发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),相同时间内CO2的转化率随温度变化曲线如图所示。
CH3OH(g)+H2O(g),相同时间内CO2的转化率随温度变化曲线如图所示。

①催化剂Ⅰ、Ⅱ中催化效率较高的是___________ 。
②随温度的升高,CO2的转化率先增大后减小,理由是___________ 。
(1)乙醛酸是一种重要的化工中间体,可果用如下图所示的电化学装置合成。图中的双极膜中间层中的
 解离为
解离为 和
和 ,并在直流电场作用下分别问两极迁移。
,并在直流电场作用下分别问两极迁移。
①阴极的电极反应式:
②制得
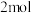 乙醛酸,理论上外电路中迁移了
乙醛酸,理论上外电路中迁移了(2)甲醇制烯烃是一项非石油路线烯烃生产技术,可减少我国对石油进口的依赖度。甲醇也可通过煤的液化过程获得,该过程是
(3)甲醇制烯烃的反应有3CH3OH(g)=C3H6(g)+3H2O(g)、4CH3OH(g)=C4H8(g)+4H2O(g),烯烃产物之间存在如下转化关系:
反应Ⅰ:2C3H6(g)
 3C2H4(g) ΔH1=+117 kJ·mol-1
3C2H4(g) ΔH1=+117 kJ·mol-1反应Ⅱ:3C4H8(g)
 4C3H6(g) ΔH2=+78 kJ·mol-1
4C3H6(g) ΔH2=+78 kJ·mol-1反应Ⅲ:C4H8(g)
 2C2H4(g) ΔH3
2C2H4(g) ΔH3反应达平衡时,三种组分的物质的量分数x随温度T的变化关系如图所示。

①反应Ⅲ的ΔH3=
②图中曲线a代表的组分是
③图中P点坐标为(900,0.48),900 K时,反应III的物质的量分数平衡常数Kx=
(4)将0.1 mol CO2和0.3 mol H2充入0.5 L恒容密闭容器中,分别在两种不同催化剂Ⅰ、Ⅱ下发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),相同时间内CO2的转化率随温度变化曲线如图所示。
CH3OH(g)+H2O(g),相同时间内CO2的转化率随温度变化曲线如图所示。
①催化剂Ⅰ、Ⅱ中催化效率较高的是
②随温度的升高,CO2的转化率先增大后减小,理由是
您最近一年使用:0次



