名校
1 . 某密闭容器中发生如下反应:X(g)+Y(g)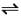 2Z(g) △H<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g) △H<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
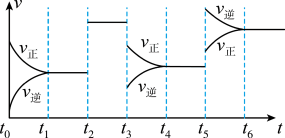
| A.t2时一定加入了催化剂 | B.t3-t4平衡正向移动 |
| C.t5时可能增大了压强 | D.t6之后转化率最低 |
您最近一年使用:0次
名校
解题方法
2 . 乙醇与水催化反应可以制得氢气。
(1)已知: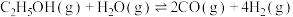
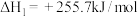 ,回答下列问题:
,回答下列问题:
①升温,平衡_______ 移动(填“向左”、“向右”、“不”);
②与原平衡相比较,增大压强,新平衡时
_______ (填“增大”、“减小”、“不变”,下同);
③恒温、恒容条件下。加入水蒸气,转化率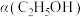
_______ ;
④恒温、恒压条件下,加入稀有气体,体积分数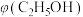
_______ 。
(2)乙醇与水催化制氢同时发生以下三个反应,回答下列问题:
反应I: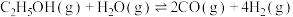
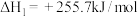
反应II:

反应III:

则
_______  。
。
(3)压强为100kPa, 的平衡产率与温度、起始时
的平衡产率与温度、起始时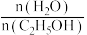 的关系如图所示,x、y、z三条曲线上的点都代表
的关系如图所示,x、y、z三条曲线上的点都代表 在不同条件下的平衡产率,且每条曲线上
在不同条件下的平衡产率,且每条曲线上 的平衡产率相同,如: A、B两点的
的平衡产率相同,如: A、B两点的 平衡产率相等,B、C两点的
平衡产率相等,B、C两点的 平衡产率不相等。
平衡产率不相等。
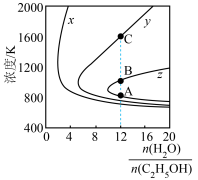
 的平衡产率:B点
的平衡产率:B点_______ C点(填“>”或“<”)。
(4)恒容条件下,将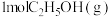 和
和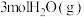 投入密闭容器中发生上述三个反应,平衡时
投入密闭容器中发生上述三个反应,平衡时 的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
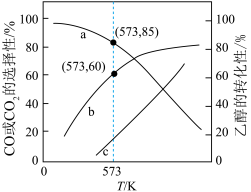
【已知:CO的选择性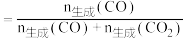 】
】
①表示乙醇转化率的曲线是_______ (填“a”、“b”或“c”)。
②573K时,反应II的压强平衡常数
_______ 。(已知:分压=总压 该组分物质的量分数,计算结果保留整数。)
该组分物质的量分数,计算结果保留整数。)
(1)已知:
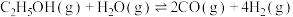
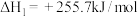 ,回答下列问题:
,回答下列问题:①升温,平衡
②与原平衡相比较,增大压强,新平衡时

③恒温、恒容条件下。加入水蒸气,转化率
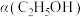
④恒温、恒压条件下,加入稀有气体,体积分数
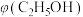
(2)乙醇与水催化制氢同时发生以下三个反应,回答下列问题:
反应I:
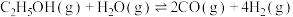
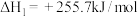
反应II:


反应III:


则

 。
。(3)压强为100kPa,
 的平衡产率与温度、起始时
的平衡产率与温度、起始时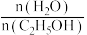 的关系如图所示,x、y、z三条曲线上的点都代表
的关系如图所示,x、y、z三条曲线上的点都代表 在不同条件下的平衡产率,且每条曲线上
在不同条件下的平衡产率,且每条曲线上 的平衡产率相同,如: A、B两点的
的平衡产率相同,如: A、B两点的 平衡产率相等,B、C两点的
平衡产率相等,B、C两点的 平衡产率不相等。
平衡产率不相等。
 的平衡产率:B点
的平衡产率:B点(4)恒容条件下,将
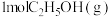 和
和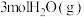 投入密闭容器中发生上述三个反应,平衡时
投入密闭容器中发生上述三个反应,平衡时 的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
【已知:CO的选择性
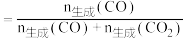 】
】①表示乙醇转化率的曲线是
②573K时,反应II的压强平衡常数

 该组分物质的量分数,计算结果保留整数。)
该组分物质的量分数,计算结果保留整数。)
您最近一年使用:0次
2023-11-14更新
|
362次组卷
|
2卷引用:重庆市第十一中学校2023-2024学年高二上学期期中考试化学试题
名校
解题方法
3 . 已知在溶液中可发生反应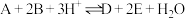 。在一定温度下,某实验小组用A、B的混合酸性溶液进行了三组实验,三组实验中
。在一定温度下,某实验小组用A、B的混合酸性溶液进行了三组实验,三组实验中 和
和 的浓度相等,
的浓度相等, 的起始浓度为
的起始浓度为 、
、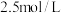 、
、 。测得
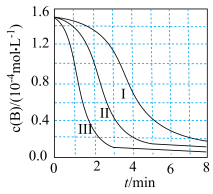
。测得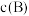 随时间t的变化曲线如下图,下列说法不正确的是
随时间t的变化曲线如下图,下列说法不正确的是
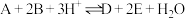 。在一定温度下,某实验小组用A、B的混合酸性溶液进行了三组实验,三组实验中
。在一定温度下,某实验小组用A、B的混合酸性溶液进行了三组实验,三组实验中 和
和 的浓度相等,
的浓度相等, 的起始浓度为
的起始浓度为 、
、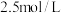 、
、 。测得
。测得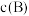 随时间t的变化曲线如下图,下列说法不正确的是
随时间t的变化曲线如下图,下列说法不正确的是
A.曲线Ⅲ起始时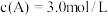 |
| B.该条件下三组实验的反应速率均随反应进程先增后减 |
C.起始时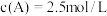 时, 时,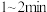 内, 内, 的平均反应速率为 的平均反应速率为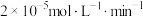 |
D.若曲线Ⅰ平衡时的 ,则该温度下该反应的平衡常数为 ,则该温度下该反应的平衡常数为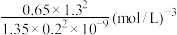 |
您最近一年使用:0次
4 .  时,
时, 的
的 溶液中,不同型体的分布优势如下图所示(X指含磷微粒的百分含量、
溶液中,不同型体的分布优势如下图所示(X指含磷微粒的百分含量、 的调控使用
的调控使用 、
、 )。
)。
已知:① (
(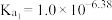 、
、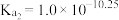 )
)
②当某一型体分布优势接近 时,另外两种相邻型体含量近似相等;
时,另外两种相邻型体含量近似相等;

则下列说法错误的是
 时,
时, 的
的 溶液中,不同型体的分布优势如下图所示(X指含磷微粒的百分含量、
溶液中,不同型体的分布优势如下图所示(X指含磷微粒的百分含量、 的调控使用
的调控使用 、
、 )。
)。已知:①
 (
(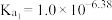 、
、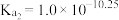 )
)②当某一型体分布优势接近
 时,另外两种相邻型体含量近似相等;
时,另外两种相邻型体含量近似相等;
则下列说法错误的是
A.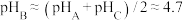 |
B.当使用 溶液滴定 溶液滴定 溶液至 溶液至 时,可选用酚酞作指示剂 时,可选用酚酞作指示剂 |
C.D点满足: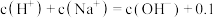 |
D.不可用 与 与 反应生成 反应生成 |
您最近一年使用:0次
5 . 银及其化合物在催化与电化学等领域中具有重要应用。
(1)在银催化下,乙烯与氧气反应生成环氧乙烷(EO)和乙醛(AA)。根据图所示,回答下列问题:

①中间体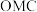 生成吸附态
生成吸附态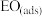 的活化能为
的活化能为_______  。
。
②由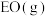 生成
生成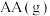 的热化学方程式为
的热化学方程式为_______ 。
(2)一定条件下,银催化剂表面上存在反应: ,该反应平衡压强
,该反应平衡压强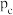 与温度
与温度 的关系如下:
的关系如下:
①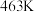 时的平衡常数
时的平衡常数
_______ 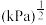 。
。
②起始状态Ⅰ中有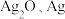 和
和 ,经下列过程达到各平衡状态:
,经下列过程达到各平衡状态:

已知状态Ⅰ和Ⅲ的固体质量相等,下列叙述正确的是_______ (填字母)。
A.从Ⅰ到Ⅱ的过程
B.
C.平衡常数: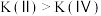
D.若体积 ,则
,则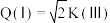
E.逆反应的速率: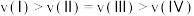
③某温度下,向恒容容器中加入 ,分解过程中反应速率
,分解过程中反应速率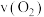 与压强
与压强 的关系为
的关系为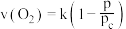 ,k为速率常数(定温下为常数)。当固体质量减少
,k为速率常数(定温下为常数)。当固体质量减少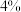 时,逆反应速率最大。若转化率为
时,逆反应速率最大。若转化率为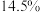 ,则
,则
_______ (用 表示)。
表示)。
(3) 可用作固体离子导体,能通过加热
可用作固体离子导体,能通过加热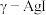 制得。上述两种晶体的晶胞示意图如图所示(为了简化,只画出了碘离子在晶胞中的位置)。
制得。上述两种晶体的晶胞示意图如图所示(为了简化,只画出了碘离子在晶胞中的位置)。

①测定晶体结构最常用的仪器是_______ (填字母)。
A.质谱仪 B.红外光谱仪 C.核磁共振仪 D. 射线衍射仪
射线衍射仪
②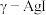 与
与 晶胞的体积之比为
晶胞的体积之比为_______ 。
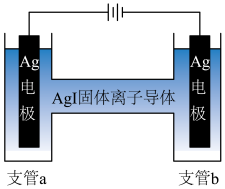
③测定 中导电离子类型的实验装置如图所示。实验测得支管a中
中导电离子类型的实验装置如图所示。实验测得支管a中 质量不变,可判定导电离子是
质量不变,可判定导电离子是 而不是
而不是 ,依据是
,依据是_______ 。
(1)在银催化下,乙烯与氧气反应生成环氧乙烷(EO)和乙醛(AA)。根据图所示,回答下列问题:

①中间体
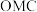 生成吸附态
生成吸附态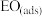 的活化能为
的活化能为 。
。②由
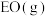 生成
生成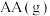 的热化学方程式为
的热化学方程式为(2)一定条件下,银催化剂表面上存在反应:
 ,该反应平衡压强
,该反应平衡压强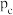 与温度
与温度 的关系如下:
的关系如下: | 401 | 443 | 463 |
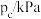 | 10 | 51 | 100 |
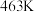 时的平衡常数
时的平衡常数
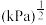 。
。②起始状态Ⅰ中有
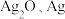 和
和 ,经下列过程达到各平衡状态:
,经下列过程达到各平衡状态:
已知状态Ⅰ和Ⅲ的固体质量相等,下列叙述正确的是
A.从Ⅰ到Ⅱ的过程

B.

C.平衡常数:
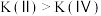
D.若体积
 ,则
,则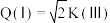
E.逆反应的速率:
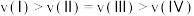
③某温度下,向恒容容器中加入
 ,分解过程中反应速率
,分解过程中反应速率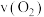 与压强
与压强 的关系为
的关系为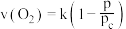 ,k为速率常数(定温下为常数)。当固体质量减少
,k为速率常数(定温下为常数)。当固体质量减少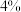 时,逆反应速率最大。若转化率为
时,逆反应速率最大。若转化率为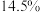 ,则
,则
 表示)。
表示)。(3)
 可用作固体离子导体,能通过加热
可用作固体离子导体,能通过加热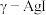 制得。上述两种晶体的晶胞示意图如图所示(为了简化,只画出了碘离子在晶胞中的位置)。
制得。上述两种晶体的晶胞示意图如图所示(为了简化,只画出了碘离子在晶胞中的位置)。
①测定晶体结构最常用的仪器是
A.质谱仪 B.红外光谱仪 C.核磁共振仪 D.
 射线衍射仪
射线衍射仪②
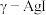 与
与 晶胞的体积之比为
晶胞的体积之比为③测定
 中导电离子类型的实验装置如图所示。实验测得支管a中
中导电离子类型的实验装置如图所示。实验测得支管a中 质量不变,可判定导电离子是
质量不变,可判定导电离子是 而不是
而不是 ,依据是
,依据是
您最近一年使用:0次
2023-09-28更新
|
5480次组卷
|
7卷引用:2023年重庆市高考化学试卷
2023高三下·全国·专题练习
名校
6 . 二氧化碳的再利用是实现温室气体减排的重要途径之一,在稀H2SO4中利用电催化可将CO2同时转化为多种燃料,其原理如图所示。下列说法正确的是
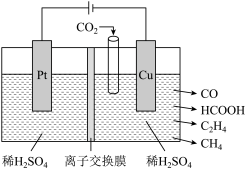

| A.离子交换膜为阳离子交换膜 |
| B.一段时间后,阴极区溶液质量会减少 |
C.Cu电极上的电极反应式为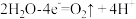 |
| D.若阴极只生成0.15molCO和0.35 mol HCOOH,则电路中转移电子的物质的量为0.50mol |
您最近一年使用:0次
2023-08-15更新
|
999次组卷
|
4卷引用:重庆市万州第二高级中学2023-2024学年高三上学期8月月考化学试题
真题
名校
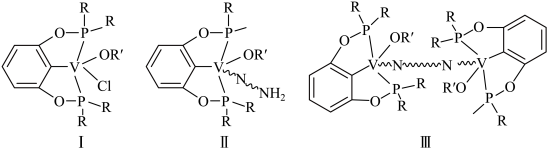
7 . 我国科学家发现一种钒配合物Ⅰ可以充当固氮反应的催化剂,反应过程中经历的中间体包括Ⅱ和Ⅲ。
(1)配合物Ⅰ中钒的配位原子有4种,它们是_______ 。
(2)配合物Ⅰ中,R′代表芳基, 空间结构呈角形,原因是
空间结构呈角形,原因是_______ 。
(3)配合物Ⅱ中,第一电离能最大的配位原子是_______ 。
(4)配合物Ⅱ和Ⅲ中,钒的化合价分别为 和
和 ,配合物Ⅱ、Ⅲ和
,配合物Ⅱ、Ⅲ和 三者中,两个氮原子间键长最长的是
三者中,两个氮原子间键长最长的是_______ 。
(5)近年来,研究人员发现含钒的锑化物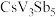 在超导方面表现出潜在的应用前景。
在超导方面表现出潜在的应用前景。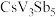 晶胞如图1所示,晶体中包含由V和Sb组成的二维平面(见图2)。
晶胞如图1所示,晶体中包含由V和Sb组成的二维平面(见图2)。_______ 。锑和磷同族,锑原子基态的价层电子排布式为_______ 。
②晶体中少部分钒原子被其它元素(包括Ti、Nb、Cr、Sn)原子取代,可得到改性材料。下列有关替代原子说法正确的是_______ 。
a.有 或
或 价态形式 b.均属于第四周期元素
价态形式 b.均属于第四周期元素
c.均属于过渡元素 d.替代原子与原离子的离子半径相近
( 代表单键、双键或叁键)
代表单键、双键或叁键)
(1)配合物Ⅰ中钒的配位原子有4种,它们是
(2)配合物Ⅰ中,R′代表芳基,
 空间结构呈角形,原因是
空间结构呈角形,原因是(3)配合物Ⅱ中,第一电离能最大的配位原子是
(4)配合物Ⅱ和Ⅲ中,钒的化合价分别为
 和
和 ,配合物Ⅱ、Ⅲ和
,配合物Ⅱ、Ⅲ和 三者中,两个氮原子间键长最长的是
三者中,两个氮原子间键长最长的是(5)近年来,研究人员发现含钒的锑化物
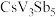 在超导方面表现出潜在的应用前景。
在超导方面表现出潜在的应用前景。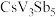 晶胞如图1所示,晶体中包含由V和Sb组成的二维平面(见图2)。
晶胞如图1所示,晶体中包含由V和Sb组成的二维平面(见图2)。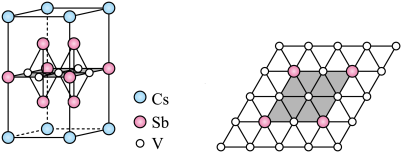
②晶体中少部分钒原子被其它元素(包括Ti、Nb、Cr、Sn)原子取代,可得到改性材料。下列有关替代原子说法正确的是
a.有
 或
或 价态形式 b.均属于第四周期元素
价态形式 b.均属于第四周期元素c.均属于过渡元素 d.替代原子与原离子的离子半径相近
您最近一年使用:0次
2023-08-03更新
|
4579次组卷
|
4卷引用:重庆市万州第二高级中学2023-2024学年高三上学期7月月考化学试题
名校
8 . 某实验小组利用如图装置模拟古法制硫酸并进行 性质探究。
性质探究。
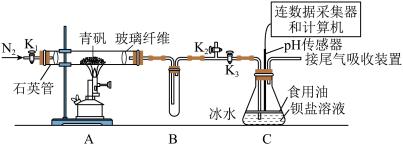
已知:①“青矾”是指 ,高温受热可完全分解得到红棕色固体和气体混合物;
,高温受热可完全分解得到红棕色固体和气体混合物;
② 熔点
熔点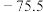 ℃,沸点
℃,沸点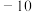 ℃:
℃: 熔点16.8℃,沸点44.8℃。
熔点16.8℃,沸点44.8℃。
请回答下列问题:
Ⅰ.制取硫酸
实验开始前打开活塞 、
、 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 后,关闭活塞
后,关闭活塞 、
、 ,打开活塞
,打开活塞 ,用酒精喷灯高温加热青矾。
,用酒精喷灯高温加热青矾。
(1)加热时A装置中发生反应的化学方程式为_____ 。
(2)B装置的作用是_____ 。
(3)将一定量的青矾在500℃时隔绝空气加热一段时间后检验其固体产物,请设计实验证明此固体产物不含二价铁:_____ 。
Ⅱ.探究 的性质
的性质
在装置C中先后三次加入同浓度同体积不同情况的钡盐溶液。控制食用油油层厚度一致、通入 流速一致。三次实验现象如下表:
流速一致。三次实验现象如下表:
分别得到如下 图:
图:

(4)实验①中,曲线呈缓慢下降趋势,原因是_____ 。(用方程式表示)
(5)对比分析②③数据,可得出的结论是_____ 。
Ⅲ. 含量的测定
含量的测定
(6)为对排气法收集到的 气体进行含量测定,将
气体进行含量测定,将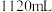 气体(已折算为标准状况)通入足量的
气体(已折算为标准状况)通入足量的 溶液中,经过滤、洗涤、烘干,最终得到沉淀
溶液中,经过滤、洗涤、烘干,最终得到沉淀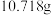 ,则
,则 体的体积分数为
体的体积分数为_____ 。若该实验数据较实际值偏大,则可能的原因是_____ 。
①气体通入速率过快②沉淀未进行恒重操作③收集的气体中有 ④未用食用油覆盖液面
④未用食用油覆盖液面
Ⅳ、 的应用
的应用
 可用于制备硫代硫酸钠晶体
可用于制备硫代硫酸钠晶体 。已知
。已知 易溶于水,在酸性或高温环境下不稳定。主要用作还原剂、定影剂等。
易溶于水,在酸性或高温环境下不稳定。主要用作还原剂、定影剂等。
实验室制备硫代硫酸钠晶体的装置如图所示。

(7)反应结束时,必须控制溶液的pH不能小于7,否则会造成的后果是_____ (用离子方程式表示)。
(8)实验结束后,进行样品纯度的测定。称取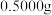 硫代硫酸钠晶体
硫代硫酸钠晶体 样品加水溶解,加几滴淀粉溶液,然后用
样品加水溶解,加几滴淀粉溶液,然后用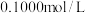 的标准碘液滴定,测得消耗标准碘液体积的平均值为
的标准碘液滴定,测得消耗标准碘液体积的平均值为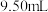 ,则该样品的纯度为
,则该样品的纯度为_____ (保留四位小数)。
已知: ,样品中杂质不参与反应。
,样品中杂质不参与反应。
(9)若滴定前未用标准碘液润洗滴定管,则测定样品中硫代硫酸钠晶体纯度_____ (“偏高”、“偏低”或“无影响”)。
 性质探究。
性质探究。
已知:①“青矾”是指
 ,高温受热可完全分解得到红棕色固体和气体混合物;
,高温受热可完全分解得到红棕色固体和气体混合物;②
 熔点
熔点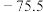 ℃,沸点
℃,沸点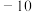 ℃:
℃: 熔点16.8℃,沸点44.8℃。
熔点16.8℃,沸点44.8℃。请回答下列问题:
Ⅰ.制取硫酸
实验开始前打开活塞
 、
、 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 后,关闭活塞
后,关闭活塞 、
、 ,打开活塞
,打开活塞 ,用酒精喷灯高温加热青矾。
,用酒精喷灯高温加热青矾。(1)加热时A装置中发生反应的化学方程式为
(2)B装置的作用是
(3)将一定量的青矾在500℃时隔绝空气加热一段时间后检验其固体产物,请设计实验证明此固体产物不含二价铁:
Ⅱ.探究
 的性质
的性质在装置C中先后三次加入同浓度同体积不同情况的钡盐溶液。控制食用油油层厚度一致、通入
 流速一致。三次实验现象如下表:
流速一致。三次实验现象如下表:| 实验 | ① | ② | ③ |
| 所加试剂 | 已煮沸的 溶液 溶液 | 未煮沸的 溶液 溶液 | 已煮沸的 溶液 溶液 |
| 实验现象 | 无白色沉淀生成 | 有白色沉淀生成 | 有白色沉淀生成 |
 图:
图:
(4)实验①中,曲线呈缓慢下降趋势,原因是
(5)对比分析②③数据,可得出的结论是
Ⅲ.
 含量的测定
含量的测定(6)为对排气法收集到的
 气体进行含量测定,将
气体进行含量测定,将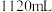 气体(已折算为标准状况)通入足量的
气体(已折算为标准状况)通入足量的 溶液中,经过滤、洗涤、烘干,最终得到沉淀
溶液中,经过滤、洗涤、烘干,最终得到沉淀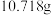 ,则
,则 体的体积分数为
体的体积分数为①气体通入速率过快②沉淀未进行恒重操作③收集的气体中有
 ④未用食用油覆盖液面
④未用食用油覆盖液面Ⅳ、
 的应用
的应用 可用于制备硫代硫酸钠晶体
可用于制备硫代硫酸钠晶体 。已知
。已知 易溶于水,在酸性或高温环境下不稳定。主要用作还原剂、定影剂等。
易溶于水,在酸性或高温环境下不稳定。主要用作还原剂、定影剂等。实验室制备硫代硫酸钠晶体的装置如图所示。

(7)反应结束时,必须控制溶液的pH不能小于7,否则会造成的后果是
(8)实验结束后,进行样品纯度的测定。称取
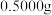 硫代硫酸钠晶体
硫代硫酸钠晶体 样品加水溶解,加几滴淀粉溶液,然后用
样品加水溶解,加几滴淀粉溶液,然后用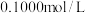 的标准碘液滴定,测得消耗标准碘液体积的平均值为
的标准碘液滴定,测得消耗标准碘液体积的平均值为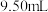 ,则该样品的纯度为
,则该样品的纯度为已知:
 ,样品中杂质不参与反应。
,样品中杂质不参与反应。(9)若滴定前未用标准碘液润洗滴定管,则测定样品中硫代硫酸钠晶体纯度
您最近一年使用:0次
2023-07-13更新
|
709次组卷
|
3卷引用:重庆市万州第二高级中学2023-2024学年高三上学期8月月考化学试题
名校
9 . 沙格列丁(J)是二肽基肽酶-Ⅳ抑制剂,可用于2型糖尿病的治疗,一种以金刚甲酸(A)为原料制备沙格列丁的流程如下:
(1)A的分子式为_______ 。
(2)B→C的化学方程式为_______ ,该反应的类型为_______ 。
(3)C→D中,实现了官能团由氰基(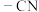 )变为
)变为_______ (填官能团的名称)。
(4)G→I中,还有HCl生成,H的结构简式为_______ 。
(5)化合物A的同分异构体满足下列条件的有_______ 种(不考虑立体异构,填字母);
a.苯环上有三个取代基,且其中两个酚羟基处于间位;b.分子中含有3个甲基。
A.7 B.8 C.9 D.10
其中核磁共振氢谱有5组峰,且峰面积之比为9∶2∶2∶2∶1的结构简式为_______ 。(任写一种)。

(1)A的分子式为
(2)B→C的化学方程式为
(3)C→D中,实现了官能团由氰基(
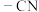 )变为
)变为(4)G→I中,还有HCl生成,H的结构简式为
(5)化合物A的同分异构体满足下列条件的有
a.苯环上有三个取代基,且其中两个酚羟基处于间位;b.分子中含有3个甲基。
A.7 B.8 C.9 D.10
其中核磁共振氢谱有5组峰,且峰面积之比为9∶2∶2∶2∶1的结构简式为
您最近一年使用:0次
2023-07-12更新
|
321次组卷
|
4卷引用:重庆市万州第二高级中学2023-2024学年高三上学期8月月考化学试题
重庆市万州第二高级中学2023-2024学年高三上学期8月月考化学试题辽宁省朝阳市2022-2023学年高二下学期期末联考化学试题辽宁省凌源市2022-2023学年高二下学期期末联考化学试题(已下线)综合02 有机化学基础压轴40题-备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)
名校
10 . 三氟化氯 是极强氧化剂,能发生自耦电离:
是极强氧化剂,能发生自耦电离: ,其分子结构如图所示,下列推测不合理的是
,其分子结构如图所示,下列推测不合理的是
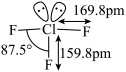
 是极强氧化剂,能发生自耦电离:
是极强氧化剂,能发生自耦电离: ,其分子结构如图所示,下列推测不合理的是
,其分子结构如图所示,下列推测不合理的是
A. 分子的中心原子有5对价层电子对 分子的中心原子有5对价层电子对 |
B. 离子空间构型为正四面体 离子空间构型为正四面体 |
C. 与 与 反应生成 反应生成 和 和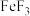 |
D.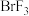 比 比 更易发生自耦电离 更易发生自耦电离 |
您最近一年使用:0次
2023-07-12更新
|
588次组卷
|
3卷引用:重庆市万州第二高级中学2023-2024学年高三上学期8月月考化学试题



