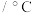1 . 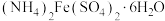 俗称摩尔盐,是一种蓝绿色的无机复盐,不溶于酒精。在实验室以铁粉、稀硫酸、硫酸铵为原料制备
俗称摩尔盐,是一种蓝绿色的无机复盐,不溶于酒精。在实验室以铁粉、稀硫酸、硫酸铵为原料制备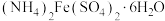 并测定摩尔盐中
并测定摩尔盐中 的含量。已知:
的含量。已知:
三种盐的溶解度(单位为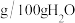 )
)
回答下列问题:
(1)制备硫酸亚铁(装置如图所示):称取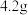 洗净的铁粉(含
洗净的铁粉(含 质量分数为2.3%)加入锥形瓶中。向锥形瓶中加入
质量分数为2.3%)加入锥形瓶中。向锥形瓶中加入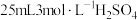 溶液,开始反应,加热,振荡,反应过程中适当补充水,防止硫酸浓度变大。然后再向锥形瓶中加入
溶液,开始反应,加热,振荡,反应过程中适当补充水,防止硫酸浓度变大。然后再向锥形瓶中加入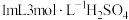 溶液,趁热过滤得
溶液,趁热过滤得 溶液。
溶液。______________________ ;装置b中所盛试剂的作用是______________________ 。
②若不及时向锥形瓶中补加水,导致硫酸浓度过大,可能造成的不良后果为______________________ 。
(2)在 的条件下,称取
的条件下,称取 晶体
晶体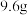 ,将其溶于
,将其溶于___________________  (结果保留一位小数,此温度下的水的密度近似为
(结果保留一位小数,此温度下的水的密度近似为 )水中,配成饱和溶液。
)水中,配成饱和溶液。
(3)将(2)中所配的 饱和溶液加入(1)所得
饱和溶液加入(1)所得 溶液中,搅拌,小火加热,在蒸发皿中蒸发浓缩得到
溶液中,搅拌,小火加热,在蒸发皿中蒸发浓缩得到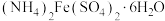 晶体,抽滤、洗涤得产品.洗涤的具体操作为
晶体,抽滤、洗涤得产品.洗涤的具体操作为_____________ 。
(4)测定产品中 的含量:称取
的含量:称取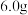 产品,溶于水配成溶液并加入稀硫酸,用
产品,溶于水配成溶液并加入稀硫酸,用 的
的 标准溶液进行滴定(杂质不参加反应),达到滴定终点时,消耗
标准溶液进行滴定(杂质不参加反应),达到滴定终点时,消耗 标准溶液的体积为
标准溶液的体积为 。
。
①滴定反应的离子方程式为___________________ 。
②产品中 的质量分数为
的质量分数为____________________ 。
③若滴定终点时俯视读数,会使测定结果_____________ (填“偏低”或“偏高”)。
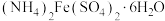 俗称摩尔盐,是一种蓝绿色的无机复盐,不溶于酒精。在实验室以铁粉、稀硫酸、硫酸铵为原料制备
俗称摩尔盐,是一种蓝绿色的无机复盐,不溶于酒精。在实验室以铁粉、稀硫酸、硫酸铵为原料制备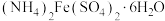 并测定摩尔盐中
并测定摩尔盐中 的含量。已知:
的含量。已知:三种盐的溶解度(单位为
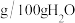 )
)温度/℃ |
|
|
|
10 | 20.0 | 73 | 17.2 |
20 | 26.5 | 75.4 | 21.6 |
30 | 32.9 | 78 | 28.1 |
(1)制备硫酸亚铁(装置如图所示):称取
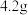 洗净的铁粉(含
洗净的铁粉(含 质量分数为2.3%)加入锥形瓶中。向锥形瓶中加入
质量分数为2.3%)加入锥形瓶中。向锥形瓶中加入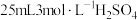 溶液,开始反应,加热,振荡,反应过程中适当补充水,防止硫酸浓度变大。然后再向锥形瓶中加入
溶液,开始反应,加热,振荡,反应过程中适当补充水,防止硫酸浓度变大。然后再向锥形瓶中加入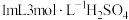 溶液,趁热过滤得
溶液,趁热过滤得 溶液。
溶液。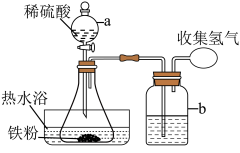
②若不及时向锥形瓶中补加水,导致硫酸浓度过大,可能造成的不良后果为
(2)在
 的条件下,称取
的条件下,称取 晶体
晶体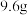 ,将其溶于
,将其溶于 (结果保留一位小数,此温度下的水的密度近似为
(结果保留一位小数,此温度下的水的密度近似为 )水中,配成饱和溶液。
)水中,配成饱和溶液。(3)将(2)中所配的
 饱和溶液加入(1)所得
饱和溶液加入(1)所得 溶液中,搅拌,小火加热,在蒸发皿中蒸发浓缩得到
溶液中,搅拌,小火加热,在蒸发皿中蒸发浓缩得到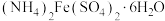 晶体,抽滤、洗涤得产品.洗涤的具体操作为
晶体,抽滤、洗涤得产品.洗涤的具体操作为(4)测定产品中
 的含量:称取
的含量:称取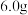 产品,溶于水配成溶液并加入稀硫酸,用
产品,溶于水配成溶液并加入稀硫酸,用 的
的 标准溶液进行滴定(杂质不参加反应),达到滴定终点时,消耗
标准溶液进行滴定(杂质不参加反应),达到滴定终点时,消耗 标准溶液的体积为
标准溶液的体积为 。
。①滴定反应的离子方程式为
②产品中
 的质量分数为
的质量分数为③若滴定终点时俯视读数,会使测定结果
您最近一年使用:0次
名校
2 . 以软锰矿(含 及少量
及少量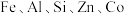 的氧化物)为主要原料可制备
的氧化物)为主要原料可制备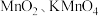 等。制备
等。制备 的实验流程如下:
的实验流程如下: 生成
生成 的离子方程式为
的离子方程式为_______ 。
(2)已知 时,
时,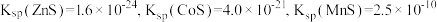 。取一定量“除
。取一定量“除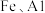 ”后的酸性滤液,分析其中
”后的酸性滤液,分析其中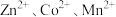 的含量
的含量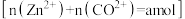 后,加入一定量
后,加入一定量 充分反应,测得金属的沉淀率随加入
充分反应,测得金属的沉淀率随加入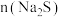 的变化如图所示。
的变化如图所示。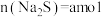 时,测得溶液中
时,测得溶液中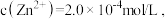 此时
此时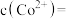
_______ 。
②当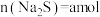 时,
时, 和
和 未完全沉淀的原因是
未完全沉淀的原因是_______ 。
(3)将一定量的 与稍过量
与稍过量 混合熔融,再分批加入一定量
混合熔融,再分批加入一定量 ,在加热条件下迅速搅拌制得墨绿色
,在加热条件下迅速搅拌制得墨绿色 。已知向
。已知向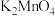 碱性溶液中加酸会生成
碱性溶液中加酸会生成 和
和 在
在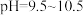 时,反应趋于完全。
时,反应趋于完全。 混合熔融时不能选用瓷坩埚的原因是
混合熔融时不能选用瓷坩埚的原因是_______ 。
(4)测定 粗品的纯度。称取
粗品的纯度。称取 粗品置于具塞锥形瓶中,加水润湿后,依次加入足量稀硫酸和过量
粗品置于具塞锥形瓶中,加水润湿后,依次加入足量稀硫酸和过量 溶液。盖上玻璃塞,充分摇匀后静置
溶液。盖上玻璃塞,充分摇匀后静置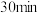 。用
。用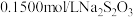 标准溶液滴定生成的
标准溶液滴定生成的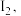 消耗
消耗 标准溶液
标准溶液 。滴定反应为
。滴定反应为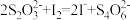 。计算粗品中
。计算粗品中 的质量分数
的质量分数_______ (写出计算过程)。
 及少量
及少量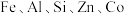 的氧化物)为主要原料可制备
的氧化物)为主要原料可制备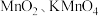 等。制备
等。制备 的实验流程如下:
的实验流程如下:
 生成
生成 的离子方程式为
的离子方程式为(2)已知
 时,
时,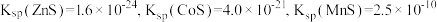 。取一定量“除
。取一定量“除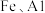 ”后的酸性滤液,分析其中
”后的酸性滤液,分析其中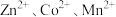 的含量
的含量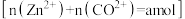 后,加入一定量
后,加入一定量 充分反应,测得金属的沉淀率随加入
充分反应,测得金属的沉淀率随加入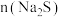 的变化如图所示。
的变化如图所示。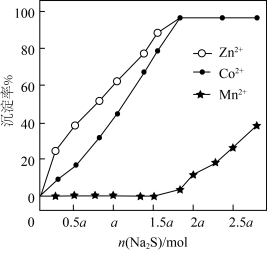
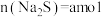 时,测得溶液中
时,测得溶液中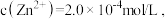 此时
此时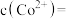
②当
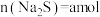 时,
时, 和
和 未完全沉淀的原因是
未完全沉淀的原因是(3)将一定量的
 与稍过量
与稍过量 混合熔融,再分批加入一定量
混合熔融,再分批加入一定量 ,在加热条件下迅速搅拌制得墨绿色
,在加热条件下迅速搅拌制得墨绿色 。已知向
。已知向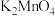 碱性溶液中加酸会生成
碱性溶液中加酸会生成 和
和 在
在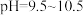 时,反应趋于完全。
时,反应趋于完全。 混合熔融时不能选用瓷坩埚的原因是
混合熔融时不能选用瓷坩埚的原因是(4)测定
 粗品的纯度。称取
粗品的纯度。称取 粗品置于具塞锥形瓶中,加水润湿后,依次加入足量稀硫酸和过量
粗品置于具塞锥形瓶中,加水润湿后,依次加入足量稀硫酸和过量 溶液。盖上玻璃塞,充分摇匀后静置
溶液。盖上玻璃塞,充分摇匀后静置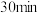 。用
。用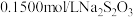 标准溶液滴定生成的
标准溶液滴定生成的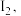 消耗
消耗 标准溶液
标准溶液 。滴定反应为
。滴定反应为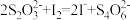 。计算粗品中
。计算粗品中 的质量分数
的质量分数
您最近一年使用:0次
3 . 纯碱是一种重要的化工原料,具有广泛的用途。实验室利用氯化钠和碳酸氢铵制备纯碱并测定产品中碳酸氢钠的含量,具体步骤如下:
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
步骤ⅱ.制备纯碱
在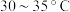 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸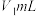 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。
已知:相关物质的溶解度如下
说明:“—”表示该物质在相应温度下已开始分解。
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为________________ ;
(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为________________ ;
(3)步骤ⅱ中,选择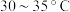 水浴的原因为
水浴的原因为________________ ;
(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为________________ ;
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的________ (填仪器名称);________ ;滴定过程中,盐酸需要逐滴加入并不断振荡的原因为________________ ;选择指示剂N时,滴定终点溶液颜色变化为________________ ;
(7)产品中碳酸氢钠的质量分数为________ (用含字母的代数式表示)。
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和
 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。步骤ⅱ.制备纯碱
在
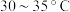 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用
 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸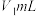 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。已知:相关物质的溶解度如下
温度 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| 15.8 | 21.0 | 27.0 | — | — | — | — |
| 8.15 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
| 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为
 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为
(3)步骤ⅱ中,选择
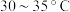 水浴的原因为
水浴的原因为(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的
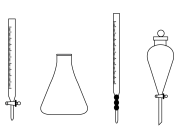
(7)产品中碳酸氢钠的质量分数为
您最近一年使用:0次
2024-06-01更新
|
158次组卷
|
3卷引用:河北省石家庄市2024届普通高中学校高三毕业年级教学质量检测(三)化学试卷
解题方法
4 . 从某工厂铜电解车间产生的难溶副产物黑铜泥(主要成分为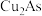 和
和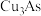 )和废水车间产生的含砷废渣(主要成分为
)和废水车间产生的含砷废渣(主要成分为 )中回收铜和砷的一种流程示意图如下。
)中回收铜和砷的一种流程示意图如下。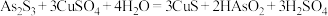 ;
;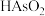 易分解生成微溶于水的
易分解生成微溶于水的 ;随着硫酸浓度的增大,
;随着硫酸浓度的增大, 在硫酸溶液中的溶解度变小。
在硫酸溶液中的溶解度变小。
(1)升温能加快氧化浸出的速率。温度过高时,浸出速率反而会下降,原因是___________ 。
(2)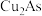 和
和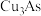 被氧化为
被氧化为 和
和 。
。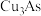 被氧化的离子方程式为
被氧化的离子方程式为___________ 。
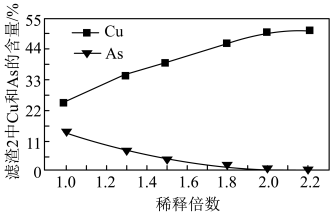
(3)沉铜前,需要对氧化浸出液进行稀释。稀释倍数对沉铜的影响如下图所示。___________ 。
(4)上述流程中可循环使用的物质是___________ 。
(5)粗三氧化二砷中砷含量的测定。
ⅰ.取0.1g样品于锥形瓶中,加入NaOH溶液,使样品完全溶解;
ⅱ.加入适量乙酸铅溶液,消除-2价硫的干扰;
ⅲ.用稀硫酸调pH=8,加入3g碳酸氢钠和少量淀粉溶液;
ⅳ.用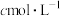 碘标准溶液(溶质按
碘标准溶液(溶质按 计)滴定,将砷氧化至最高价态。到达滴定终点时,消耗碘标准溶液VmL。
计)滴定,将砷氧化至最高价态。到达滴定终点时,消耗碘标准溶液VmL。
已知:样品中砷只以+3价的形式存在。
①若样品中有-2价硫,没有步骤ⅱ,测定结果将___________ (填“偏大”“偏小”或“不变”)。
②样品中砷的质量分数为___________ 。
③步骤ⅲ中加入碳酸氢钠,能保持滴定过程中溶液pH基本稳定,结合化学用语解释原因___________ 。
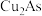 和
和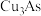 )和废水车间产生的含砷废渣(主要成分为
)和废水车间产生的含砷废渣(主要成分为 )中回收铜和砷的一种流程示意图如下。
)中回收铜和砷的一种流程示意图如下。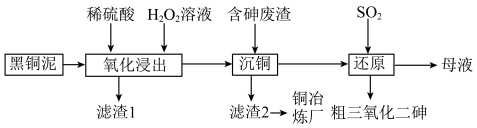
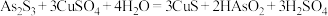 ;
;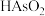 易分解生成微溶于水的
易分解生成微溶于水的 ;随着硫酸浓度的增大,
;随着硫酸浓度的增大, 在硫酸溶液中的溶解度变小。
在硫酸溶液中的溶解度变小。(1)升温能加快氧化浸出的速率。温度过高时,浸出速率反而会下降,原因是
(2)
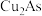 和
和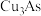 被氧化为
被氧化为 和
和 。
。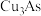 被氧化的离子方程式为
被氧化的离子方程式为(3)沉铜前,需要对氧化浸出液进行稀释。稀释倍数对沉铜的影响如下图所示。
(4)上述流程中可循环使用的物质是
(5)粗三氧化二砷中砷含量的测定。
ⅰ.取0.1g样品于锥形瓶中,加入NaOH溶液,使样品完全溶解;
ⅱ.加入适量乙酸铅溶液,消除-2价硫的干扰;
ⅲ.用稀硫酸调pH=8,加入3g碳酸氢钠和少量淀粉溶液;
ⅳ.用
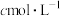 碘标准溶液(溶质按
碘标准溶液(溶质按 计)滴定,将砷氧化至最高价态。到达滴定终点时,消耗碘标准溶液VmL。
计)滴定,将砷氧化至最高价态。到达滴定终点时,消耗碘标准溶液VmL。已知:样品中砷只以+3价的形式存在。
①若样品中有-2价硫,没有步骤ⅱ,测定结果将
②样品中砷的质量分数为
③步骤ⅲ中加入碳酸氢钠,能保持滴定过程中溶液pH基本稳定,结合化学用语解释原因
您最近一年使用:0次
2024高三下·全国·专题练习
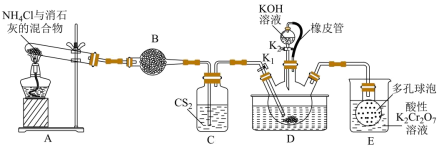
5 . 硫氰化钾( )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示: 不溶于水,密度比水的大;
不溶于水,密度比水的大;
② 不溶于
不溶于 ;
;
③三颈烧瓶内盛放有 、水和催化剂。
、水和催化剂。
回答下列问题:
制备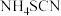 溶液:
溶液:
测定晶体中 的含量:称取10.0g样品,配成
的含量:称取10.0g样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴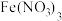 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。
(1)滴定时发生的反应: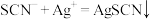 (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是_______ 。
(2)晶体中 的质量分数为
的质量分数为_______ (结果精确至0.1%)。
 )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示: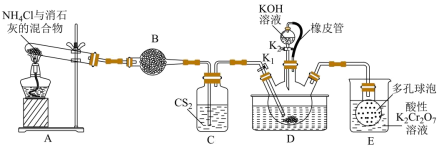
 不溶于水,密度比水的大;
不溶于水,密度比水的大;②
 不溶于
不溶于 ;
;③三颈烧瓶内盛放有
 、水和催化剂。
、水和催化剂。回答下列问题:
制备
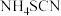 溶液:
溶液:测定晶体中
 的含量:称取10.0g样品,配成
的含量:称取10.0g样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴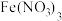 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。(1)滴定时发生的反应:
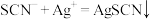 (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是(2)晶体中
 的质量分数为
的质量分数为
您最近一年使用:0次
6 . 硫氰化钾( )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
已知:① 不溶于水,密度比水的大;
不溶于水,密度比水的大;
② 不溶于
不溶于 ;
;
③三颈烧瓶内盛放有 、水和催化剂。
、水和催化剂。
回答下列问题:
(1)制备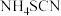 溶液:
溶液:
①实验前,经检验装置的气密性良好。其中装置B中的试剂是___________ 。
②实验开始时,打开K,加热装置A、D,使A中产生的气体缓缓通入D中,发生反应
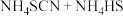 该反应比较缓慢),当看到
该反应比较缓慢),当看到___________ 现象时说明该反应接近完全。
(2)制备 溶液:
溶液:
①熄灭A处的酒精灯,关闭 ,移开水浴,将装置D继续加热至105℃,当
,移开水浴,将装置D继续加热至105℃,当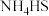 完全分解后(
完全分解后(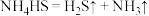 ),打开
),打开 ,继续保持液温105℃,缓缓滴入适量的
,继续保持液温105℃,缓缓滴入适量的 溶液,发生反应的化学方程式为
溶液,发生反应的化学方程式为___________ 。
②装置E中多孔球泡的作用是___________ 。
(3)制备 晶体:先滤去三颈烧瓶中的固体催化剂,
晶体:先滤去三颈烧瓶中的固体催化剂,___________ 、___________ 、过滤、洗涤、干燥,得到硫氰化钾晶体。
(4)测定晶体中 的含量:称取10.0g样品,配成
的含量:称取10.0g样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴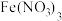 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。
①滴定时发生的反应: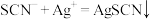 (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是________ 。
②晶体中 的质量分数为
的质量分数为___________ (结果精确至0.1%)。
 )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
已知:①
 不溶于水,密度比水的大;
不溶于水,密度比水的大;②
 不溶于
不溶于 ;
;③三颈烧瓶内盛放有
 、水和催化剂。
、水和催化剂。回答下列问题:
(1)制备
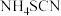 溶液:
溶液:①实验前,经检验装置的气密性良好。其中装置B中的试剂是
②实验开始时,打开K,加热装置A、D,使A中产生的气体缓缓通入D中,发生反应

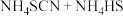 该反应比较缓慢),当看到
该反应比较缓慢),当看到(2)制备
 溶液:
溶液:①熄灭A处的酒精灯,关闭
 ,移开水浴,将装置D继续加热至105℃,当
,移开水浴,将装置D继续加热至105℃,当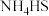 完全分解后(
完全分解后(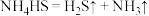 ),打开
),打开 ,继续保持液温105℃,缓缓滴入适量的
,继续保持液温105℃,缓缓滴入适量的 溶液,发生反应的化学方程式为
溶液,发生反应的化学方程式为②装置E中多孔球泡的作用是
(3)制备
 晶体:先滤去三颈烧瓶中的固体催化剂,
晶体:先滤去三颈烧瓶中的固体催化剂,(4)测定晶体中
 的含量:称取10.0g样品,配成
的含量:称取10.0g样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴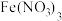 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。①滴定时发生的反应:
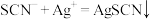 (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是②晶体中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
7 . 自然界中,纯粹的典型晶体是不多的,大多数晶体是分子晶体、共价晶体、金属晶体和离子晶体之间的过渡晶体。以下列出了第三周期几种氧化物晶体中离子键的百分数。
提示:离子键的百分数是通过电负性的差值计算出来的,电负性的差值越大,离子键的百分数越大。
(1)从原子结构角度解释,为什么一般认为氧化镁属于离子晶体,而二氧化硅属于共价晶体:___________ 。
(2)硅元素位于元素周期表的___________ 区。基态硅原子的价层电子排布式为___________ 。
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,已知该晶体中晶胞各边长度分别为apm、apm和cpm,两条底边夹角为120°,距离最近的两个B原子之间距离为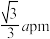 。
。
①该物质化学式为___________ ;
②距离每个B原子最近的Mg原子有___________ 个;
③该晶体密度为___________  。
。 含量。
含量。
(ⅰ)称取m克硅酸钠样品加热溶解后,配置为250mL待测液。
(ⅱ)移取50mL待测液至250mL锥形瓶中,加入10滴甲基红指示剂【HIn(红色) (黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为
(黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为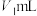 ,体系中有沉淀。
,体系中有沉淀。
(ⅲ)加入3.0g氟化钠固体,充分反应。
(ⅳ)用0.5000mol/L HCl标准溶液滴定至溶液为玫瑰红色并继续加入至过量,共加入 。
。
(ⅴ)用0.5000mol/L NaOH标准溶液滴定至溶液变为亮黄色,消耗NaOH溶液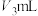 。
。
已知: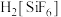 为强电解质,回答问题:
为强电解质,回答问题:
①步骤(ⅲ)中加入NaF后发生化学反应的离子方程式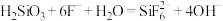 ,则加入NaF后的实验现象为
,则加入NaF后的实验现象为___________ 。
②样品中硅酸钠的纯度为___________ (用质量分数表示)。
| 氧化物 |  | MgO |  |  |
| 离子键百分数 | 62 | 50 | 41 | 33 |
(1)从原子结构角度解释,为什么一般认为氧化镁属于离子晶体,而二氧化硅属于共价晶体:
(2)硅元素位于元素周期表的
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,已知该晶体中晶胞各边长度分别为apm、apm和cpm,两条底边夹角为120°,距离最近的两个B原子之间距离为
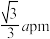 。
。①该物质化学式为
②距离每个B原子最近的Mg原子有
③该晶体密度为
 。
。
 含量。
含量。(ⅰ)称取m克硅酸钠样品加热溶解后,配置为250mL待测液。
(ⅱ)移取50mL待测液至250mL锥形瓶中,加入10滴甲基红指示剂【HIn(红色)
 (黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为
(黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为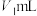 ,体系中有沉淀。
,体系中有沉淀。(ⅲ)加入3.0g氟化钠固体,充分反应。
(ⅳ)用0.5000mol/L HCl标准溶液滴定至溶液为玫瑰红色并继续加入至过量,共加入
 。
。(ⅴ)用0.5000mol/L NaOH标准溶液滴定至溶液变为亮黄色,消耗NaOH溶液
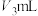 。
。已知:
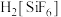 为强电解质,回答问题:
为强电解质,回答问题:①步骤(ⅲ)中加入NaF后发生化学反应的离子方程式
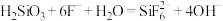 ,则加入NaF后的实验现象为
,则加入NaF后的实验现象为②样品中硅酸钠的纯度为
您最近一年使用:0次
8 . 实验室中以活性炭为催化剂制备 并测定钴元素的含量。
并测定钴元素的含量。
已知: 是橙黄色晶体,可溶于水和稀酸、不溶于乙醇;在强碱溶液中煮沸产生
是橙黄色晶体,可溶于水和稀酸、不溶于乙醇;在强碱溶液中煮沸产生 、
、 ;
; 不易被氧化,
不易被氧化, 有较强还原性。
有较强还原性。
Ⅰ.制备晶体(装置如图1,55℃水浴加热)
Ⅱ.测定产品 中钴元素的含量(装置如图2)
中钴元素的含量(装置如图2)
称取 样品于锥形瓶中,加水溶解。在另一锥形瓶中加入
样品于锥形瓶中,加水溶解。在另一锥形瓶中加入 标准
标准 溶液并置于冰水浴中,向漏斗中加入足量
溶液并置于冰水浴中,向漏斗中加入足量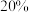 的
的 溶液,加热,保持微沸状态一段时间后,取出插入标准
溶液,加热,保持微沸状态一段时间后,取出插入标准 溶液中的导气管,用蒸馏水冲洗导管内外,洗涤液并入装有标准
溶液中的导气管,用蒸馏水冲洗导管内外,洗涤液并入装有标准 溶液的锥形瓶中。取出锥形瓶,加入指示剂,用
溶液的锥形瓶中。取出锥形瓶,加入指示剂,用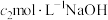 标准溶液滴定剩余的
标准溶液滴定剩余的 ,滴定终点时消耗
,滴定终点时消耗 标准溶液
标准溶液 。
。
回答下列问题:
(1) 制备
制备 的化学方程式为
的化学方程式为___________ 。
(2)仪器a的名称是___________ ;b中的试剂是___________ 。
(3)向 、
、 和活性炭混合液中先加浓氨水目的是
和活性炭混合液中先加浓氨水目的是___________ 。
(4)样品中钴元素的质量分数为___________ (用含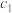 、
、 、
、 、
、 、
、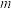 的代数式表示)。若缺少“蒸馏水冲洗导管内外”,会使测定结果
的代数式表示)。若缺少“蒸馏水冲洗导管内外”,会使测定结果___________ (填“偏高”“偏低”或“无影响”)。
(5)① 的空间结构为正八面体,若
的空间结构为正八面体,若 中2个
中2个 被2个
被2个 取代,能得到
取代,能得到___________ 种产物。
②钴(Ⅱ)与氯化钴和氨水以及 反应中若不加活性炭催化剂,可能有
反应中若不加活性炭催化剂,可能有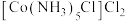 、
、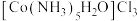 生成。现有
生成。现有 浓度为
浓度为 的
的 或
或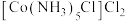 溶液,用
溶液,用 的
的 溶液进行滴定,消耗
溶液进行滴定,消耗 溶液
溶液 ,则该溶液中的溶质为
,则该溶液中的溶质为___________ (填化学式)。
 并测定钴元素的含量。
并测定钴元素的含量。已知:
 是橙黄色晶体,可溶于水和稀酸、不溶于乙醇;在强碱溶液中煮沸产生
是橙黄色晶体,可溶于水和稀酸、不溶于乙醇;在强碱溶液中煮沸产生 、
、 ;
; 不易被氧化,
不易被氧化, 有较强还原性。
有较强还原性。Ⅰ.制备晶体(装置如图1,55℃水浴加热)

Ⅱ.测定产品
 中钴元素的含量(装置如图2)
中钴元素的含量(装置如图2)称取
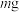 样品于锥形瓶中,加水溶解。在另一锥形瓶中加入
样品于锥形瓶中,加水溶解。在另一锥形瓶中加入 标准
标准 溶液并置于冰水浴中,向漏斗中加入足量
溶液并置于冰水浴中,向漏斗中加入足量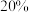 的
的 溶液,加热,保持微沸状态一段时间后,取出插入标准
溶液,加热,保持微沸状态一段时间后,取出插入标准 溶液中的导气管,用蒸馏水冲洗导管内外,洗涤液并入装有标准
溶液中的导气管,用蒸馏水冲洗导管内外,洗涤液并入装有标准 溶液的锥形瓶中。取出锥形瓶,加入指示剂,用
溶液的锥形瓶中。取出锥形瓶,加入指示剂,用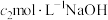 标准溶液滴定剩余的
标准溶液滴定剩余的 ,滴定终点时消耗
,滴定终点时消耗 标准溶液
标准溶液 。
。回答下列问题:
(1)
 制备
制备 的化学方程式为
的化学方程式为(2)仪器a的名称是
(3)向
 、
、 和活性炭混合液中先加浓氨水目的是
和活性炭混合液中先加浓氨水目的是(4)样品中钴元素的质量分数为
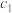 、
、 、
、 、
、 、
、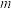 的代数式表示)。若缺少“蒸馏水冲洗导管内外”,会使测定结果
的代数式表示)。若缺少“蒸馏水冲洗导管内外”,会使测定结果(5)①
 的空间结构为正八面体,若
的空间结构为正八面体,若 中2个
中2个 被2个
被2个 取代,能得到
取代,能得到②钴(Ⅱ)与氯化钴和氨水以及
 反应中若不加活性炭催化剂,可能有
反应中若不加活性炭催化剂,可能有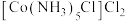 、
、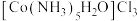 生成。现有
生成。现有 浓度为
浓度为 的
的 或
或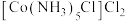 溶液,用
溶液,用 的
的 溶液进行滴定,消耗
溶液进行滴定,消耗 溶液
溶液 ,则该溶液中的溶质为
,则该溶液中的溶质为
您最近一年使用:0次
解题方法
9 . 工业碱的主要成分主要是NaOH和 或
或 和
和 (无其他杂质)。实验室用盐酸做标准溶液,酚酞和甲基橙双指示剂来滴定测定工业碱的组成和含量。已知室温下
(无其他杂质)。实验室用盐酸做标准溶液,酚酞和甲基橙双指示剂来滴定测定工业碱的组成和含量。已知室温下 溶液的pH为8.32,饱和
溶液的pH为8.32,饱和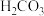 溶液的pH为3.89。实验步骤如下:
溶液的pH为3.89。实验步骤如下:
①量取6.0 盐酸5.0mL加入到245mL蒸馏水中混合均匀备用。
盐酸5.0mL加入到245mL蒸馏水中混合均匀备用。
②称取1.06g无水 置于小烧杯中,加入适量蒸馏水溶解并转移到100mL容量瓶中,定容摇匀后转移到试剂瓶中备用。
置于小烧杯中,加入适量蒸馏水溶解并转移到100mL容量瓶中,定容摇匀后转移到试剂瓶中备用。
③量取15.00mL 溶液,加1~2滴甲基橙,用标准盐酸滴定至溶液由黄色变橙色,3次平行实验所用盐酸平均体积为V mL,计算标准盐酸浓度。
溶液,加1~2滴甲基橙,用标准盐酸滴定至溶液由黄色变橙色,3次平行实验所用盐酸平均体积为V mL,计算标准盐酸浓度。
④称取一定质量的工业碱置于烧杯中,加入适量蒸馏水溶解,配置成250mL溶液。量取25.00mL于锥形瓶中,加入指示剂1,用标准盐酸滴定至终点1,记录所用盐酸体积;再加入指示剂2,继续用标准盐酸滴定至终点2,记录所用盐酸体积。进行3次平行实验,终点1所用标准盐酸平均体积 mL,终点2所用标准盐酸平均体积为
mL,终点2所用标准盐酸平均体积为 mL。
mL。
下列说法正确的是
 或
或 和
和 (无其他杂质)。实验室用盐酸做标准溶液,酚酞和甲基橙双指示剂来滴定测定工业碱的组成和含量。已知室温下
(无其他杂质)。实验室用盐酸做标准溶液,酚酞和甲基橙双指示剂来滴定测定工业碱的组成和含量。已知室温下 溶液的pH为8.32,饱和
溶液的pH为8.32,饱和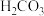 溶液的pH为3.89。实验步骤如下:
溶液的pH为3.89。实验步骤如下:①量取6.0
 盐酸5.0mL加入到245mL蒸馏水中混合均匀备用。
盐酸5.0mL加入到245mL蒸馏水中混合均匀备用。②称取1.06g无水
 置于小烧杯中,加入适量蒸馏水溶解并转移到100mL容量瓶中,定容摇匀后转移到试剂瓶中备用。
置于小烧杯中,加入适量蒸馏水溶解并转移到100mL容量瓶中,定容摇匀后转移到试剂瓶中备用。③量取15.00mL
 溶液,加1~2滴甲基橙,用标准盐酸滴定至溶液由黄色变橙色,3次平行实验所用盐酸平均体积为V mL,计算标准盐酸浓度。
溶液,加1~2滴甲基橙,用标准盐酸滴定至溶液由黄色变橙色,3次平行实验所用盐酸平均体积为V mL,计算标准盐酸浓度。④称取一定质量的工业碱置于烧杯中,加入适量蒸馏水溶解,配置成250mL溶液。量取25.00mL于锥形瓶中,加入指示剂1,用标准盐酸滴定至终点1,记录所用盐酸体积;再加入指示剂2,继续用标准盐酸滴定至终点2,记录所用盐酸体积。进行3次平行实验,终点1所用标准盐酸平均体积
 mL,终点2所用标准盐酸平均体积为
mL,终点2所用标准盐酸平均体积为 mL。
mL。下列说法正确的是
A.标准盐酸的浓度为0.12 |
| B.步骤③中V可能等于12.50mL |
C.若 ,试样的成分为NaOH和 ,试样的成分为NaOH和 |
D.若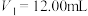 , ,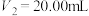 ,则 ,则 的质量分数为34.57% 的质量分数为34.57% |
您最近一年使用:0次
10 . 工业锌粉常用于制造防锈漆等,其主要成分为金属锌,还有少量含锌化合物及其他杂质,锌单质的含量及锌元素的总量影响着工业锌粉的等级。
I.锌的制备
(1)氯氨法炼锌:一定条件下,通入 ,以
,以 浓溶液为浸取剂浸锌,可将矿物中难溶的
浓溶液为浸取剂浸锌,可将矿物中难溶的 转化为
转化为 、
、 等,同时生成S,结合平衡移动原理解释
等,同时生成S,结合平衡移动原理解释 、
、 对浸锌的作用:
对浸锌的作用:_________ 。
(2)酸性介质中电沉积制锌粉:以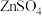 和
和 混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
①阴极的电极反应有_________ 。
②制得65g锌粉时,电解质溶液中 的物质的量至少增加
的物质的量至少增加_________ mol。
(3)离子液体电沉积制锌:80℃时,将 溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:
溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:_________ 。
i.二甲酚橙(In)与 反应:
反应:
EDTA与 反应:
反应: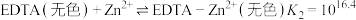
ii. 溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
(4)滴定终点时的现象是_________ 。
(5)计算样品中锌元素的质量分数还需要的实验数据有_________ 。
I.锌的制备
(1)氯氨法炼锌:一定条件下,通入
 ,以
,以 浓溶液为浸取剂浸锌,可将矿物中难溶的
浓溶液为浸取剂浸锌,可将矿物中难溶的 转化为
转化为 、
、 等,同时生成S,结合平衡移动原理解释
等,同时生成S,结合平衡移动原理解释 、
、 对浸锌的作用:
对浸锌的作用:(2)酸性介质中电沉积制锌粉:以
 和
和 混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。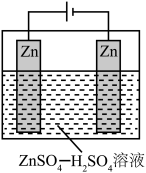

①阴极的电极反应有
②制得65g锌粉时,电解质溶液中
 的物质的量至少增加
的物质的量至少增加(3)离子液体电沉积制锌:80℃时,将
 溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:
溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因: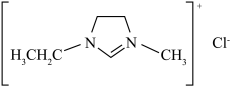

i.二甲酚橙(In)与
 反应:
反应:
EDTA与
 反应:
反应: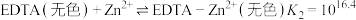
ii.
 溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。(4)滴定终点时的现象是
(5)计算样品中锌元素的质量分数还需要的实验数据有
您最近一年使用:0次