名校
解题方法
1 . 某化学兴趣小组利用如图装置制取并探究二氧化疏的性质。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)
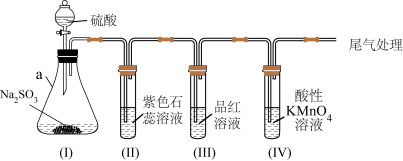
【实验探究】
(1)装置(I)仪器a的名称是___________ 。
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为___________ ,写出相关的化学方程式___________ 。
②装置(III)中品红溶液________ ,原因是________ ,加热后,溶液又恢复_________ ,可用于检验SO2。
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有___________ (填“氧化性”或“还原性”)。
(3)为防止SO2污染空气,尾气可用NaOH溶液吸收,写出该反应的离子方程式___________ 。
(4)用25.2gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为___________ L。(已知Na2SO3的摩尔质量为126g•mol-1)
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现浑浊,补充完整该反应的离子方程式:SO2+2___________ +4H+=3S↓+2H2O。
【知识应用】
(6)二氧化硫可作为食品添加剂。
查阅资料:国家食品添加剂使用标准中二氧化硫最大使用量
说明在严格控制用量的情况下,二氧化硫可被添加到食品中作为漂白剂、防腐剂和___________ (填“氧化剂”或“抗氧化剂”)。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)

【实验探究】
(1)装置(I)仪器a的名称是
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为
②装置(III)中品红溶液
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有
(3)为防止SO2污染空气,尾气可用NaOH溶液吸收,写出该反应的离子方程式
(4)用25.2gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现浑浊,补充完整该反应的离子方程式:SO2+2
【知识应用】
(6)二氧化硫可作为食品添加剂。
查阅资料:国家食品添加剂使用标准中二氧化硫最大使用量
| 食品名称 | 食糖 | 葡萄酒 | 水果干类 |
| SO2最大使用量 | 0.1g∙kg-1 | 0.25g∙kg-1 | 1g∙kg-1 |
您最近一年使用:0次
名校
2 . 某化学兴趣小组利用如图装置制取并探究二氧化疏的性质。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)
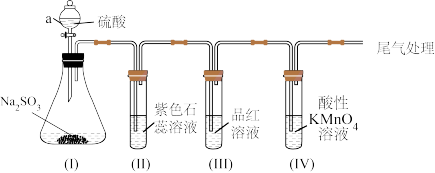
【实验探究】
(1)装置(I)仪器a的名称是___ 。
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为____ ,原因是SO2和水反应生成____ (填“H2SO3”或“H2SO4”)。
②装置(III)中品红溶液褪色,原因是____ 。
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有___ (填“氧化性”或“还原性”)。
(3)为防止SO2污染空气,尾气可用____ (填“NaOH溶液”或“稀硫酸”)吸收。
(4)用12.6gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为___ L。(已知Na2SO3的摩尔质量为126g•mol-1)
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现____ (填“白色”或“淡黄色”)浑浊,补充完整下面的离子方程式:____ 。
SO2+2S2-+4_____=3S↓+2H2O
【知识应用】
(6)二氧化硫可作为食品添加剂。查阅资料:
国家食品添加剂使用标准中二氧化硫最大使用量
说明在严格控制用量的情况下,二氧化硫可被添加到食品中作为漂白剂、防腐剂和____ (填“氧化剂”或“抗氧化剂”)。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)

【实验探究】
(1)装置(I)仪器a的名称是
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为
②装置(III)中品红溶液褪色,原因是
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有
(3)为防止SO2污染空气,尾气可用
(4)用12.6gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现
SO2+2S2-+4_____=3S↓+2H2O
【知识应用】
(6)二氧化硫可作为食品添加剂。查阅资料:
国家食品添加剂使用标准中二氧化硫最大使用量
| 食品名称 | 食糖 | 葡萄酒 | 水果干类 |
| SO2最大使用量 | 0.1g•kg-1 | 0.25g•kg-1 | 1g•kg-1 |
您最近一年使用:0次
2022-07-11更新
|
403次组卷
|
2卷引用:2022年01月福建省普通高中高一学业水平合格性考试真题化学试题
名校
3 . 下表列出了①-⑤五种元素在周期表中的位置:
按要求回答下列问题:
(1)元素⑥的最高正化合价是___________ ,最低负化合价是___________ 。
(2)元素⑤在周期表中的位置是___________ 。
(3)元素②和元素③的非金属性强弱关系是②___________ ③(选“>”或“<”);表中所列六种元素的单质,常温下为有色气体的是___________ (填化学式)。
(4)①~⑥六种元素中原子半径最大的是___________ (填元素符号)。②③两种元素的最简单氢化物中最稳定 的是___________ (填化学式)
(5)元素③与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,常用与呼吸面具中做供氧剂。写出Y与水反应的化学方程式:___________ 。
(6)CH4与NH3相比,热稳定性较强的是___________ ;Cl2和N2氧化性较强的是___________ 。
(7)碳的一种氢化物结构式为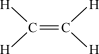 ,其分子式是
,其分子式是___________ ,其中碳元素与氢元素的质量比m(C):m(H)___________ 。(相对原子质量:C-12,C-H)
(8)下列各项性质的比较,符合相关性质递变规律的是___________(填标号)。
族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | ⅢA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ |
(1)元素⑥的最高正化合价是
(2)元素⑤在周期表中的位置是
(3)元素②和元素③的非金属性强弱关系是②
(4)①~⑥六种元素中原子半径最大的是
(5)元素③与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,常用与呼吸面具中做供氧剂。写出Y与水反应的化学方程式:
(6)CH4与NH3相比,热稳定性较强的是
(7)碳的一种氢化物结构式为
 ,其分子式是
,其分子式是(8)下列各项性质的比较,符合相关性质递变规律的是___________(填标号)。
| A.还原性:Na<Mg | B.非金属性:O>S |
| C.酸性:H2S>HCl | D.碱性:NaOH>Al(OH)3 |
您最近一年使用:0次
2022-06-09更新
|
334次组卷
|
3卷引用:福建省三明市第二中学2021-2022学年高一下学期会考模拟卷(一)化学试题
名校
解题方法
4 . 某化学兴趣小组为制取NH3并探究其性质,按下图装置进行实验。【制取氨气的反应原理:2NH4Cl+Ca(OH)2 CaCl2+2NH3+2H2O,部分夹持仪器已略去】
CaCl2+2NH3+2H2O,部分夹持仪器已略去】
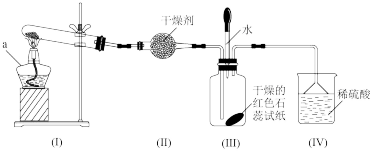
【实验探究】(1)装置(I)中仪器a的名称是_____ 。
(2)装置(Ⅱ)中可用_________ (填“碱石灰”或“食盐”)作干燥剂。
(3)实验进行一段时间后,装置(Ⅲ)中干燥的红色石蕊试纸不变色,然后滴加水,观察到试纸颜色变为___ (填“白色”或“蓝色”)原因是氨水呈____ (填“碱性”或“酸性”)。
(4)装置(Ⅲ)中胶头滴管若改装浓盐酸,实验进行一段时间后,滴加浓盐酸,观察到瓶内充满_______ (填“白烟”或“白雾”),写出NH3与HCl反应生成NH4Cl的化学方程式:_________ 。
(5)装置(IV)中稀硫酸的作用是___________ 。
(6)用0.1 mol NH4Cl与足量Ca(OH)2反应,理论上可生成NH3的物质的量是____ mol。
【实验拓展】(7)已知:2NH3+3CuO 3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为
3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为____ (填“白色”或“红色”),在这过程中NH3表现出__ (填“还原性”或“氧化性”)。
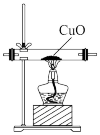
【知识应用】(8)氨气是一种重要的化工原料。写出它的一种用途:__________ 。
 CaCl2+2NH3+2H2O,部分夹持仪器已略去】
CaCl2+2NH3+2H2O,部分夹持仪器已略去】
【实验探究】(1)装置(I)中仪器a的名称是
(2)装置(Ⅱ)中可用
(3)实验进行一段时间后,装置(Ⅲ)中干燥的红色石蕊试纸不变色,然后滴加水,观察到试纸颜色变为
(4)装置(Ⅲ)中胶头滴管若改装浓盐酸,实验进行一段时间后,滴加浓盐酸,观察到瓶内充满
(5)装置(IV)中稀硫酸的作用是
(6)用0.1 mol NH4Cl与足量Ca(OH)2反应,理论上可生成NH3的物质的量是
【实验拓展】(7)已知:2NH3+3CuO
 3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为
3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为
【知识应用】(8)氨气是一种重要的化工原料。写出它的一种用途:
您最近一年使用:0次
2020-07-17更新
|
433次组卷
|
4卷引用:2020年6月福建省普通高中学业水平合格性考试化学试题
2020年6月福建省普通高中学业水平合格性考试化学试题福建省泉州市第七中学 2020--2021 学年高二上学期期末化学学业水平合格性测试二福建省莆田第七中学2021-2022学年高一下学期期中考试化学试题(已下线)专题13 元素及其化合物知识的综合应用-2020年高考真题和模拟题化学分项汇编
5 . 元素周期表是学习和研究化学科学的主要工具。下表是元素周期表的一部分,按要求作答。
(1)元素a位于周期表中第___________ 周期___________ 族。
(2)元素b属于___________ (填“金属”或“非金属”)元素,它的最高化合价是___________ 。
(3)碳的原子结构示意图为___________ 。
(4)地壳中含量最多的元素是___________ 。
(5)O与S中,原子半径较大的是___________ 。
(6) 与
与 中,热稳定性较弱的是
中,热稳定性较弱的是___________ 。
(7) 与
与 中,酸性较弱的是
中,酸性较弱的是___________ 。
(8)LiOH、 和KOH中,碱性最强的是
和KOH中,碱性最强的是___________ ,呈两性的是___________ 。
(9)元素Ca和Cl形成化合物的化学式是___________ ,化学键类型是___________ 。
(10)元素硒(Se)与硫位于同一主族,预测硒及其化合物具有的性质___________(填标号)。
族 周期 |  A A |  A A |  A A |  A A | 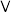 A A |  A A | 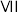 A A |
| 2 | Li | C | O | a | |||
| 3 | b | Al | Si | P | S | Cl | |
| 4 | K | Ca |
(2)元素b属于
(3)碳的原子结构示意图为
(4)地壳中含量最多的元素是
(5)O与S中,原子半径较大的是
(6)
 与
与 中,热稳定性较弱的是
中,热稳定性较弱的是(7)
 与
与 中,酸性较弱的是
中,酸性较弱的是(8)LiOH、
 和KOH中,碱性最强的是
和KOH中,碱性最强的是(9)元素Ca和Cl形成化合物的化学式是
(10)元素硒(Se)与硫位于同一主族,预测硒及其化合物具有的性质___________(填标号)。
A. 只具有氧化性 只具有氧化性 | B.Se的非金属性比S强 |
| C.其单质在常温下呈气态 | D.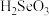 能与NaOH溶液发生反应 能与NaOH溶液发生反应 |
您最近一年使用:0次
名校
6 . 如表是元素周期表的一部分,根据表中给出的10种元素(其中X、Y分别表示某种化学元素),按要求作答。
(1)X、Y两种元素符号分别是____ 和____ 。
(2)Mg的原子序数为____ 。
(3)氧元素位于第二周期第____ 。
(4)表中失电子能力最强的原子是____ 。
(5)表中某原子最外层电子数为4,其元素符号是____ 。
(6)F与N相比,原子半径较小的是____ 。
(7)O2与S单质相比,更难与H2化合的是____ 。
(8)NH3中N元素的化合价为____ ,其水溶液呈____ (填“酸性”或“碱性”)。
(9)Cl2与水反应的生成物中具有漂白作用的是____ (填“HCl”或“HClO”),写出该反应的化学方程式:____ 。
(10)下列各项比较,符合相关性质递变规律的是____ (填标号)。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | N | O | F | X | ||||
| 3 | Na | Y | Al | Si | S | Cl |
(2)Mg的原子序数为
(3)氧元素位于第二周期第
(4)表中失电子能力最强的原子是
(5)表中某原子最外层电子数为4,其元素符号是
(6)F与N相比,原子半径较小的是
(7)O2与S单质相比,更难与H2化合的是
(8)NH3中N元素的化合价为
(9)Cl2与水反应的生成物中具有漂白作用的是
(10)下列各项比较,符合相关性质递变规律的是
| A.氧化性:O2>N2 | B.金属性:Na<Mg |
| C.酸性:H2SO4>HClO4 | D.碱性:NaOH<Mg(OH)2 |
您最近一年使用:0次
2022-07-11更新
|
447次组卷
|
2卷引用:2022年01月福建省普通高中高一学业水平合格性考试真题化学试题
名校
7 . 下表是元素周期表的一部分,根据表中给出的10种元素,按要求作答。
(1)金属性最强的元素是______ ;请表示出其在周期表中的位置______ ;
(2)F的原子结构示意图是_________ ;
(3)地壳中含量最多的元素是__________ ;
(4)Ne原子的最外层电子数是__________ ;
(5)N与O原子半径较大的是__________ ;
(6) 与HCl热稳定性较弱的是
与HCl热稳定性较弱的是_________ ;
(7) 与MgO难与水反应的是
与MgO难与水反应的是_________ ;
(8)用于制造光导纤维的物质是__________ (填“Si”或“ ”);
”);
(9) 与
与 能与强碱反应的是
能与强碱反应的是_______ ;
(10)次氯酸(HClO)具有杀菌漂白作用,其中Cl元素的化合价为_______ ,HClO不稳定,易分解生成HCl和 ,写出其在光照条件下分解的化学方程式:
,写出其在光照条件下分解的化学方程式:_________ ;
(11)下列各项性质的比较,符合相关性质递变规律的是_______(填标号)。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | N | O | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)F的原子结构示意图是
(3)地壳中含量最多的元素是
(4)Ne原子的最外层电子数是
(5)N与O原子半径较大的是
(6)
 与HCl热稳定性较弱的是
与HCl热稳定性较弱的是(7)
 与MgO难与水反应的是
与MgO难与水反应的是(8)用于制造光导纤维的物质是
 ”);
”);(9)
 与
与 能与强碱反应的是
能与强碱反应的是(10)次氯酸(HClO)具有杀菌漂白作用,其中Cl元素的化合价为
 ,写出其在光照条件下分解的化学方程式:
,写出其在光照条件下分解的化学方程式:(11)下列各项性质的比较,符合相关性质递变规律的是_______(填标号)。
| A.金属性:Na<Al | B.氧化性: |
C.酸性: | D.碱性: |
您最近一年使用:0次
解题方法
8 . 某化学兴趣小组为制取氯气并探究其性质,按下列装置(部分夹持仪器已略去)进行实验。
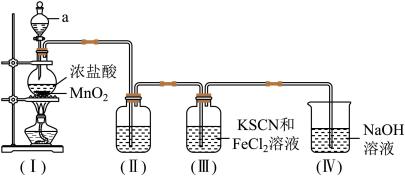
【装置(I)中发生反应的化学方程式:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O】
MnCl2+Cl2↑+2H2O】
【实验探究】
(1)装置(I)中仪器a的名称是___________ 。
(2)为除去Cl2中混有的HCl气体,装置(II)中的溶液是_________ (填“饱和食盐水”或“浓硫酸”)
(3)实验进行一段时间后,装置(III)中溶液颜色变为___________ (填“红色”或“紫色”),该反应中Cl2表现出___________ (填“氧化性”或“还原性”)。
(4)装置(IV)中NaOH溶液的作用是___________ 。
(5)若要生成标准状况下2.24LCl2,理论上参加反应的MnO2的质量是___________ g。(MnO2的摩尔质量为87g·mol-1)
【实验拓展】
(6)图是探究Cl2性质的微型实验,a处是湿润的红纸,b处是浸有淀粉KI溶液的滤纸。向KClO3晶体中滴加浓盐酸后,立即用另一培养皿扣在上面。
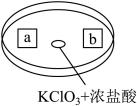
已知:KC1O3+6HCl(浓)=KC1+3C12↑+3H2O
回答下列问题:
①a处湿润的红纸___________ (填“褪色”或“不褪色”)
②b处滤纸变蓝色,写出Cl2与KI反应的化学方程式:___________
【知识应用】
(7)84消毒液(有效成分是NaClO)是常用的消毒剂,NaClO与水和空气里的二氧化碳反应生成___________ 可以消毒杀菌;84消毒液与洁厕灵(其中含盐酸)混合使用会发生反应,补充完整该反应的化学方程式:NaClO+2HCl=NaCl+___________ ↑+H2O。

【装置(I)中发生反应的化学方程式:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O】
MnCl2+Cl2↑+2H2O】【实验探究】
(1)装置(I)中仪器a的名称是
(2)为除去Cl2中混有的HCl气体,装置(II)中的溶液是
(3)实验进行一段时间后,装置(III)中溶液颜色变为
(4)装置(IV)中NaOH溶液的作用是
(5)若要生成标准状况下2.24LCl2,理论上参加反应的MnO2的质量是
【实验拓展】
(6)图是探究Cl2性质的微型实验,a处是湿润的红纸,b处是浸有淀粉KI溶液的滤纸。向KClO3晶体中滴加浓盐酸后,立即用另一培养皿扣在上面。

已知:KC1O3+6HCl(浓)=KC1+3C12↑+3H2O
回答下列问题:
①a处湿润的红纸
②b处滤纸变蓝色,写出Cl2与KI反应的化学方程式:
【知识应用】
(7)84消毒液(有效成分是NaClO)是常用的消毒剂,NaClO与水和空气里的二氧化碳反应生成
您最近一年使用:0次
名校
9 . 某校化学探究小组利用以下装置制取并探究氨气的性质。[已知生石灰与水反应生成Ca(OH)2并放出热量,实验室利用此原理往生石灰中滴加浓氨水,可以快速制取氨气。部分夹持仪器已略去]

[实验探究]
(1)装置(Ⅰ)中生石灰的化学式为_______ ,仪器a的名称是_______ 。
(2)装置(Ⅱ)中的干燥剂可选用_______ (填“碱石灰”或“浓硫酸”)。
(3)在装置(Ⅲ)连接如图所示的装置,用于收集氨气(已知氨气的密度小于空气),氨气应从导管口_______ (填“b”或“c”)通入集气瓶中。

(4)当实验进行一段时间后,挤压装置(Ⅳ)中的胶头滴管,滴入1~2滴浓盐酸,可观察到瓶内产生大量的_______ (填“白烟”或“白雾”);写出NH3与HCl反应的化学方程式:_______ 。
(5)装置(Ⅴ)中仪器d的作用是_______ 。取装置(Ⅴ)中的少量溶液于试管中,滴入1~2滴酚酞试液,溶液显_______ (填“无色”或“红色”),其原因是_______ 。
[知识应用]
(6)液氨用作制冷剂是由于液氨汽化时_______ (填“吸收”或“放出”)大量的热,使周围环境的温度降低。
(7)氨气是工业制硝酸的原料,其第一步反应为4NH3+ 5O2 4NO + 6H2O,在该反应中氨气表现出
4NO + 6H2O,在该反应中氨气表现出_______ (填“氧化性”或“还原性”),若NO 接触空气,观察到的现象是_______ 。

[实验探究]
(1)装置(Ⅰ)中生石灰的化学式为
(2)装置(Ⅱ)中的干燥剂可选用
(3)在装置(Ⅲ)连接如图所示的装置,用于收集氨气(已知氨气的密度小于空气),氨气应从导管口

(4)当实验进行一段时间后,挤压装置(Ⅳ)中的胶头滴管,滴入1~2滴浓盐酸,可观察到瓶内产生大量的
(5)装置(Ⅴ)中仪器d的作用是
[知识应用]
(6)液氨用作制冷剂是由于液氨汽化时
(7)氨气是工业制硝酸的原料,其第一步反应为4NH3+ 5O2
 4NO + 6H2O,在该反应中氨气表现出
4NO + 6H2O,在该反应中氨气表现出
您最近一年使用:0次
解题方法
10 . 化学创造美好生活。下列各项劳动项目与化学原理不相对应 的是
| 选项 | 劳动项目 | 化学原理 |
| A | 用洁厕剂(含盐酸)清洗卫生间 | 盐酸与碱性物质反应 |
| B | 用84消毒液消毒教室桌椅 | 84消毒液具有强氧化性而杀菌消毒 |
| C | 公园的钢铁护栏涂刷多彩防护漆 | 防护漆隔绝潮湿空气以防止钢铁锈蚀 |
| D | 以油脂为原料自制肥皂 | 油脂能溶解油污 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



