解题方法
1 . 高锰酸钾分别在酸性、中性、碱性条件下发生的反应如下:
MnO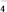 +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
MnO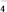 +3e-+2H2O===MnO2↓+4OH-
+3e-+2H2O===MnO2↓+4OH-
MnO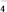 +e-===MnO
+e-===MnO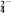 (溶液呈绿色)
(溶液呈绿色)
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的_______ 影响。
(2)将SO2通入高锰酸钾溶液中,发生氧化还原反应的离子方程式为______________ 。
(3)将PbO2投入酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法正确的是________ (填字母)。
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.MnSO4溶液可以用盐酸酸化
MnO
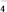 +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2OMnO
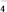 +3e-+2H2O===MnO2↓+4OH-
+3e-+2H2O===MnO2↓+4OH-MnO
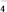 +e-===MnO
+e-===MnO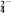 (溶液呈绿色)
(溶液呈绿色)(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的
(2)将SO2通入高锰酸钾溶液中,发生氧化还原反应的离子方程式为
(3)将PbO2投入酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法正确的是
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.MnSO4溶液可以用盐酸酸化
您最近一年使用:0次
解题方法
2 . 氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理。某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性。
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用)。
查阅资料知:氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2和HCl。

(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法: 。
(2)气流从左至右,装置接口连接顺序是:
A→ ( )→( )→( )→( )→( )
(3)装置C中干燥管中所盛试剂的名称是: ,作用是: 。
(4)装置C中酒精灯的作用是: 。
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol·L-1酸性KMnO4标准溶液滴定至终点。(已知还原性Fe2+>Cl-)滴定结果如下表所示:
①写出滴定过程中所发生的2个离子方程式:
、
。
②样品中氯化亚铁的质量分数为 。
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用)。
查阅资料知:氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2和HCl。

(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法: 。
(2)气流从左至右,装置接口连接顺序是:
A→ ( )→( )→( )→( )→( )
(3)装置C中干燥管中所盛试剂的名称是: ,作用是: 。
(4)装置C中酒精灯的作用是: 。
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol·L-1酸性KMnO4标准溶液滴定至终点。(已知还原性Fe2+>Cl-)滴定结果如下表所示:
| 滴定次数 | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 1.04 | 25.03 |
| 2 | 1.98 | 25.99 |
| 3 | 3.20 | 25.24 |
、
。
②样品中氯化亚铁的质量分数为 。
您最近一年使用:0次
2016-12-09更新
|
283次组卷
|
3卷引用:2018届高三一轮复习化学:微考点20-铁及其化合物的实验探究
3 . 某学习小组设计实验,探究二氧化硫的漂白性和还原性。
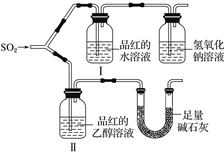
(1)漂白性
甲同学用如图所示装置(气密性良好)进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。
①甲同学作对照实验的目的是_________________________________________ 。
②足量碱石灰的作用是_____________________________________________ 。
甲同学由此得出的实验结论是_________________________________________ 。
(2)还原性
乙同学将SO2通入FeCl3溶液中,使其充分反应。
①SO2与FeCl3反应的离子方程式是____________________ ,检验该反应所得含氧酸根离子的方法是___________________________________________________________ 。
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色。资料显示:红棕色为FeSO3 (墨绿色难溶物)与FeCl3 溶液形成的混合色。 则②中红棕色变为浅绿色的原因是_________________________________________________________ 。
乙同学得出的实验结论是二氧化硫可还原三氯化铁。

(1)漂白性
甲同学用如图所示装置(气密性良好)进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。
①甲同学作对照实验的目的是
②足量碱石灰的作用是
甲同学由此得出的实验结论是
(2)还原性
乙同学将SO2通入FeCl3溶液中,使其充分反应。
①SO2与FeCl3反应的离子方程式是
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色。资料显示:红棕色为FeSO3 (墨绿色难溶物)与FeCl3 溶液形成的混合色。 则②中红棕色变为浅绿色的原因是
乙同学得出的实验结论是二氧化硫可还原三氯化铁。
您最近一年使用:0次
名校
4 . 过氧化钠具有强氧化性,遇木炭、铝粉等还原性物质时可燃烧。下列有关说法不正确的是( )
| A.Na2O2与CO2反应时,Na2O2是氧化剂,CO2是还原剂 |
| B.1mol过氧化钠中阴离子数目为NA |
| C.过氧化钠与木炭、铝粉反应时,过氧化钠均表现出强氧化性 |
| D.过氧化钠与二氧化硫反应时可生成硫酸钠 |
您最近一年使用:0次
2016-12-09更新
|
538次组卷
|
8卷引用:人教版2017-2018学年高一化学必修1:第三章 金属及其化合物-金属钠及其化合物 专项训练习题
名校
5 . 已知;还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图。下列说法正确的是


| A.反应过程中的氧化产物均为Na2SO4 |
| B.a 点时消耗NaHSO3的物质的量为1.0mol |
| C.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O |
| D.当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为1.1mol |
您最近一年使用:0次
2016-12-09更新
|
244次组卷
|
4卷引用:2018届高三一轮复习化学:考点14-氧化还原反应的计算
解题方法
6 . A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:

请回答下列问题:
(1)写出A、B和C的化学式:
A____________ ,B____________ ,C____________ 。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:____________________________________________________ 。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:___________________________________________________ 。
(4)写出由F→H的化学方程式:______________________________ 。

请回答下列问题:
(1)写出A、B和C的化学式:
A
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:
(4)写出由F→H的化学方程式:
您最近一年使用:0次
7 . 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)(2016·衡阳一中高三3月月考)高铁酸钾有以下几种常见制备方法:
干法 Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
湿法 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
电解法 制备中间产物Na2FeO4,再与KOH溶液反应
①干法制备K2FeO4的化学方程式为_____________________________________ ,
氧化剂与还原剂的物质的量之比为____________ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:______________________________________ 。
(2)(2016·青岛高三上学期期末)工业上常采用NaClO氧化法生产高铁酸钾,反应原理为
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为_________________________________________________________________ 。
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH===K2FeO4+2NaOH,K2FeO4在水溶液中易水解:4FeO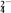 +10H2O4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
+10H2O4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用________ 溶液(填序号)。
A.水 B.NH4Cl、异丙醇
C.Fe(NO3)3、异丙醇 D.CH3COONa、异丙醇
(1)(2016·衡阳一中高三3月月考)高铁酸钾有以下几种常见制备方法:
干法 Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
湿法 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
电解法 制备中间产物Na2FeO4,再与KOH溶液反应
①干法制备K2FeO4的化学方程式为
氧化剂与还原剂的物质的量之比为
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:
(2)(2016·青岛高三上学期期末)工业上常采用NaClO氧化法生产高铁酸钾,反应原理为
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH===K2FeO4+2NaOH,K2FeO4在水溶液中易水解:4FeO
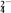 +10H2O4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
+10H2O4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用A.水 B.NH4Cl、异丙醇
C.Fe(NO3)3、异丙醇 D.CH3COONa、异丙醇
您最近一年使用:0次
13-14高三上·福建泉州·期末
名校
解题方法
8 . 已知NH4CuSO3与足量的1 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法合理的是
| A.NH4CuSO3中硫元素被氧化了 |
| B.刺激性气味的气体是二氧化硫或氨气 |
| C.该反应中NH4CuSO3既是氧化剂又是还原剂 |
| D.该反应中硫酸既表现为酸性又表现氧化性 |
您最近一年使用:0次
2020-10-07更新
|
1337次组卷
|
29卷引用:2018届高三一轮复习化学:微考点11-氧化还原反应的概念
2018届高三一轮复习化学:微考点11-氧化还原反应的概念(已下线)2015届浙江省台州中学高三上学期第一次统练化学试卷2019年秋高三化学复习强化练习—— 氮及其化合物河南省信阳市罗山县2020届高三毕业班第一次调研化学试题苏教版(2020)高一必修第一册专题4 总结检测高一必修第二册(人教2019版)第五章 第一节 硫及其化合物 综合训练湖南省长沙市长郡中学2021届高三月考试卷(二)化学试题安徽省定远县育才学校2021届高三上学期第一次月考化学试题上海市七宝中学2021届高三下学期3月摸底考试化学试题湖北省公安县第三中学2020-2021学年高三上学期11月月考化学试题课后-5.1.2 硫酸和硫酸根离子的检验 -人教2019必修第二册湖北省荆州市公安县第三中学2022-2023学年高三上学期8月月考化学试题安徽省宿州市第二中学2022-2023学年高一上学期第一次月考化学试题安徽省亳州市第一中学2022-2023学年高一下学期第一次月考化学试题河南省郑州外国语学校2022-2023学年高一下学期第一次月考化学试题湖北省武昌实验中学2022-2023学年高一下学期3月月考化学试题上海市进才中学2022-2023学年高一下学期5月月考化学试题河南省焦作市沁阳市第一中学2022-2023学年高一下学期6月份月考 化学试题(已下线)2013届福建省南安一中高三上学期期末考试化学试卷2016届宁夏六盘山高级中学高三上学期期中考试化学试卷2017届浙江省温州中学高三上10月高考模拟化学试卷浙江省2018版考前特训(2017年10月)学考70快练:3 化学反应类型及氧化还原反应概念山东省济宁市微山县第二中学2018届高三上学期第一次月考化学试题(已下线)【浙江新东方】双师(27)(已下线)【浙江新东方】绍兴qw78安徽省淮北师范大学附属实验中学2022-2023学年高一下学期第一次月考化学试题湖北省恩施州高中教育联盟2022-2023学年高一下学期期中考试化学试题湖南省衡阳县第四中学2022-2023学年高一下学期第一次(3月)月考化学试题山东省淄博市张店区潘庄高级中学2023-2024学年高一下学期第一次月考化学试题
2014·北京东城·零模
名校
解题方法
9 . 某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置:(部分夹持装置已略去)

(1)写出A中反应的离子方程式________________________________________ 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式___________________________ 。
(3)试从原子结构角度解释氯的氧化性大于硫的原因____________________________________ 。
(4)D中干燥管中出现的现象及化学方程式__________________________________________ 。
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请画出其装置图______ (并注明盛装试剂)。
(6)还有什么方法能证明氧化性Cl2> S,用一种相关事实说明_____________________________ 。

(1)写出A中反应的离子方程式
(2)B中出现黄色浑浊现象,产生此现象的离子方程式
(3)试从原子结构角度解释氯的氧化性大于硫的原因
(4)D中干燥管中出现的现象及化学方程式
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请画出其装置图
(6)还有什么方法能证明氧化性Cl2> S,用一种相关事实说明
您最近一年使用:0次
2016-12-09更新
|
661次组卷
|
7卷引用:2018届高三一轮复习化学:微考点26-氯水和常见漂白剂性质探究
2018届高三一轮复习化学:微考点26-氯水和常见漂白剂性质探究(已下线)2014届北京市东城区高三下学期零模诊断理综化学试卷(已下线)2014高考名师推荐化学化学平衡图像(已下线)易错22 气体实验装置的设计-备战2021年高考化学一轮复习易错题福建2020届高三化学总复习专题训练——化学综合实验题安徽省芜湖市2021届高三第二次月考化学试题福建省连城县第一中学2020-2021学年高一下学期第一次月考化学试题
10 . 已知酸性高锰酸钾溶液可以氧化FeSO4,反应的化学方程式为2KMnO4+10FeSO4+8H2SO4===K2SO4+X+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液(假设I-与KMnO4反应的氧化产物为I2),混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示。则下列有关说法不正确的是


| A.方程式中的X为2MnSO4 |
| B.氧化性:KMnO4>Fe3+>I2 |
| C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.30 mol |
| D.AB段是高锰酸钾和碘化钾溶液反应,BC段的反应为2Fe3++2I-=2Fe2++I2 |
您最近一年使用:0次
2019-03-04更新
|
186次组卷
|
4卷引用:2018届高三一轮复习化学:考点12-氧化性、还原性强弱的比较
2018届高三一轮复习化学:考点12-氧化性、还原性强弱的比较2016届湖北省孝感高级中学高三9月调考化学试卷(已下线)考点05 氧化还原反应——备战2019年浙江新高考化学考点安徽省芜湖市2021届高三第二次月考化学试题



