10-11高三上·福建莆田·期中
解题方法
1 . 某校化学实验兴趣小组在“探究溴水与氯化亚铁溶液反应”的实验中发现:在足量的稀氯化亚铁溶液中,加入1—2滴溴水,振荡后溶液呈黄色。查阅资料显示:溴水是溴(Br2)的水溶液,呈黄色;溴水中含有溴单质。
(1)提出问题:Fe3+、Br2,谁的氧化性更强。
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含_______ (填化学式,下同)所致
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_______ 所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
除氯化亚铁溶液和溴水外,还有供选用的试剂:
a、酚酞试液;b、CCl4;c、无水酒精;d、KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)
(4)结论:氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1—2滴溴水,溶液呈黄色所发生的离子反应方程式为_______
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是_______ (填离子的化学式)。
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_______ 。
(1)提出问题:Fe3+、Br2,谁的氧化性更强。
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
除氯化亚铁溶液和溴水外,还有供选用的试剂:
a、酚酞试液;b、CCl4;c、无水酒精;d、KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为
您最近一年使用:0次
2019-01-30更新
|
450次组卷
|
7卷引用:上海市长宁区2022-2023学年高一上学期学业综合评价化学试题
上海市长宁区2022-2023学年高一上学期学业综合评价化学试题(已下线)2011届福建省莆田一中高三上学期期中考试化学试卷(已下线)2012届福建省莆田一中高三第一学段考试化学试卷(已下线)2015届河南郑州市第四十七中学高三上第一次(10月)月考化学试卷(已下线)2014届浙江省衢州第二中学高三上学期期中考试化学试卷2016届河南省周口中英文学校高三上学期期中测试化学试卷(已下线)专题九 铁及其化合物
2 . 天然气中常混有 ,现用如下方法测定天然气中
,现用如下方法测定天然气中 的含量。反应中涉及的方程式有:
的含量。反应中涉及的方程式有:
①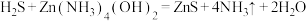
②
③
(1)反应①中, 体现
体现_______ (选填“酸性”“氧化性”或“还原性”)。
采用以下方法测定 的含量。
的含量。
步骤I:将1L天然气中的 溶于水并进行反应①,配制成500mL溶液。
溶于水并进行反应①,配制成500mL溶液。
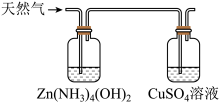
步骤II:加入0.001mol的I2(过量)使ZnS完全转化为ZnI2,加入淀粉溶液作为指示剂,用0.1mol·L-1的 滴定过量的I2,做几组平行实验,平均消耗15.00mL。
滴定过量的I2,做几组平行实验,平均消耗15.00mL。
(2)①滴定达到终点的现象为:溶液由_______ 色变_______ 色,且半分钟不恢复原色。
②根据条件计算天然气中H2S的含量为_______ mg·L-1。
③若在步骤I收集H2S的过程中,有少量硫化氢进入 溶液中,则测得H2S的含量
溶液中,则测得H2S的含量_______ (选填“偏高”“偏低”或“无影响”)。
(3)假设在反应②中,碘单质全部转化为易溶于水的ZnI2,如何检验体系中的I-_______ 。
(4)利用硫碘循环处理H2S的方法如图所示:
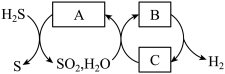
写出上述流程中A、B、C的化学式。
A:_______ ;B:_______ ;C:_______ 。
 ,现用如下方法测定天然气中
,现用如下方法测定天然气中 的含量。反应中涉及的方程式有:
的含量。反应中涉及的方程式有:①
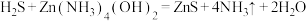
②

③

(1)反应①中,
 体现
体现采用以下方法测定
 的含量。
的含量。步骤I:将1L天然气中的
 溶于水并进行反应①,配制成500mL溶液。
溶于水并进行反应①,配制成500mL溶液。
步骤II:加入0.001mol的I2(过量)使ZnS完全转化为ZnI2,加入淀粉溶液作为指示剂,用0.1mol·L-1的
 滴定过量的I2,做几组平行实验,平均消耗15.00mL。
滴定过量的I2,做几组平行实验,平均消耗15.00mL。(2)①滴定达到终点的现象为:溶液由
②根据条件计算天然气中H2S的含量为
③若在步骤I收集H2S的过程中,有少量硫化氢进入
 溶液中,则测得H2S的含量
溶液中,则测得H2S的含量(3)假设在反应②中,碘单质全部转化为易溶于水的ZnI2,如何检验体系中的I-
(4)利用硫碘循环处理H2S的方法如图所示:

写出上述流程中A、B、C的化学式。
A:
您最近一年使用:0次
3 . “84消毒液”是常见的消毒剂,其有效成分是NaClO。
(1)Cl2和NaOH制备NaClO的化学方程式为___________ 。
(2)如图是某品牌“84消毒液”的使用注意事项。
①注意事项4“易使有色衣物脱色”,是因为“84消毒液”具有___________ 。
A.碱性 B.强氧化性
②注意事项6“不可与酸性物质同时使用”,例如,若将“84消毒液”与“洁厕灵”(含盐酸)同时使用会生成黄绿色有毒气体。写出反应的离子方程式___________ 。
(1)Cl2和NaOH制备NaClO的化学方程式为
(2)如图是某品牌“84消毒液”的使用注意事项。
| 注意事项 1、外用消毒液,勿口服; 2、现用现配,使用时注意戴手套防护; 3、不适用于钢和铝制品的消毒; 4、易使有色衣物脱色; 5、避光、阴凉处保存; 6、不可与酸性物质同时使用。 |
A.碱性 B.强氧化性
②注意事项6“不可与酸性物质同时使用”,例如,若将“84消毒液”与“洁厕灵”(含盐酸)同时使用会生成黄绿色有毒气体。写出反应的离子方程式
您最近一年使用:0次
名校
4 . 卤族元素在性质上具有相似性与递变性。为了验证卤族部分元素递变规律,设计如图装置进行实验。请回答下列问题。
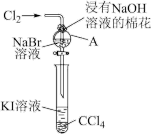
(1)A中发生反应的化学方程式是_______ 。
(2)根据上述实验操作步骤,为确保“非金属性:氯>溴>碘”的实验结论可靠,你认为做好本实验最关键因素是_______ 。
(3)下列性质的递变规律正确,且能作为卤族元素非金属性递变规律判断依据的是
IBr、 ICl等称为卤素互化物,(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
(4)氯化碘 ( ICl)能与水发生反应:ICl+H2O= HIO+ HCl,该反应_______  填“是”或“不是”
填“是”或“不是” 氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为
氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为_______ 。
(5)从原子结构角度解释分子(CN)2中两种元素非金属性的强弱_______ 。
(6)已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。在NaBr和KSCN的混合溶液中通入(CN)2,反应的离子方程式为_______ 。
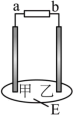
(7)如图所示,E是用饱和NaCl溶液和淀粉-KI溶液的混合液湿润的滤纸,用石墨做电极,通电后发现乙周围滤纸褪为蓝色,则下列判断正确的是
(8)下图是用强光照射广口瓶中新制氯水时传感器所获得数据的图像,下列各项代表纵坐标的物理量,其中与图像不相符的是

(9)下列变化不需要破坏化学键的是

(1)A中发生反应的化学方程式是
(2)根据上述实验操作步骤,为确保“非金属性:氯>溴>碘”的实验结论可靠,你认为做好本实验最关键因素是
(3)下列性质的递变规律正确,且能作为卤族元素非金属性递变规律判断依据的是
| A.Cl-、Br-、I-的还原性逐渐增强 | B.Cl2、Br2、I2的熔点逐渐升高 |
| C.HCl、HBr、HI的酸性逐渐减弱 | D.HCl、HBr、HI的稳定性逐渐减弱 |
IBr、 ICl等称为卤素互化物,(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
(4)氯化碘 ( ICl)能与水发生反应:ICl+H2O= HIO+ HCl,该反应
 填“是”或“不是”
填“是”或“不是” 氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为
氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为(5)从原子结构角度解释分子(CN)2中两种元素非金属性的强弱
(6)已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。在NaBr和KSCN的混合溶液中通入(CN)2,反应的离子方程式为
(7)如图所示,E是用饱和NaCl溶液和淀粉-KI溶液的混合液湿润的滤纸,用石墨做电极,通电后发现乙周围滤纸褪为蓝色,则下列判断正确的是

| A.b是阳极,a是阴极 | B.a是正极,b是负极 |
| C.乙是正极,甲是负极 | D.乙是阳极,甲是阴极 |

| A.溶液中氯离子的浓度 | B.溶液的 pH |
| C.瓶中氧气的体积分数 | D.溶液的导电能力 |
| A.液态水变为水蒸气 | B.HCl 气体溶于水 |
| C.NaHCO3 受热分解 | D.NaCl 熔化 |
您最近一年使用:0次
5 . 生产自来水时需通入Cl2杀菌消毒,主要是由于Cl2和H2O反应生成的HClO具有
| A.氧化性 | B.酸性 | C.还原性 | D.稳定性 |
您最近一年使用:0次
2019-06-23更新
|
412次组卷
|
8卷引用:2019年上海市浦东新区高中学业水平合格考试(模拟)化学试题
解题方法
6 . 某小组想通过实验探究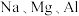 三种金属元素性质的递变规律。
三种金属元素性质的递变规律。
1.下表是元素周期表的一部分,将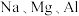 三种元素填入相应位置
三种元素填入相应位置_______ 。
I.探究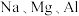 分别与水反应的情况。
分别与水反应的情况。
实验①切一小块绿豆大小的金属 ,用滤纸吸干其表面的煤油,将其投入盛有
,用滤纸吸干其表面的煤油,将其投入盛有 水(含酚酞)的烧杯中。观察到
水(含酚酞)的烧杯中。观察到 与冷水发生剧烈反应,烧杯内溶液变红。
与冷水发生剧烈反应,烧杯内溶液变红。
2. 与
与 反应生成
反应生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ 。该反应中作还原剂的是_______ 。
A. B.
B. C.
C.
3. 溶液中使酚酞试液变红的微粒是
溶液中使酚酞试液变红的微粒是_______ 。
A. B.
B. C.
C.
实验②分别取一小段镁条和铝条,放入两支试管中,向试管中各加入 水,再滴入2滴酚酞试液,观察到试管中均无明显现象。
水,再滴入2滴酚酞试液,观察到试管中均无明显现象。
有同学提出实验②的设计存在问题,故对实验②作如下调整:
实验③另取镁条和铝条,分别用砂纸打磨去除它们表面的氧化膜后,再进行以上实验操作并加热。观察到:未加热时,反应现象均不明显;加热后镁条表面有气泡生成,溶液变红;加热后 与水反应现象仍不明显。
与水反应现象仍不明显。
4.实验②的设计中未考虑到的因素是_______ 。
5.通过上述实验,得出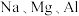 的金属性由强到弱顺序
的金属性由强到弱顺序_______ 。
A. B.
B.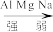
6.除反应物自身性质外,上述实验还验证了化学反应速率与_______ 有关。
Ⅱ.比较 碱性的强弱。
碱性的强弱。
实验④在试管中加入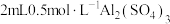 溶液,然后逐滴滴加
溶液,然后逐滴滴加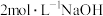 溶液至过量,边加边振荡。观察到试管中先出现白色沉淀后全部溶解。
溶液至过量,边加边振荡。观察到试管中先出现白色沉淀后全部溶解。
实验⑤在试管中加入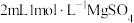 溶液,然后逐滴滴加
溶液,然后逐滴滴加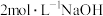 溶液至过量,边加边振荡。观察到试管中出现白色沉淀且不溶解。
溶液至过量,边加边振荡。观察到试管中出现白色沉淀且不溶解。
7.写出由实验④、⑤的实验现象可推导得出的结论。
8.综上实验可知, 的碱性由强到弱顺序:
的碱性由强到弱顺序:_______ 。
A.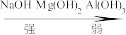 B.
B.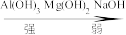
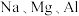 三种金属元素性质的递变规律。
三种金属元素性质的递变规律。1.下表是元素周期表的一部分,将
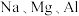 三种元素填入相应位置
三种元素填入相应位置H | |||
C | |||
I.探究
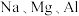 分别与水反应的情况。
分别与水反应的情况。实验①切一小块绿豆大小的金属
 ,用滤纸吸干其表面的煤油,将其投入盛有
,用滤纸吸干其表面的煤油,将其投入盛有 水(含酚酞)的烧杯中。观察到
水(含酚酞)的烧杯中。观察到 与冷水发生剧烈反应,烧杯内溶液变红。
与冷水发生剧烈反应,烧杯内溶液变红。2.
 与
与 反应生成
反应生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式A.
 B.
B. C.
C.
3.
 溶液中使酚酞试液变红的微粒是
溶液中使酚酞试液变红的微粒是A.
 B.
B. C.
C.
实验②分别取一小段镁条和铝条,放入两支试管中,向试管中各加入
 水,再滴入2滴酚酞试液,观察到试管中均无明显现象。
水,再滴入2滴酚酞试液,观察到试管中均无明显现象。有同学提出实验②的设计存在问题,故对实验②作如下调整:
实验③另取镁条和铝条,分别用砂纸打磨去除它们表面的氧化膜后,再进行以上实验操作并加热。观察到:未加热时,反应现象均不明显;加热后镁条表面有气泡生成,溶液变红;加热后
 与水反应现象仍不明显。
与水反应现象仍不明显。4.实验②的设计中未考虑到的因素是
5.通过上述实验,得出
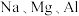 的金属性由强到弱顺序
的金属性由强到弱顺序A.
 B.
B.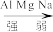
6.除反应物自身性质外,上述实验还验证了化学反应速率与
Ⅱ.比较
 碱性的强弱。
碱性的强弱。实验④在试管中加入
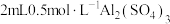 溶液,然后逐滴滴加
溶液,然后逐滴滴加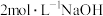 溶液至过量,边加边振荡。观察到试管中先出现白色沉淀后全部溶解。
溶液至过量,边加边振荡。观察到试管中先出现白色沉淀后全部溶解。实验⑤在试管中加入
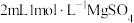 溶液,然后逐滴滴加
溶液,然后逐滴滴加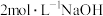 溶液至过量,边加边振荡。观察到试管中出现白色沉淀且不溶解。
溶液至过量,边加边振荡。观察到试管中出现白色沉淀且不溶解。7.写出由实验④、⑤的实验现象可推导得出的结论。
实验序号 | 现象 | 结论 |
④ | 出现白色沉淀 |
|
沉淀全部溶解 | ||
⑤ | 出现白色沉淀 | |
沉淀不溶解 |
|
 的碱性由强到弱顺序:
的碱性由强到弱顺序:A.
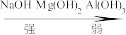 B.
B.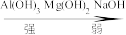
您最近一年使用:0次
7 . 将SO2通入含有I2的淀粉溶液中,体现SO2的( )
| A.漂白性 | B.还原性 | C.氧化性 | D.酸性氧化物 |
您最近一年使用:0次
8 . 含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-2、0、+4、+6四种,其不同价态的物质间可相互转化,完成下列填空:
(1)写出硫与铁反应的化学方程式_____________________ ,所得产物的颜色为_________ 。
(2)将硫化氢气体与二氧化硫气体在集气瓶中混合发生反应,现象是___________ ,硫化氢呈现______ (选填“氧化性”、“还原性”)。
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是_________ 。
(4)硫酸盐的种类很多,且应用广泛,医疗上采用____ 作X射线透视肠胃的内服药剂。
(1)写出硫与铁反应的化学方程式
(2)将硫化氢气体与二氧化硫气体在集气瓶中混合发生反应,现象是
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是
(4)硫酸盐的种类很多,且应用广泛,医疗上采用
您最近一年使用:0次
9 . 能用于比较 与S非金属性强弱的依据是
与S非金属性强弱的依据是
 与S非金属性强弱的依据是
与S非金属性强弱的依据是| A.熔沸点:硫单质>氯单质 | B.酸性: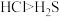 |
C.热稳定性: | D.氧化性: |
您最近一年使用:0次
10 . 长征五号B运载火箭中使用了耐热性佳,导热性好的氮化铝陶瓷。已知:Al4C3+4NH3=4AlN+3CH4。回答下列问题:
(1)碳原子核外电子中未成对电子数是_____ ,氨气的电子式是_____ 。
(2)AlN是由共价键直接形成的晶体,硬度大、熔点高,它是_____ 晶体。上述反应中形成相同电子层结构离子的元素,其简单离子半径由大到小的顺序是_____ 。
(3)比较非金属性N>C正确的是_____
a.HNO3酸性大于H2CO3
b.N最高价为+5,C最高价为+4
c.HNO3氧化性大于H2CO3
d.H3C﹣NH2中C﹣N共用电子对偏向N
(4)AlN遇水会发生水解,反应的化学方程式为:_____ ,AlN在80℃和90℃水中完全水解,测得水解后溶液的pH(80℃)>pH(90℃),试从平衡移动角度解释其原因:_____ 。 (不考虑水的离子积变化和Al(OH)3电离)。
(5)向Al(OH)3悬浊液中加入NaOH溶液至沉淀恰好完全溶解,写出反应的离子方程式:_____ 。溶液中c(Na+)_____ c(AlO ) (填“>”或“<”),欲使c(Na+):c(AlO
) (填“>”或“<”),欲使c(Na+):c(AlO )=1:1,可加入
)=1:1,可加入_____ 。
(1)碳原子核外电子中未成对电子数是
(2)AlN是由共价键直接形成的晶体,硬度大、熔点高,它是
(3)比较非金属性N>C正确的是
a.HNO3酸性大于H2CO3
b.N最高价为+5,C最高价为+4
c.HNO3氧化性大于H2CO3
d.H3C﹣NH2中C﹣N共用电子对偏向N
(4)AlN遇水会发生水解,反应的化学方程式为:
(5)向Al(OH)3悬浊液中加入NaOH溶液至沉淀恰好完全溶解,写出反应的离子方程式:
 ) (填“>”或“<”),欲使c(Na+):c(AlO
) (填“>”或“<”),欲使c(Na+):c(AlO )=1:1,可加入
)=1:1,可加入
您最近一年使用:0次

 的碱性比
的碱性比 无酸性
无酸性

