1 . 氨能被氧气氧化,经一系列反应得到硝酸。分析如图实验所得结论错误的是
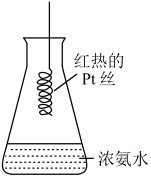
| A.浓氨水具有挥发性 |
B.浓氨水中含有的微粒有NH3·H2O、H2O、NH3、 、OH-、H+ 、OH-、H+ |
| C.若Pt丝始终保持红热,则该反应放热,催化剂是Pt |
| D.锥形瓶口有少量红棕色气体出现,图中反应为4NH3+7O2=4NO2+6H2O |
您最近一年使用:0次
13-14高二下·宁夏银川·期末
2 . 下列说法或有关化学用语的表达正确的是
| A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 |
B.基态Fe原子的外围电子排布图为: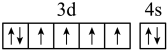 |
| C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 |
| D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |
您最近一年使用:0次
2024-02-04更新
|
219次组卷
|
62卷引用:2015-2016学年贵州省思南中学高二下期中化学试卷
2015-2016学年贵州省思南中学高二下期中化学试卷2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2015-2016学年辽宁省五校协作体高二下学期期中考试化学试卷贵州省思南中学2016-2017学年高二下学期期末考试化学试题内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高二下学期期中考试化学试题陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题吉林省长春市第二十九中学2019-2020学年高二下学期期中考试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题福建省莆田市仙游县第二中学2019-2020学年高二下学期期中考试化学试题四川省南充市阆中中学2020-2021学年高二上学期期中考试化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期期中考试化学试题天津市实验中学滨海学校2020-2021学年高二下学期期中化学试题甘肃省武威第十八中学2020-2021学年高二下学期期中考试化学试题四川省遂宁市第二中学校2021-2022学年高二上学期期中考试化学试题安徽省合肥市肥东县综合高中2021-2022学年高二下学期期中考试化学试题福建省泉州科技中学2021-2022学年高二下学期期中考试化学试题宁夏青铜峡市宁朔中学2022-2023学年高二下学期期中考试化学试题四川省广元中学2022-2023学年高二下学期5月期中考试化学试题安徽省安庆市第二中学2022-2023学年高二下学期期中考试化学试题(已下线)2013-2014宁夏银川一中高二下学期期末考试化学试卷2015-2016学年山西省大同一中高二下3月月考化学试卷2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷山西省大同市第一中学2016-2017学年高二5月月考化学试题新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题2017-2018学年人教版高中化学选修三 模块综合质量检测吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题四川省广安市第二中学校2017-2018学年高二下学期第二次月考化学试题山西省沁县中学2018-2019学年高二下学期第一次月考化学试题吉林省扶余市第一中学2018-2019学年高二下学期第一次月考化学试题山东省聊城市2019-2020学年高三化学一轮复习《物质结构与性质(》模拟测试四川省广安第二中学校2017-2018学年高二下学期第一次月考化学试题辽宁省丹东市2017-2018学年高二下学期期末质量监测化学试题广西靖西市第二中学2019-2020学年高二下学期开学考试化学试题江苏省如东高级中学2019-2020学年高一下学期第二次阶段测试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题(已下线)模块同步卷12 综合检测卷(提升卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记山东省济南市济阳区闻韶中学2020-2021学年高三(3班)12月第一次模拟考试化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题辽宁省沈阳市辽中区第一高级中学2020-2021学年高二下学期开学考试化学试题(已下线)作业02 原子结构与元素的性质-2021年高二化学暑假作业(人教版2019)新疆昌吉教育共同体2020-2021学年高二下学期期末质量检测化学试题福建省漳州市正兴学校2020-2021学年高二下学期期末考试化学试题宁夏银川市第六中学2020-2021学年高二下学期期末考试化学试题辽宁省本溪市第二高级中学2021-2022学年高二上学期期末考试化学试题山西省长治市沁源县第一中学等名校2021-2022学年高二下学期5月联考化学试题吉林地区普通高中友好学校联合体2021-2022学年高二下学期期末考试化学试题第一章 本章复习提升1云南省石屏县第一中学2021-2022学年高二下学期3月份考试化学试题福建省莆田市第一中学2021-2022学年高二下学期期末考试化学试题四川省广安市邻水县二中 2022-2023学年高三上学期9月考化学试题甘肃省庆阳市第六中学2021-2022学年高二下学期期末考试化学试题新疆克拉玛依市高级中学2021-2022学年高二下学期期末考试化学试题重庆市荣昌永荣中学校2021-2022学年高二下学期期末考试化学试题山东省新泰市第一中学2022-2023学年高二下学期第一次大单元考试化学试题山东省青岛第十九中学2022-2023学年高二下学期4月月考化学试题河北省唐山市开滦一中2022-2023学年高二下学期期末考试化学试题吉林省普通高中友好学校联合体2023-2024学年高二上学期第三十七届基础年段期末联考化学试题湖南省长郡中学2023-2024学年高二下学期寒假检测(开学考试)化学试题湖北省武汉西藏中学2023-2024学年高二下学期4月月考化学试题(已下线)猜想01 原子结构与性质 【考题猜想】(8大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
解题方法
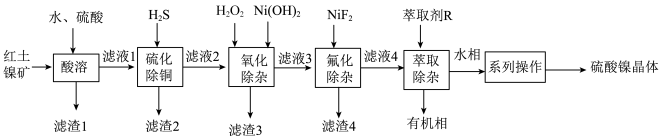
3 . 硫酸镍广泛应用于电镀、电池等工业。现以红土镍矿(主要成分为 ,含
,含 、
、 、
、 、
、 、
、 、
、 、
、 、
、 等杂质)为原料制备硫酸镍,工艺流程如下:
等杂质)为原料制备硫酸镍,工艺流程如下:
已知:①相关金属离子[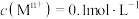 ]形成氢氧化物沉淀的
]形成氢氧化物沉淀的 范围如下:
范围如下:
②当离子完全沉淀时, 。
。
③硫酸镍晶体 可溶于水,不溶于乙醇和乙醚,乙醚微溶于水。
可溶于水,不溶于乙醇和乙醚,乙醚微溶于水。
④硫酸镍在水中溶解度随温度变化的曲线如图所示。回答下列问题:

(1)为加快“酸溶”速率,可采取的措施有___________ (任写一条)。“滤渣2”的主要成分有 和
和___________ (填化学式)。
(2)写出“氧化除杂”过程中加入 涉及反应的离子方程式
涉及反应的离子方程式___________ 。
(3)“氧化除杂”中加入 的作用是
的作用是___________ ,溶液的 应调节为
应调节为___________  之间。
之间。
(4)萃取后的所得的水相“系列操作”包括___________ 、过滤、洗涤得到硫酸镍晶体。
(5)洗涤过程中最好选择___________进行洗涤。
 ,含
,含 、
、 、
、 、
、 、
、 、
、 、
、 、
、 等杂质)为原料制备硫酸镍,工艺流程如下:
等杂质)为原料制备硫酸镍,工艺流程如下:
已知:①相关金属离子[
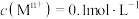 ]形成氢氧化物沉淀的
]形成氢氧化物沉淀的 范围如下:
范围如下:| 金属离子 |  |  |  |  |  |  |
开始沉淀的 | 6.3 | 1.8 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的 | 8.3 | 3.2 | 4.7 | 10.9 | 8.2 | 8.9 |
 。
。③硫酸镍晶体
 可溶于水,不溶于乙醇和乙醚,乙醚微溶于水。
可溶于水,不溶于乙醇和乙醚,乙醚微溶于水。④硫酸镍在水中溶解度随温度变化的曲线如图所示。回答下列问题:

(1)为加快“酸溶”速率,可采取的措施有
 和
和(2)写出“氧化除杂”过程中加入
 涉及反应的离子方程式
涉及反应的离子方程式(3)“氧化除杂”中加入
 的作用是
的作用是 应调节为
应调节为 之间。
之间。(4)萃取后的所得的水相“系列操作”包括
(5)洗涤过程中最好选择___________进行洗涤。
| A.蒸馏水 | B.无水乙醇 | C.乙醚 | D.稀盐酸 |
您最近一年使用:0次
2023-10-23更新
|
189次组卷
|
2卷引用:贵州省黔东南州从江县2023-2024学年高三上学期期中检测化学试题
4 . 烟气中的主要污染物为SO2、NOx,随意排放会导致酸雨等,因此烟气中的氮氧化物和硫氧化物需要消除,从而实现绿色可持续发展。
处理方法一:烟气经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NO的主要反应的热化学方程式如下:
Ⅰ.NO(g)+O3(g) NO2(g)+O2(g) △H=-200.9kJ•mol-1
NO2(g)+O2(g) △H=-200.9kJ•mol-1
Ⅱ.NO(g)+ O2(g)
O2(g) NO2(g) △H=-58.2kJ•mol-1
NO2(g) △H=-58.2kJ•mol-1
Ⅲ.SO2(g)+O3(g) SO3(g)+O2(g) △H=-241.6kJ•mol-1
SO3(g)+O2(g) △H=-241.6kJ•mol-1
回答下列问题
(1)反应3NO(g)+O3(g) 3NO2(g)在
3NO2(g)在_____ (填“高温”或“低温”)条件下能自发进行。
(2)某温度下,在2L恒容密闭容器中通入等物质的量的NO和O3,只发生反应3NO(g)+O3(g) 3NO2(g)。
3NO2(g)。
①下列能说明该反应达到平衡状态的是_____ (填标号)。
a.混合气体颜色不再改变 b.混合气体密度不再改变
c.体系中NO与O3的物质的量相同 d.容器内压强不再改变
②t1时刻反应达到平衡,t2时刻改变外界条件,t3时重新达到平衡,NO转化率随时间变化如图所示,则t2时刻改变的条件可能是_____ (填标号)。

A.升高温度 B.通入稀有气体
C.向体系中再通入一定量的O3 D.加入催化剂
(3)在一定温度下,向2L恒容密闭容器中充入2molSO2(g)和2molO3(g),发生反应SO2(g)+O3(g) SO3(g)+O2(g),初始压强为p0,5min时,测得容器中O3和SO3体积分数相同。
SO3(g)+O2(g),初始压强为p0,5min时,测得容器中O3和SO3体积分数相同。
①0~5min内,SO2的平均反应速率v(SO2)=______ mol•L-1•min-1。
②达到平衡时,O3的体积分数为30%,则平衡分压常数Kp=_____ (分压=物质的量分数×总压)。
处理方法二:烟气中的NO、SO2可通过电解法除去并获得氨水和硫酸,其原理如图所示。
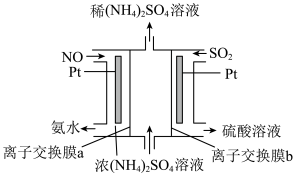
(4)该电解池阳极的电极反应式为_____ ,离子交换膜a是_____ (填“阴”或“阳”)离子交换膜。
处理方法一:烟气经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NO的主要反应的热化学方程式如下:
Ⅰ.NO(g)+O3(g)
 NO2(g)+O2(g) △H=-200.9kJ•mol-1
NO2(g)+O2(g) △H=-200.9kJ•mol-1Ⅱ.NO(g)+
 O2(g)
O2(g) NO2(g) △H=-58.2kJ•mol-1
NO2(g) △H=-58.2kJ•mol-1Ⅲ.SO2(g)+O3(g)
 SO3(g)+O2(g) △H=-241.6kJ•mol-1
SO3(g)+O2(g) △H=-241.6kJ•mol-1回答下列问题
(1)反应3NO(g)+O3(g)
 3NO2(g)在
3NO2(g)在(2)某温度下,在2L恒容密闭容器中通入等物质的量的NO和O3,只发生反应3NO(g)+O3(g)
 3NO2(g)。
3NO2(g)。①下列能说明该反应达到平衡状态的是
a.混合气体颜色不再改变 b.混合气体密度不再改变
c.体系中NO与O3的物质的量相同 d.容器内压强不再改变
②t1时刻反应达到平衡,t2时刻改变外界条件,t3时重新达到平衡,NO转化率随时间变化如图所示,则t2时刻改变的条件可能是

A.升高温度 B.通入稀有气体
C.向体系中再通入一定量的O3 D.加入催化剂
(3)在一定温度下,向2L恒容密闭容器中充入2molSO2(g)和2molO3(g),发生反应SO2(g)+O3(g)
 SO3(g)+O2(g),初始压强为p0,5min时,测得容器中O3和SO3体积分数相同。
SO3(g)+O2(g),初始压强为p0,5min时,测得容器中O3和SO3体积分数相同。①0~5min内,SO2的平均反应速率v(SO2)=
②达到平衡时,O3的体积分数为30%,则平衡分压常数Kp=
处理方法二:烟气中的NO、SO2可通过电解法除去并获得氨水和硫酸,其原理如图所示。

(4)该电解池阳极的电极反应式为
您最近一年使用:0次
2023-04-13更新
|
255次组卷
|
3卷引用:贵州省遵义市部分高中2022-2023学年高二下学期期中联考化学试题
解题方法
5 . 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_______ ,直到因加入一滴盐酸后,溶液由黄色变为橙色,并_______ 为止。盐酸装入_______ (填a,b);NaOH溶液装入_______ (填a,b)
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_______(填字母)。
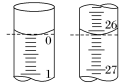
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_______ mL,终点读数为_______ mL,所用盐酸的体积为_______ mL。
(4)某学生根据3次实验分别记录有关数据如下表:
依据上表数据可求出NaOH溶液的物质的量浓度_______ (保留四位有效数字)。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_______(填字母)。
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |


(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
您最近一年使用:0次
解题方法
6 . 用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品,所用主要仪器除药匙外还需_________ 、_________ 。
(2)将样品配成250mL待测液,需要的仪器有烧杯、_________ 、_________ 、_________ 。
(3)取10.00mL待测液,用_________ 量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时_________ 手旋转_________ 式滴定管的玻璃活塞,_________ 手不停地摇动锥形瓶,两眼注视_________ ,直到滴定终点。
(5)根据下列数据
计算待测烧碱的浓度:_________ 。
(6)在滴定操作中,导致实验结果偏低的是_________ 。
①酸式滴定管用蒸馏水洗净后没有用标准液润洗
②指示剂变色时立即停止滴定
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
(1)准确称取4.1g烧碱样品,所用主要仪器除药匙外还需
(2)将样品配成250mL待测液,需要的仪器有烧杯、
(3)取10.00mL待测液,用
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时
(5)根据下列数据
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
(6)在滴定操作中,导致实验结果偏低的是
①酸式滴定管用蒸馏水洗净后没有用标准液润洗
②指示剂变色时立即停止滴定
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
您最近一年使用:0次
解题方法
7 . 合成氨反应在工业生产中的大量运用,满足了人口的急㓮增长对粮食的需求,也为有机合成提供了足够的原料——氨。合成氨反应是一个可逆反应:
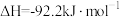 。在298K时,该反应的
。在298K时,该反应的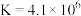 。
。
(1)从平衡常数来看,反应的限度已经很大,为什么还需要使用倠化剂?___________ 。
(2)试分析实际工业生产中合成氨选择400~500℃的原因:_________________ 。
(3)若工业生产中 和
和 按投料比1:2.8的比例进入合成塔,采用此投料比的原因是
按投料比1:2.8的比例进入合成塔,采用此投料比的原因是__________ 。
(4)合成氨的原料气必须经过净化,目的是__________________ 。
(5)298K、 下,在10L密闭容器中充入10mol氮气、30mol氢气和20mol氨气,开始的瞬间,反应向
下,在10L密闭容器中充入10mol氮气、30mol氢气和20mol氨气,开始的瞬间,反应向__________ (填“正反应”或“逆反应”)方向进行,反应进行5min后体系能量的变化为______ (填“吸收”或“放出”)184.4kJ,容器内压强变为原来的_______ 倍。

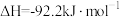 。在298K时,该反应的
。在298K时,该反应的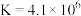 。
。(1)从平衡常数来看,反应的限度已经很大,为什么还需要使用倠化剂?
(2)试分析实际工业生产中合成氨选择400~500℃的原因:
(3)若工业生产中
 和
和 按投料比1:2.8的比例进入合成塔,采用此投料比的原因是
按投料比1:2.8的比例进入合成塔,采用此投料比的原因是(4)合成氨的原料气必须经过净化,目的是
(5)298K、
 下,在10L密闭容器中充入10mol氮气、30mol氢气和20mol氨气,开始的瞬间,反应向
下,在10L密闭容器中充入10mol氮气、30mol氢气和20mol氨气,开始的瞬间,反应向
您最近一年使用:0次
2022-11-27更新
|
222次组卷
|
2卷引用:贵州省“三新”改革联盟校联考2022-2023学年高二上学期期中考试化学试题
解题方法
8 . 下列反应为工业上用 制备
制备 的体系中发生的反应:
的体系中发生的反应:
反应①:
 kJ·mol
kJ·mol
反应②:
 kJ·mol
kJ·mol
反应③:
 kJ·mol
kJ·mol
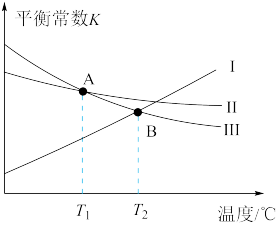
相关反应的平衡常数K与温度的关系如图所示:
回答下列问题:
(1)曲线Ⅰ对应的是反应_________ (填标号,下同),该反应在_________ (填“高温”、“低温”或“任何温度”)下能自发进行。
(2)水煤气法制 的反应为
的反应为
 ,则:
,则:
①
_________ 。
②该反应在M催化剂上的反应历程为:
第一步:
 ,快反应。
,快反应。
第二步:
 ,慢反应。
,慢反应。
下列图像与该反应历程相符的是_________ (填标号)。
A.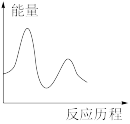 B.
B.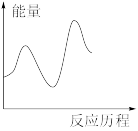 C.
C.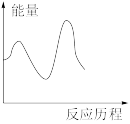 D.
D.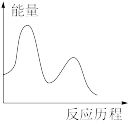
③ ℃时,向2 L恒容密闭容器中充入1 mol
℃时,向2 L恒容密闭容器中充入1 mol  和1 mol
和1 mol  ,5 min后,反应达到平衡,则0~5 min内,
,5 min后,反应达到平衡,则0~5 min内,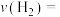
_________ ;该温度下该反应的平衡常数
_________ 。
(3) ℃时,向某恒容密闭容器中加入1 mol
℃时,向某恒容密闭容器中加入1 mol  和1 mol
和1 mol  ,同时发生反应①和③,测得起始压强为p,达到平衡后,测得压强为起始压强的1.4倍,已知该条件下
,同时发生反应①和③,测得起始压强为p,达到平衡后,测得压强为起始压强的1.4倍,已知该条件下 转化为
转化为 的选择性[
的选择性[ 的选择性
的选择性 为20%,则
为20%,则 的转化率为
的转化率为_________ ;平衡时,CO的分压为_________ (用含p的代数式表示)。
 制备
制备 的体系中发生的反应:
的体系中发生的反应:反应①:

 kJ·mol
kJ·mol
反应②:

 kJ·mol
kJ·mol
反应③:

 kJ·mol
kJ·mol
相关反应的平衡常数K与温度的关系如图所示:

回答下列问题:
(1)曲线Ⅰ对应的是反应
(2)水煤气法制
 的反应为
的反应为
 ,则:
,则:①

②该反应在M催化剂上的反应历程为:
第一步:

 ,快反应。
,快反应。第二步:

 ,慢反应。
,慢反应。下列图像与该反应历程相符的是
A.
 B.
B. C.
C. D.
D.
③
 ℃时,向2 L恒容密闭容器中充入1 mol
℃时,向2 L恒容密闭容器中充入1 mol  和1 mol
和1 mol  ,5 min后,反应达到平衡,则0~5 min内,
,5 min后,反应达到平衡,则0~5 min内,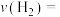

(3)
 ℃时,向某恒容密闭容器中加入1 mol
℃时,向某恒容密闭容器中加入1 mol  和1 mol
和1 mol  ,同时发生反应①和③,测得起始压强为p,达到平衡后,测得压强为起始压强的1.4倍,已知该条件下
,同时发生反应①和③,测得起始压强为p,达到平衡后,测得压强为起始压强的1.4倍,已知该条件下 转化为
转化为 的选择性[
的选择性[ 的选择性
的选择性 为20%,则
为20%,则 的转化率为
的转化率为
您最近一年使用:0次
2022-11-11更新
|
133次组卷
|
3卷引用:贵州省遵义市2022-2023学年高二上学期期中考试化学试题
解题方法
9 . 当今,世界各国相继规划了碳达峰、碳中和的时间节点。因此,研发 利用技术、降低空气中
利用技术、降低空气中 含量成为了研究热点。为减少
含量成为了研究热点。为减少 对环境造成的影响,可采用以下方法将其资源化利用。
对环境造成的影响,可采用以下方法将其资源化利用。
(1) 催化加氢制甲醇
催化加氢制甲醇
一定温度下,在某恒容密闭容器中充入一定量的 和
和 ,发生反应:
,发生反应: 。下列叙述能说明该反应已达到平衡状态的是_______(填标号)。
。下列叙述能说明该反应已达到平衡状态的是_______(填标号)。
(2) 催化加氢合成乙烯
催化加氢合成乙烯
在 某恒容密闭容器中,充入
某恒容密闭容器中,充入 和
和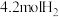 ,发生反应:
,发生反应: 。反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
。反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。

①该反应的
_______ (填“>”或“<”)0,曲线Ⅰ和曲线Ⅱ分别表示_______ (填化学式,下同)和_______ 的变化曲线。
②根据图中a点,计算该温度下平衡时的
_______  ,
,
_______  ,
, 的平衡转化率为
的平衡转化率为_______  (保留三位有效数字)。
(保留三位有效数字)。
③若平衡时a点容器内气体的总压强为 ,则该反应的平衡常数
,则该反应的平衡常数
_______  (列出计算式,用分压表示,分压
(列出计算式,用分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。
(3) 用途广泛,写出其基于物理性质的一种用途:
用途广泛,写出其基于物理性质的一种用途:_______ 。
 利用技术、降低空气中
利用技术、降低空气中 含量成为了研究热点。为减少
含量成为了研究热点。为减少 对环境造成的影响,可采用以下方法将其资源化利用。
对环境造成的影响,可采用以下方法将其资源化利用。(1)
 催化加氢制甲醇
催化加氢制甲醇一定温度下,在某恒容密闭容器中充入一定量的
 和
和 ,发生反应:
,发生反应: 。下列叙述能说明该反应已达到平衡状态的是_______(填标号)。
。下列叙述能说明该反应已达到平衡状态的是_______(填标号)。| A.混合气体的密度不再随时间变化而改变 |
| B.气体的压强不再随时间变化而改变 |
C. 的物质的量分数不再随时间变化而改变 的物质的量分数不再随时间变化而改变 |
D.单位时间内每形成 键,同时断裂 键,同时断裂 键 键 |
 催化加氢合成乙烯
催化加氢合成乙烯在
 某恒容密闭容器中,充入
某恒容密闭容器中,充入 和
和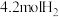 ,发生反应:
,发生反应: 。反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
。反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
①该反应的

②根据图中a点,计算该温度下平衡时的

 ,
,
 ,
, 的平衡转化率为
的平衡转化率为 (保留三位有效数字)。
(保留三位有效数字)。③若平衡时a点容器内气体的总压强为
 ,则该反应的平衡常数
,则该反应的平衡常数
 (列出计算式,用分压表示,分压
(列出计算式,用分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。(3)
 用途广泛,写出其基于物理性质的一种用途:
用途广泛,写出其基于物理性质的一种用途:
您最近一年使用:0次
2021-10-21更新
|
119次组卷
|
3卷引用:贵州省遵义市2021-2022学年高二上学期期中质量检测化学试题
解题方法
10 . 某化学兴趣小组设计实验探究钠分别与乙醇、乙酸反应的反应速率。已学知识:
①羟基与羧基中氢的活性:羟基 羧基。
羧基。
②
(1)依据所学知识预测:反应速率更快的是钠与___________ (填“乙醇”或“乙酸”)的反应。
实验1:将 无水乙酸和
无水乙酸和 无水乙醇分别加入两个相同的烧杯中,取两块形状大小几乎一样的金属钠(都约为
无水乙醇分别加入两个相同的烧杯中,取两块形状大小几乎一样的金属钠(都约为 ),分别同时投入上述两个烧杯中,观察反应现象并记录金属钠完全溶解所需要的时间。(实验在常温下完成,下同)
),分别同时投入上述两个烧杯中,观察反应现象并记录金属钠完全溶解所需要的时间。(实验在常温下完成,下同)
(2)请完成下表:
(3)依据实验现象,有同学指出实验1设计存在缺陷,该缺陷是___________ ;改进的措施是___________ 。
【实验结论】钠与无水乙醇反应的反应速率比钠与无水乙酸反应的反应速率快得多。
(4)【查阅资料】探究钠与水反应的反应速率的影响因素:
①金属失电子的过程:
②金属离子离开的过程:
③活性氢得电子的过程:
④ 分子离开的过程:
分子离开的过程:
猜想原因:对照钠与水反应的反应速率的影响因素,钠与无水乙醇或无水乙酸反应的反应速率主要是由第②个因素决定的,即由生成的乙酸钠(或乙醇钠)在无水乙酸(或无水乙醇)中的________ 决定。
(5)设计实验验证猜想:将 无水乙酸和
无水乙酸和 无水乙醇分别加入两个相同的烧杯中,
无水乙醇分别加入两个相同的烧杯中,___________ 。
①羟基与羧基中氢的活性:羟基
 羧基。
羧基。②
| 物质 | 钠 | 乙醇 | 冰醋酸 |
密度/( ) ) | 0.968 | 0.789 | 1.05 |
实验1:将
 无水乙酸和
无水乙酸和 无水乙醇分别加入两个相同的烧杯中,取两块形状大小几乎一样的金属钠(都约为
无水乙醇分别加入两个相同的烧杯中,取两块形状大小几乎一样的金属钠(都约为 ),分别同时投入上述两个烧杯中,观察反应现象并记录金属钠完全溶解所需要的时间。(实验在常温下完成,下同)
),分别同时投入上述两个烧杯中,观察反应现象并记录金属钠完全溶解所需要的时间。(实验在常温下完成,下同)(2)请完成下表:
| 反应物 | 实验现象 | 钠完全溶解所需时间 |
| 钠与无水乙酸 | 钠 |  |
| 钠与无水乙醇 | 钠 |  |
【实验结论】钠与无水乙醇反应的反应速率比钠与无水乙酸反应的反应速率快得多。
(4)【查阅资料】探究钠与水反应的反应速率的影响因素:
①金属失电子的过程:

②金属离子离开的过程:

③活性氢得电子的过程:

④
 分子离开的过程:
分子离开的过程:
猜想原因:对照钠与水反应的反应速率的影响因素,钠与无水乙醇或无水乙酸反应的反应速率主要是由第②个因素决定的,即由生成的乙酸钠(或乙醇钠)在无水乙酸(或无水乙醇)中的
(5)设计实验验证猜想:将
 无水乙酸和
无水乙酸和 无水乙醇分别加入两个相同的烧杯中,
无水乙醇分别加入两个相同的烧杯中,
您最近一年使用:0次
2021-10-20更新
|
605次组卷
|
5卷引用:贵州省遵义市2021-2022学年高二上学期期中质量检测化学试题
贵州省遵义市2021-2022学年高二上学期期中质量检测化学试题河南省创新发展联盟2021-2022学年高二上学期第二次联考化学试题辽宁省葫芦岛市协作校2021-2022学年高二上学期第一次考试化学试题(已下线)第九单元 有机化学基础(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)专题06 有机化学基础之十大有机课本实验-【微专题·大素养】备战2022年高考化学核心突破(选考模块)



