名校
1 . 草酸(H2C2O4)是一种常见二元弱酸,易溶于水,常用来做还原剂、沉淀剂、媒染剂、络合剂等。某化学学习兴趣小组欲制备草酸并探究其某些化学性质,经查找资料:乙炔在45-55℃硝酸汞作催化剂的条件下,经浓硝酸氧化可制得草酸。
[草酸的制备]
甲同学以电石(主要成分CaC2)、浓硝酸及少量硝酸汞为原料,利用如图装置制备草酸。

(1)仪器a的名称_______
(2)实验室制乙炔时用饱和食盐水代替水的目的是。_______ 。反应时C中产生大量红棕色气体,请写出C中发生化学反应方程式_______ 。
[产品中草酸晶体(H2C2O4·2H2O)质量分数的测定]
乙同学准确称取ag产品,配成100mL水溶液,取20mL所配制的溶液置于锥形瓶内,用cmol·L-1酸性KMnO4标准溶液滴定至终点,平行实验三次,平均消耗标准溶液vmL。试回答:
(3)上述滴定实验中发生的离子反应方程式_______ ,判断到达滴定终点的现象是_______ 。
(4)产品中草酸晶体(H2C2O4·2H2O)的质量分数为_______ (用a、v表示)
[草酸的性质]
(5)上述酸性高锰酸钾与草酸反应,体现了草酸_______ (填酸性、氧化性或还原性)
(6)室温下已知:Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=1.5×104,通过下列实验探究草酸的性质。[1g2=0.3,lg3=0.5]。向10mL0.1mol/LH2C2O4溶液中逐滴加入VmL0.1mol/LNaOH溶液,当V从0逐渐增大至20时,测得混合溶液的pH逐渐增大,下列说法正确的是_______(填字母)
[草酸的制备]
甲同学以电石(主要成分CaC2)、浓硝酸及少量硝酸汞为原料,利用如图装置制备草酸。

(1)仪器a的名称
(2)实验室制乙炔时用饱和食盐水代替水的目的是。
[产品中草酸晶体(H2C2O4·2H2O)质量分数的测定]
乙同学准确称取ag产品,配成100mL水溶液,取20mL所配制的溶液置于锥形瓶内,用cmol·L-1酸性KMnO4标准溶液滴定至终点,平行实验三次,平均消耗标准溶液vmL。试回答:
(3)上述滴定实验中发生的离子反应方程式
(4)产品中草酸晶体(H2C2O4·2H2O)的质量分数为
[草酸的性质]
(5)上述酸性高锰酸钾与草酸反应,体现了草酸
(6)室温下已知:Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=1.5×104,通过下列实验探究草酸的性质。[1g2=0.3,lg3=0.5]。向10mL0.1mol/LH2C2O4溶液中逐滴加入VmL0.1mol/LNaOH溶液,当V从0逐渐增大至20时,测得混合溶液的pH逐渐增大,下列说法正确的是_______(填字母)
A.当V=10时,溶液中离子浓度关系:c(Na+)>c(HC2O )>c(C2O )>c(C2O )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
B.当溶液中c(C2O )=c(HC2O )=c(HC2O )时,混合溶液的pH约为3.8 )时,混合溶液的pH约为3.8 |
C.当溶液中c(C2O )+c(HC2O )+c(HC2O )=c(Na+)时,混合溶液的pH=7 )=c(Na+)时,混合溶液的pH=7 |
D.当溶液中c(Na+)=2c(C2O )+2c(HC2O )+2c(HC2O )+2c(H2C2O4)时,混合溶液的pH>7 )+2c(H2C2O4)时,混合溶液的pH>7 |
您最近一年使用:0次
2022-04-17更新
|
459次组卷
|
4卷引用:辽宁省葫芦岛市第一高级中学2022-2023学年高三上学期期末线上教学阶段检测化学试题
辽宁省葫芦岛市第一高级中学2022-2023学年高三上学期期末线上教学阶段检测化学试题(已下线)化学(辽宁A卷)-学易金卷:2023年高考第一次模拟考试卷江西省上饶市六校2022届高三第二次联考理科综合化学试题湖南省邵阳市第一中学2023届高三第五次月考化学试题
2 . 高铁酸钾(K2FeO4)是新型高效净水剂,某实验小组制备K2FeO4并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4 (夹持装置略)

①A为氯气发生装置。A中反应的离子方程式为_______ 。
②请在B方框内将除杂装置补充完整,并标明所用试剂_______ 。
③C中得到紫色固体和溶液。C中主要反应的化学方程式为_______ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
由方案Ⅰ中溶液变红可知a中含有的离子为_______ ,但该离子的产生不能判断一定是由Cl-还原K2FeO4得到的,该离子还可能由_______ 产生(用离子方程式表示)。
②根据K2FeO4的制备实验得出:氧化性Cl2_______  (填“>”或“<”),由方案Ⅱ实验表明,Cl2和
(填“>”或“<”),由方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4 (夹持装置略)

①A为氯气发生装置。A中反应的离子方程式为
②请在B方框内将除杂装置补充完整,并标明所用试剂
③C中得到紫色固体和溶液。C中主要反应的化学方程式为
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),由方案Ⅱ实验表明,Cl2和
(填“>”或“<”),由方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
名校
解题方法
3 . 下列说法正确的有
①在周期表中,同周期第ⅡA族和第ⅢA族元素质子数相差可能是1、11或25
②同主族元素从上至下,单质的氧化性逐渐减弱,熔点逐渐降低
③碱性:LiOH>NaOH>KOH>RbOH
④酸性:H2SO4>HClO4>HBrO4>HIO4
⑤卤族元素由上至下,阴离子的还原性增强,单质的颜色加深
⑥碱金属单质物理通性是硬度小,密度小,熔点低
⑦碱金属元素的原子半径和离子半径都随核电荷数的增大而增大
⑧可以利用非金属单质与H2反应的难易程度来证明其元素非金属性的强弱
①在周期表中,同周期第ⅡA族和第ⅢA族元素质子数相差可能是1、11或25
②同主族元素从上至下,单质的氧化性逐渐减弱,熔点逐渐降低
③碱性:LiOH>NaOH>KOH>RbOH
④酸性:H2SO4>HClO4>HBrO4>HIO4
⑤卤族元素由上至下,阴离子的还原性增强,单质的颜色加深
⑥碱金属单质物理通性是硬度小,密度小,熔点低
⑦碱金属元素的原子半径和离子半径都随核电荷数的增大而增大
⑧可以利用非金属单质与H2反应的难易程度来证明其元素非金属性的强弱
| A.4个 | B.5个 | C.6个 | D.7个 |
您最近一年使用:0次
2021-12-03更新
|
348次组卷
|
2卷引用:辽宁省辽河油田第一高级中学2020-2021学年高一上学期期末考试化学试题(A部)
4 . 【查阅资料】乙二酸俗称草酸,草酸晶体(H2C2O4•2H2O)在100 ℃时开始升华,157 ℃时大量升华并开始分解;草酸蒸气在低温下迅速冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊。
Ⅰ.乙二酸的不稳定性:根据草酸晶体的组成,猜想其受热分解产物为CO、CO2和H2O。
(1)请用下列装置组成一套探究并验证其产物的实验装置。请回答下列问题:
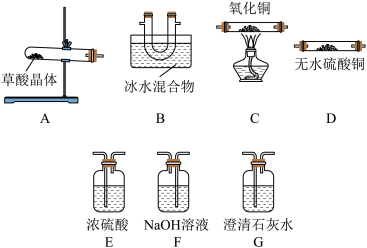
①装置的连接顺序为:A→D→B→G→______→______→C→G______ 。
②装置中冰水混合物的作用是______ 。
③整套装置存在不合理之处______ 。
Ⅱ.乙二酸的弱酸性:
(2)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的的是______ 。
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定0.1 mol•L-1草酸溶液的pH
C.将草酸溶液加入Na2CO3溶液中,有CO2放出
Ⅲ.乙二酸的还原性:
(3)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。该反应的离子方程式为:2MnO +H2C2O4+6H+=2Mn2++10CO2↑+8H2O。
+H2C2O4+6H+=2Mn2++10CO2↑+8H2O。
利用该性质测草酸浓度,取草酸(H2C2O4)溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1 mol•L-1的高锰酸钾溶液滴定,表格中记录了实验数据:
①滴定时,KMnO4溶液应装在______ 式滴定管中,滴定终点时的现象是______ 。
②该草酸溶液的浓度为______ 。
③下列操作会引起测定结果偏高的是_____ 。
A.滴定管在盛装KMnO4溶液前未润洗
B.滴定过程中,锥形瓶振荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.装待测液的锥形瓶用蒸馏水洗涤后,没用待测液润洗
Ⅰ.乙二酸的不稳定性:根据草酸晶体的组成,猜想其受热分解产物为CO、CO2和H2O。
(1)请用下列装置组成一套探究并验证其产物的实验装置。请回答下列问题:

①装置的连接顺序为:A→D→B→G→______→______→C→G
②装置中冰水混合物的作用是
③整套装置存在不合理之处
Ⅱ.乙二酸的弱酸性:
(2)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的的是
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定0.1 mol•L-1草酸溶液的pH
C.将草酸溶液加入Na2CO3溶液中,有CO2放出
Ⅲ.乙二酸的还原性:
(3)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。该反应的离子方程式为:2MnO
 +H2C2O4+6H+=2Mn2++10CO2↑+8H2O。
+H2C2O4+6H+=2Mn2++10CO2↑+8H2O。利用该性质测草酸浓度,取草酸(H2C2O4)溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1 mol•L-1的高锰酸钾溶液滴定,表格中记录了实验数据:
| 滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 1.00 | 22.50 |
| 第四次 | 25.00 | 4.00 | 24.10 |
②该草酸溶液的浓度为
③下列操作会引起测定结果偏高的是
A.滴定管在盛装KMnO4溶液前未润洗
B.滴定过程中,锥形瓶振荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.装待测液的锥形瓶用蒸馏水洗涤后,没用待测液润洗
您最近一年使用:0次
2023-02-09更新
|
224次组卷
|
2卷引用:辽宁省营口市大石桥市第三高级中学等2校2022-2023学年高二上学期期末考试化学试题
13-14高一下·辽宁抚顺·期末
名校
5 . 下列关于元素周期表和元素周期律的说法不正确的是( )
| A.从氟到碘,单质的氧化性逐渐减弱,氢化物的还原性逐渐增强 |
| B.等物质的量的钠原子比铝原子失去的电子数少,所以钠比铝的还原性弱 |
| C.从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 |
| D.氧与硫为同主族元素,氧比硫的原子半径小,氧气比硫的氧化性强 |
您最近一年使用:0次
11-12高二·辽宁·期末
名校
6 . 维生素C 又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+ 转变为易吸收的Fe2+ ,这说明维生素C具有
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
您最近一年使用:0次
2016-12-09更新
|
383次组卷
|
7卷引用:2012年辽宁省普通高中学业水平考试前测题化学试卷
名校
解题方法
7 . 化学实验是研究物质组成和探究物质性质的重要途径。
Ⅰ.某澄清透明溶液(忽略水的电离),可能含有Fe3+、Mg2+、K+、CO 、SO
、SO 、Ba2+、MnO
、Ba2+、MnO 等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示。请你根据上述实验推断:
等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示。请你根据上述实验推断:
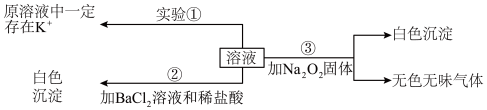
(1)实验①的焰色试验,需要透过_______ ,来观察火焰的颜色。
(2)取100mL溶液进行实验②,经足量盐酸洗涤、干燥后,得沉淀质量为2.33g。该溶液中K+的物质的量浓度为________ 。
(3)实验③产生的无色无味气体为________ ,白色沉淀为_______ (填物质化学式)。原溶液中一定存在的离子有_______ 。
(4)向该溶液中加入硫酸酸化,再通入SO2气体,发生反应使该溶液的颜色发生变化,写出该反应的离子方程式_______ 。
Ⅱ.Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测,Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。其中装置A用锌和稀盐酸制取氢气。
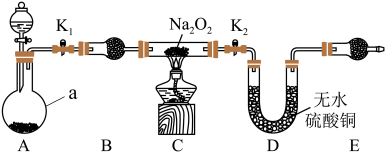
(5)装置B中的试剂是________ 。
(6)下面是实验过程中的重要操作,正确的顺序是_______。
(7)实验过程中观察到淡黄色粉末慢慢变成白色固体,无水硫酸铜未变蓝色。由此可推测出Na2O2与H2反应生成的产物为_______ 。
Ⅰ.某澄清透明溶液(忽略水的电离),可能含有Fe3+、Mg2+、K+、CO
 、SO
、SO 、Ba2+、MnO
、Ba2+、MnO 等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示。请你根据上述实验推断:
等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示。请你根据上述实验推断:
(1)实验①的焰色试验,需要透过
(2)取100mL溶液进行实验②,经足量盐酸洗涤、干燥后,得沉淀质量为2.33g。该溶液中K+的物质的量浓度为
(3)实验③产生的无色无味气体为
(4)向该溶液中加入硫酸酸化,再通入SO2气体,发生反应使该溶液的颜色发生变化,写出该反应的离子方程式
Ⅱ.Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测,Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。其中装置A用锌和稀盐酸制取氢气。

(5)装置B中的试剂是
(6)下面是实验过程中的重要操作,正确的顺序是_______。
| A.加热至Na2O2逐渐熔化,反应一段时间 | B.用小试管收集气体并检验其纯度 |
| C.打开K1、K2,通入氢气 | D.停止加热,充分冷却,关闭K1、K2 |
(7)实验过程中观察到淡黄色粉末慢慢变成白色固体,无水硫酸铜未变蓝色。由此可推测出Na2O2与H2反应生成的产物为
您最近一年使用:0次
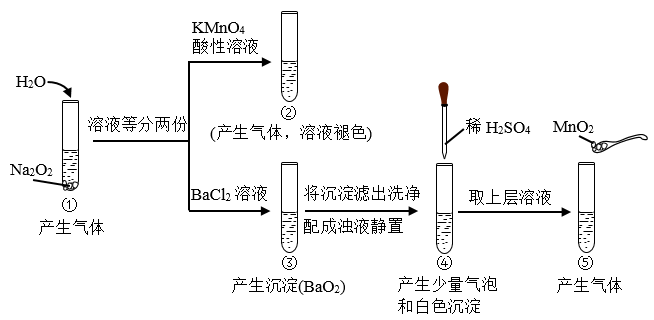
8 . 有资料表明,Na2O2与水反应的原理为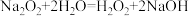 、
、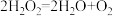 。如图实验验证该原理(已知:
。如图实验验证该原理(已知: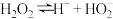 、
、 )。下列分析不正确的是
)。下列分析不正确的是
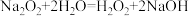 、
、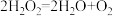 。如图实验验证该原理(已知:
。如图实验验证该原理(已知: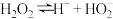 、
、 )。下列分析不正确的是
)。下列分析不正确的是
| A.①④中均发生了复分解反应和氧化还原反应 |
| B.①⑤中产生等物质的量气体转移电子数相等 |
| C.通过②⑤可比较氧化性KMnO4>H2O2、MnO2>H2O2 |
| D.③反应不能比较酸性:HCl>H2O2 |
您最近一年使用:0次
9 . 海洋是生命的摇篮,蕴藏着丰富的化学资源。回答下列问题:
(1)目前海水淡化的主要方法有_______ (填一种)。
(2)从氯碱工业的副产品中能够得到一种含氯消毒剂,有效成分为 ,该消毒剂起作用的原理是利用了
,该消毒剂起作用的原理是利用了 的
的_______ (填“强氧化性”或“强还原性”)。
(3)海水提镁工艺流程如图所示: 的名称为
的名称为_______ 。
②用电解法制备金属镁,两位同学分别设计了下面的两种方法。
甲:电解氯化镁溶液。
乙:电解熔融的氯化镁。
其中_______ (填“甲”或“乙”)同学能够成功地制备金属镁,假设生产过程中镁元素没有损失,则制备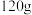 镁所需生石灰的质量至少为
镁所需生石灰的质量至少为_______  。
。
(4)海水提溴工艺流程如图所示: 被
被 氧化的离子方程式是
氧化的离子方程式是_______ 。
②写出吸收塔中 将
将 转化为
转化为 的化学方程式:
的化学方程式:_______ 。
③工业上也可用 溶液吸收吹出的
溶液吸收吹出的 。配平以下化学方程式:
。配平以下化学方程式:
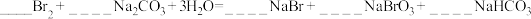
_____
(1)目前海水淡化的主要方法有
(2)从氯碱工业的副产品中能够得到一种含氯消毒剂,有效成分为
 ,该消毒剂起作用的原理是利用了
,该消毒剂起作用的原理是利用了 的
的(3)海水提镁工艺流程如图所示:
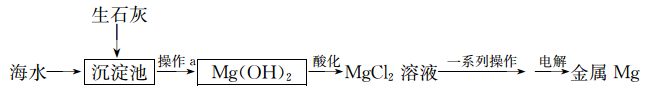
 的名称为
的名称为②用电解法制备金属镁,两位同学分别设计了下面的两种方法。
甲:电解氯化镁溶液。
乙:电解熔融的氯化镁。
其中
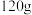 镁所需生石灰的质量至少为
镁所需生石灰的质量至少为 。
。(4)海水提溴工艺流程如图所示:

 被
被 氧化的离子方程式是
氧化的离子方程式是②写出吸收塔中
 将
将 转化为
转化为 的化学方程式:
的化学方程式:③工业上也可用
 溶液吸收吹出的
溶液吸收吹出的 。配平以下化学方程式:
。配平以下化学方程式: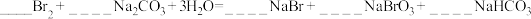
您最近一年使用:0次
2021-07-12更新
|
314次组卷
|
5卷引用:辽宁省朝阳市建平县2021-2022学年高一下学期期末考试化学试题
名校
解题方法
10 . 部分氯及其化合物的“价—类”二维图如图所示。下列叙述正确的是
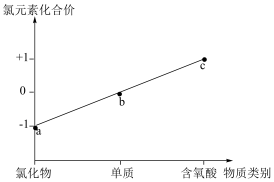
| A.a只有还原性,没有氧化性 | B.b与 反应生成a和c 反应生成a和c |
| C.c有漂白性、酸性和强稳定性 | D.c见光易分解,释放出b |
您最近一年使用:0次
2024-03-02更新
|
112次组卷
|
4卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高一上学期2月期末化学试题
辽宁省朝阳市建平县实验中学2023-2024学年高一上学期2月期末化学试题(已下线)综合突破01 期末压轴80题之选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)海南省海口市海南中学2023-2024学年高一下学期开学化学试题河南省郑州市宇华实验学校2023-2024学年高一下学期3月月考化学试题



