1 . 某兴趣小组同学为探究黑木耳中含铁量,进行如下实验。
已知:ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等。每100 g黑木耳含铁量高达185 mg。
ⅱ.紫红色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。
Ⅰ.为确定黑木耳中含有铁元素,甲同学设计实验方案如下。
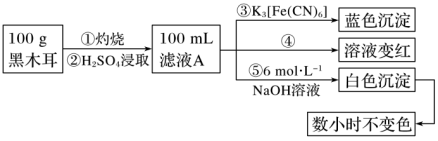
(1)步骤②得到滤液A的操作是___________ 。
(2)步骤④检验Fe3+所用试剂是___________ 溶液。
(3)根据上述实验得出的结论是___________ (填字母)。
a.黑木耳中一定含Fe2+和Fe3+
b.滤液A中一定含Fe2+和Fe3+
c.白色沉淀中一定含Fe(OH)2
Ⅱ.为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
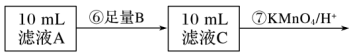
(4)可选做试剂B的物质是___________ (填字母)。
a.Na b.Zn c.Fe d.Cu
(5)步骤⑦中观察到的实验现象是___________ ,反应的离子方程式是___________ 。
(6)若乙同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是___________ 。
已知:ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等。每100 g黑木耳含铁量高达185 mg。
ⅱ.紫红色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。
Ⅰ.为确定黑木耳中含有铁元素,甲同学设计实验方案如下。

(1)步骤②得到滤液A的操作是
(2)步骤④检验Fe3+所用试剂是
(3)根据上述实验得出的结论是
a.黑木耳中一定含Fe2+和Fe3+
b.滤液A中一定含Fe2+和Fe3+
c.白色沉淀中一定含Fe(OH)2
Ⅱ.为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。

(4)可选做试剂B的物质是
a.Na b.Zn c.Fe d.Cu
(5)步骤⑦中观察到的实验现象是
(6)若乙同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是
您最近一年使用:0次
2022-03-31更新
|
198次组卷
|
5卷引用:浙江省宁波市效实中学2023-2024学年高一上学期期末化学模拟卷
2010·全国·一模
名校
解题方法
2 . 人体血红蛋白中含有Fe2+,如果误食亚硝酸盐会使人中毒,因为亚硝酸盐会使Fe2+变Fe3+,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐中毒。说明维生素C具有
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
您最近一年使用:0次
2020-11-09更新
|
1006次组卷
|
70卷引用:2012-2013学年浙江省杭州十四中高一上学期期末考试化学试卷
(已下线)2012-2013学年浙江省杭州十四中高一上学期期末考试化学试卷(已下线)2010—2011学年云南省元阳一中高一上学期期末考试化学试卷(已下线)2011-2012学年上海理工大学附属中学高一上学期期末考试化学试卷(已下线)2011-2012学年广东省汕头金山中学高一第一学期期末考试化学(文)试卷(已下线)2011-2012学年浙江省余姚中学高一下学期期中考试文科化学试卷(已下线)2012-2013学年上海市上海理工大学附属中学高一上期末考试化学试卷(已下线)2012-2013学年浙江省杭州地区七校高一下学期期中联考文科化学试卷2014-2015山西省原平市一中高一上学期期末考试化学试卷2015-2016学年宁夏吴忠中学高一上学期期末考试化学试卷2015-2016学年湖南省常德一中高一上学期期末化学试卷陕西省西安市长安区第一中学2017-2018学年高二上学期期末考试化学(文)试题广东省惠州市2017-2018学年高一上学期期末教学质量检测化学试题湖南省师范大学附属中学2017-2018学年高二上学期期末考试化学(文)试题云南省昆明市黄冈实验学校2017-2018学年高二上学期期末考试化学(理)试题安徽省芜湖市2019-2020学年高二上学期期末考试化学(文)试题(已下线)【浙江新东方】7吉林省大安市第六中学2019-2020学年高二下学期期末考试化学(理)试题山西省大同市2021-2022学年高一上学期期末调研化学试题北京清华大学附属中学2022-2023学年高一上学期期末考试化学试卷(已下线)高考第一轮复习化学反应与能量变化单元测试(已下线)2011-2012学年福建省泉州一中高一下学期期中考试化学试卷(已下线)2012-2013学年河北省邢台一中高一上学期第三次月考化学试卷(已下线)2013-2014学年山东省临沂市重点中学高一上学期期中考试化学试卷2015-2016学年吉林省吉林五十五中高二上学期期中(文)化学试卷2015-2016学年广东广州执信中学高二上期中文化学试卷2015-2016学年福建省莆田二十五中高一下学期第一次月考化学试卷2015-2016学年山西晋城市高平市特立高级中学高二下期中理科化学卷2016-2017学年广东佛山一中高一上第一次段考化学卷2016-2017学年遵义市第四中学高二上学期期中考试化学(文)试卷2016-2017学年广东省广州执信中学高二上期中化学卷2016-2017学年广东省汕头市金山中学高二上学业水平测试化学卷甘肃省武威市河西成功学校2017-2018学年高一上学期期中考试化学试题山东省临沂市蒙阴县实验中学2017-2018学年高一上学期期中考试化学试题山东省桓台第二中学2017-2018学年高一12月月考化学试题云南民族大学附属中学2017-2018学年高一下学期期中考试化学试题2018-2019学年鲁科版必修1第2章元素与物质世界本章测试题广东省普通高中2018-2019学年高二学业水平测试预测试题福建省晋江市季延中学2018-2019学年高二(文)上学期期中考试化学试题山西省祁县第二中学校2018-2019学年高二下学期5月考试化学试题江苏省苏州陆慕高级中学2018-2019学年高一下学期5月月考化学试题江苏省苏州市第五中学2018-2019学年高二上学期期中考试(必修)化学试题甘肃省嘉峪关市一中2017-2018学年高一上学期期中考试化学试题云南省云天化中学2019-2020学年高一9月月考化学试题黑龙江省哈尔滨市第三中学2019-2020学年高二上学期期中考试化学(文)试题黑龙江省哈尔滨市阿城区龙涤中学2019-2020学年高一上学期第一次段考化学试题上海市嘉定区封浜高中2019-2020学年高二上学期期中考试化学试题湖南省常德市2018-2019学年高二下学期第一次月考化学试题江西省抚州市南城县第二中学2019-2020学年高一上学期第二次月考化学试题江苏省海头高级中学2019-2020学年高一上学期第三次月考化学试题福建省晋江市养正中学2019-2020学年高二上学期第二次月考化学试题山西省运城市盐湖五中2019-2020学年高一上学期期中考试化学试题安徽省六安市第一中学2019-2020学年高一下学期疫情防控延期开学期间辅导测试(三)化学试题辽宁省东北育才学校科学高中部2020-2021学年高一上学期第一学段检测化学试题广东省佛山市第一中学2020-2021学年高一上学期第一次段考化学试题江苏省常州市2020-2021学年高一上学期期中考试化学试题江西省九江市浔阳区九江市第七中学2020-2021学年高一上学期期中考试化学试题上海市奉城高级中学2018-20219学年高二上学期期中考试化学试题河北省石家庄市第二中学西校区2020-2021学年高一上学期12月月考化学试卷河南省南阳市第四中学2020-2021学年高一上学期第二次月考化学试题河南省南阳市油田第一中学2020-2021学年高二上学期期中考试化学试题福建省莆田第一中学2021-2022学年高一上学期期中考试化学试题上海理工大学附属中学中2021-2022学年高一下学期期中考试化学试题江苏省常州市金坛区2021-2022学年高一上学期期中教学质量调研化学试题广东省华南师范大学附属中学2020-2021学年高一上学期期中考试化学试题辽宁省锦州市黑山县黑山中学2021-2022学年高一上学期12月月考化学试题海南省临高县新盈中学2021-2022学年高二上学期(5-8班)期中考试化学试题湖南省株洲市炎陵县第一中学等2校2022-2023学年高一下学期3月月考化学试题甘肃省武威市天祝藏族自治县第一中学2022-2023学年高一下学期开学考试化学试题广东省汕头市潮阳第一中学2023-2024学年高一上学期12月月考化学试题北京市顺义区杨镇第一中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
3 . 高铁酸盐是优良的多功能水处理剂。某实验小组采用如图装置制备高铁酸钾(K2FeO4)并探究其性质用途。
资料:K2FeO4为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性,在酸性或中性溶液中紫色快速褪去并产生O2,在碱性溶液中较稳定。
制备K2FeO4(夹持、加热等装置略)

(1)B中所用试剂为_____
(2)C中反应为放热反应,而反应温度须控制在0~8℃,可使用的控温方法为_____ ,充分反应后得到紫色固体,化学方程式为_____ 。
(3)C中混合物经过滤、洗涤、干燥,得纯净高铁酸钾晶体,洗涤时洗涤剂可选用_____ 。
a.冰水 b.KOH溶液 c.异丙醇
(4)反应中KOH必须过量的原因是_____ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性,在酸性或中性溶液中紫色快速褪去并产生O2,在碱性溶液中较稳定。
制备K2FeO4(夹持、加热等装置略)

(1)B中所用试剂为
(2)C中反应为放热反应,而反应温度须控制在0~8℃,可使用的控温方法为
(3)C中混合物经过滤、洗涤、干燥,得纯净高铁酸钾晶体,洗涤时洗涤剂可选用
a.冰水 b.KOH溶液 c.异丙醇
(4)反应中KOH必须过量的原因是
您最近一年使用:0次
2021高一·全国·专题练习
解题方法
4 . 为了探究过氧化钠的强氧化性,某小组设计了如图所示的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢加浓盐酸,A中剧烈反应,有黄绿色气体产生。
③待产生连续气泡后,将装置D中的导管末端伸入集气瓶中,收集到无色气体。
④反应一段时间后,关闭分液漏斗的活塞,再通一段时间N2,直至装置中气体变为无色。
回答下列问题:
(1)装置D中收集的无色气体能使带火星的木条复燃,据此推断该气体是___________ ,解释产生该气体的原因是(用化学方程式表示)___________ 。
(2)装置B中湿润的淀粉碘化钾试纸变蓝。甲同学根据A中气体的颜色推测试纸变蓝时发生的反应可能是(写化学方程式)________________ 。乙同学认为使试纸变蓝的原因也可能是___________ 。
(3)资料显示,Na2O2与干燥的HCl能发生化学反应生成Cl2,该反应的化学方程式为___________ 。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢加浓盐酸,A中剧烈反应,有黄绿色气体产生。
③待产生连续气泡后,将装置D中的导管末端伸入集气瓶中,收集到无色气体。
④反应一段时间后,关闭分液漏斗的活塞,再通一段时间N2,直至装置中气体变为无色。
回答下列问题:
(1)装置D中收集的无色气体能使带火星的木条复燃,据此推断该气体是
(2)装置B中湿润的淀粉碘化钾试纸变蓝。甲同学根据A中气体的颜色推测试纸变蓝时发生的反应可能是(写化学方程式)
(3)资料显示,Na2O2与干燥的HCl能发生化学反应生成Cl2,该反应的化学方程式为
您最近一年使用:0次
解题方法
5 . 在生活中亚硝酸钠(NaNO2)应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长等。某化学兴趣小组查阅资料得知2NO+Na2O2=2NaNO2,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去)。

已知:NO能被酸性高锰酸钾氧化成最高价离子,但不能被浓硫酸氧化。回答下列问题:
(1)盛装稀硝酸的仪器名称为___________ ,仪器按气流方向连接顺序为b→___________ (部分装置可重复使用)。
(2)反应开始前打开止水夹a,通入过量氮气的目的是为了排除装置内的空气,反应结束后打开止水夹a,通入过量氮气的目的是___________ 。
(3)已知:亚硝酸钠在中性或碱性条件中是稳定的,但酸化后能氧化KI,生成I2。若需鉴别亚硝酸钠和食盐,可供选择的物质有:①自来水②淀粉-KI试纸③淀粉④白糖⑤食醋,进行实验时,必须使用的物质有(填序号)___________ 。
(4)写出NO被酸性高锰酸钾溶液吸收的离子方程式___________ 。

已知:NO能被酸性高锰酸钾氧化成最高价离子,但不能被浓硫酸氧化。回答下列问题:
(1)盛装稀硝酸的仪器名称为
(2)反应开始前打开止水夹a,通入过量氮气的目的是为了排除装置内的空气,反应结束后打开止水夹a,通入过量氮气的目的是
(3)已知:亚硝酸钠在中性或碱性条件中是稳定的,但酸化后能氧化KI,生成I2。若需鉴别亚硝酸钠和食盐,可供选择的物质有:①自来水②淀粉-KI试纸③淀粉④白糖⑤食醋,进行实验时,必须使用的物质有(填序号)
(4)写出NO被酸性高锰酸钾溶液吸收的离子方程式
您最近一年使用:0次
解题方法
6 . KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。请回答下列问题:
(1)KIO3的化学名称是___________ 。
(2)KIO3具有一定的氧化性,能与H2S反应生成淡黄色沉淀,请配平该离子反应方程式: +H2S=I-+S↓+H2O,
+H2S=I-+S↓+H2O,___________ 。
(3)炒菜使用加碘盐,最好等出锅时再放盐,理由是___________ (请用化学反应方程式表示)。
(4)KIO3可采用“电解法”制备,某同学查阅资料,设计将NO2、O2和熔融盐组成的燃料电池(装置1)与装置2相连,主要原理如图所示。电解前,在a极区先将一定量的碘溶于过量KOH溶液,发生反应3I2+6KOH=5KI+KIO3+3H2O,电解后在该区获得KIO3。

①装置1,熔融盐中NO 移向
移向___________ (填“石墨I”或“石墨II”);在使用过程中石墨I电极反应生成一种氧化物Y,请写出该氧化物Y的化学式是___________ 。
②请写出装置1中石墨II的电极反应式是___________ 。
③装置2,用惰性电极和不锈钢两种作为电极材料,请写出电极a可采用的材料是___________ (填“石墨”或“不锈钢”或“两者皆可”),该电极上发生的电极反应式是___________ 。
④装置2,电解过程中通过离子交换膜的离子主要是___________ ;电解后,b极区周围的pH会___________ (填“升高”或“降低”)。
(1)KIO3的化学名称是
(2)KIO3具有一定的氧化性,能与H2S反应生成淡黄色沉淀,请配平该离子反应方程式:
 +H2S=I-+S↓+H2O,
+H2S=I-+S↓+H2O,(3)炒菜使用加碘盐,最好等出锅时再放盐,理由是
(4)KIO3可采用“电解法”制备,某同学查阅资料,设计将NO2、O2和熔融盐组成的燃料电池(装置1)与装置2相连,主要原理如图所示。电解前,在a极区先将一定量的碘溶于过量KOH溶液,发生反应3I2+6KOH=5KI+KIO3+3H2O,电解后在该区获得KIO3。

①装置1,熔融盐中NO
 移向
移向②请写出装置1中石墨II的电极反应式是
③装置2,用惰性电极和不锈钢两种作为电极材料,请写出电极a可采用的材料是
④装置2,电解过程中通过离子交换膜的离子主要是
您最近一年使用:0次
7 . 物质的性质决定用途,下列两者对应关系不正确 的是
A. 溶液呈碱性,其热溶液可用于去除厨房油渍 溶液呈碱性,其热溶液可用于去除厨房油渍 |
B. 难溶于水和酸且不能被X射线穿透,可用作人体造影剂 难溶于水和酸且不能被X射线穿透,可用作人体造影剂 |
C. 具有强氧化性,可用作自来水消毒剂 具有强氧化性,可用作自来水消毒剂 |
| D.钠、钾具有很强还原性,钠钾合金可用作核反应堆的传热介质 |
您最近一年使用:0次
19-20高二·浙江·期末
解题方法
8 . 工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:

查阅相关资料得知:
i. 常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-。
ii.
回答下列问题:
(1)固体A的成分是_____________________ 。
(2)③为加入物质来调节溶液的pH,则pH的合适范围是__________________ 。
(3)⑤中酸化是使CrO42-转化为Cr2O72-写出该反应的离子方程式_________________ 。
(4)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为______ ;固体D中含Fe化合物的物质的量为_____________ 。

查阅相关资料得知:
i. 常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-。
ii.
| 物质 | 开始沉淀的pH | 完全沉淀的pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.4 | 4.4 |
| Cr(OH)3 | 4.6 | 5.9 |
| Fe(OH)2 | 7.5 | 9.7 |
| Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)固体A的成分是
(2)③为加入物质来调节溶液的pH,则pH的合适范围是
(3)⑤中酸化是使CrO42-转化为Cr2O72-写出该反应的离子方程式
(4)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为

您最近一年使用:0次
19-20高二·浙江·期末
名校
解题方法
9 . 氧化亚铜是一种附加值较高的铜类物质,下列流程是利用再生资源回收高品质氧化亚铜。某兴趣小组通过查阅资料得知CuCl可溶于 浓度较大的体系,能被硝酸氧化,在碱性条件下易水解转化为Cu2O,Cu2O在酸性条件下可歧化为
浓度较大的体系,能被硝酸氧化,在碱性条件下易水解转化为Cu2O,Cu2O在酸性条件下可歧化为 和Cu。据此设计了如下实验方案。下列说法正确的是
和Cu。据此设计了如下实验方案。下列说法正确的是

 浓度较大的体系,能被硝酸氧化,在碱性条件下易水解转化为Cu2O,Cu2O在酸性条件下可歧化为
浓度较大的体系,能被硝酸氧化,在碱性条件下易水解转化为Cu2O,Cu2O在酸性条件下可歧化为 和Cu。据此设计了如下实验方案。下列说法正确的是
和Cu。据此设计了如下实验方案。下列说法正确的是
A.生成CuCl的离子方程式为 |
B.为确保 完全沉淀,应向含铜废液中加入过量的NaCl 完全沉淀,应向含铜废液中加入过量的NaCl |
| C.检验制得的Cu2O中是否含有CuCl,可用硝酸银和硝酸 |
| D.可直接向含铜废液中加入葡萄糖,在碱性条件下制得Cu2O |
您最近一年使用:0次
2020-02-28更新
|
340次组卷
|
3卷引用:【新东方】 2020-26
名校
10 . 亚硝酸钠既有氧化性也有还原性,易溶于水,水溶液显碱性。由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放,处理方法之一如下:NaNO2 +KI+_____ NO↑+I2+K2SO4+Na2SO4+___________。请回答下列问题:
NO↑+I2+K2SO4+Na2SO4+___________。请回答下列问题:
(1)配平上述化学方程式,请写出其完整方程式___________ 。
(2)鉴于NO是有毒气体,从环保角度来讲,要处理NaNO2,可以选用以下试剂___________
A. FeCl2 B. H2O2 C. KMnO4 D. H2SO4
(3)根据信息,鉴别亚硝酸钠和氯化钠的简单方法是___________ 。
(4)已知亚硝酸钠与氯化铵反应生成氮气、氯化钠和水,写出该反应的化学方程式并用双线桥表示其电子转移的方向和数目:___________ 。
 NO↑+I2+K2SO4+Na2SO4+___________。请回答下列问题:
NO↑+I2+K2SO4+Na2SO4+___________。请回答下列问题:(1)配平上述化学方程式,请写出其完整方程式
(2)鉴于NO是有毒气体,从环保角度来讲,要处理NaNO2,可以选用以下试剂
A. FeCl2 B. H2O2 C. KMnO4 D. H2SO4
(3)根据信息,鉴别亚硝酸钠和氯化钠的简单方法是
(4)已知亚硝酸钠与氯化铵反应生成氮气、氯化钠和水,写出该反应的化学方程式并用双线桥表示其电子转移的方向和数目:
您最近一年使用:0次



