名校
解题方法
1 . 五水硫酸铜在化工、农业、医药、食品等方面均有广泛的用途,实验室制备方法如下:
(1)制备硫酸铜溶液
称取3.0g铜粉放入双颈烧瓶中,加入11.0mL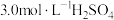 ,再分批缓慢加入5.0mL
,再分批缓慢加入5.0mL 浓
浓 ,待反应缓和后水浴加热。在加热过程中补加6.0mL
,待反应缓和后水浴加热。在加热过程中补加6.0mL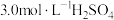 和1.0mL浓硝酸。
和1.0mL浓硝酸。
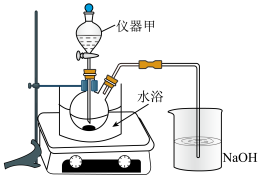
①仪器甲的名称是______ ,硝酸的主要作用是______ 。
②分批加入硝酸的主要原因是______ 。
③实验过程中,观察到有气体生成,NaOH溶液的作用是吸收______ 和______ 。
(2)制得五水硫酸铜粗品
待Cu接近于全部溶解后,趁热用倾析法将溶液转至小烧杯中,然后通过“相关操作”得到粗五水硫酸铜晶体。
①趁热用倾析法转液的目的是______ 、______ 。
②通过“相关操作”得到粗五水硫酸铜晶体,其“相关操作”是指将溶液转至蒸发皿中,水浴加热,______ 。
③如果蒸发水时温度过高,得到的晶体会偏白色,则原因是______ 。(用化学反应方程式表示)
(1)制备硫酸铜溶液
称取3.0g铜粉放入双颈烧瓶中,加入11.0mL
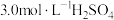 ,再分批缓慢加入5.0mL
,再分批缓慢加入5.0mL 浓
浓 ,待反应缓和后水浴加热。在加热过程中补加6.0mL
,待反应缓和后水浴加热。在加热过程中补加6.0mL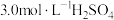 和1.0mL浓硝酸。
和1.0mL浓硝酸。
①仪器甲的名称是
②分批加入硝酸的主要原因是
③实验过程中,观察到有气体生成,NaOH溶液的作用是吸收
(2)制得五水硫酸铜粗品
待Cu接近于全部溶解后,趁热用倾析法将溶液转至小烧杯中,然后通过“相关操作”得到粗五水硫酸铜晶体。
①趁热用倾析法转液的目的是
②通过“相关操作”得到粗五水硫酸铜晶体,其“相关操作”是指将溶液转至蒸发皿中,水浴加热,
③如果蒸发水时温度过高,得到的晶体会偏白色,则原因是
您最近一年使用:0次
2024-04-04更新
|
256次组卷
|
3卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题
名校
解题方法
2 . 资源化利用CO2,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
(1)CO2的捕集:
①CO2属于___________ 分子(填“极性”或“非极性”),其晶体(干冰)属于__________ 晶体。
②用饱和 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)=_______ ;(室温下, 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式_____ 。
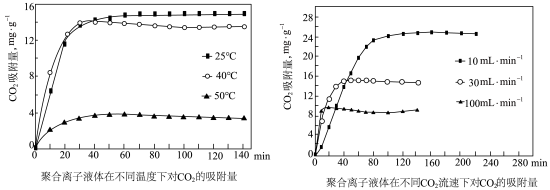
③聚合离子液体是目前广泛研究的CO2吸附剂。结合下图 分析聚合离子液体吸附CO2的有利条件是____________ 。
(2)生产尿素:工业上以CO2、 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步: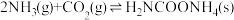
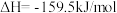
第二步:
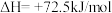
写出上述合成尿素的热化学方程式_______ 。
(3)合成乙酸:中国科学家首次以 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
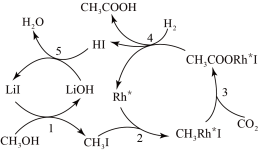
①原料中的 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:____________ 。
②根据图示 ,写出总反应的化学方程式:_______ 。
(1)CO2的捕集:
①CO2属于
②用饱和
 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)= 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式③聚合离子液体是目前广泛研究的CO2吸附剂。

(2)生产尿素:工业上以CO2、
 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:第一步:
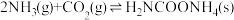
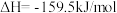
第二步:

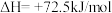
写出上述合成尿素的热化学方程式
(3)合成乙酸:中国科学家首次以
 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
①原料中的
 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:②
您最近一年使用:0次
2024-04-04更新
|
363次组卷
|
3卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题
名校
解题方法
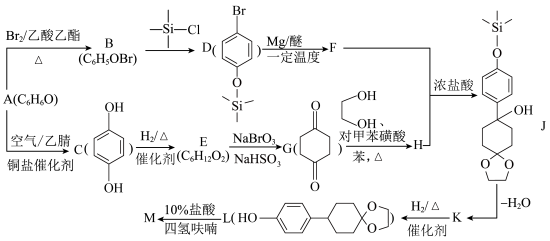
3 . 有机物M是一种制备液晶材料的重要中间体,其合成路线如图所示。
已知:Ⅰ.RX+Mg R-MgX(格林试剂),X=Cl、Br、I;
R-MgX(格林试剂),X=Cl、Br、I;
Ⅱ.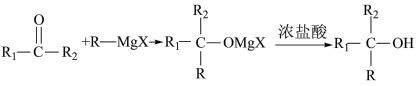 ;
;
Ⅲ.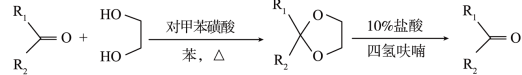 。
。
回答下列问题:
(1)A的俗称是___________ ,B的结构简式为___________ 。
(2)B→D的反应类型是___________ ,反应中使用三甲基氯硅烷(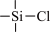 )的作用是
)的作用是___________ ,在本流程中起类似作用的有机物还有___________ (填名称)。
(3)G→H的化学方程式是___________ 。
(4)M的结构简式为___________ ,所含官能团有___________ (填名称)。
(5)符合下列条件的E的同分异构体有___________ 种(不考虑立体异构);其中核磁共振氢谱中显示有6组峰且峰面积之比为6∶2∶1∶1∶1∶1,同时含有1个手性碳原子的有机物结构简式为___________ (写一种)。
①能与金属钠反应产生氢气;②含两个甲基;③能发生银镜反应。

已知:Ⅰ.RX+Mg
 R-MgX(格林试剂),X=Cl、Br、I;
R-MgX(格林试剂),X=Cl、Br、I;Ⅱ.
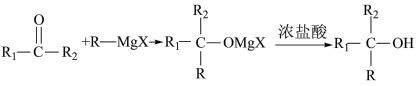 ;
;Ⅲ.
 。
。回答下列问题:
(1)A的俗称是
(2)B→D的反应类型是
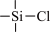 )的作用是
)的作用是(3)G→H的化学方程式是
(4)M的结构简式为
(5)符合下列条件的E的同分异构体有
①能与金属钠反应产生氢气;②含两个甲基;③能发生银镜反应。
您最近一年使用:0次
2024-04-04更新
|
180次组卷
|
2卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题
名校
4 . 叠氮化钠( )是一种防腐剂和分析试剂,在有机合成和汽车行业有着重要应用。学习小组对叠氮化钠的制备和产品纯度测定进行相关探究。
)是一种防腐剂和分析试剂,在有机合成和汽车行业有着重要应用。学习小组对叠氮化钠的制备和产品纯度测定进行相关探究。
查阅资料:
①氨基钠(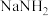 )熔点为208℃,易潮解和氧化;
)熔点为208℃,易潮解和氧化; 有强氧化性,不与酸、碱反应;叠氮酸(
有强氧化性,不与酸、碱反应;叠氮酸( )不稳定,易分解爆炸;
)不稳定,易分解爆炸;
② ,
, 。
。
回答下列问题:
I.制备
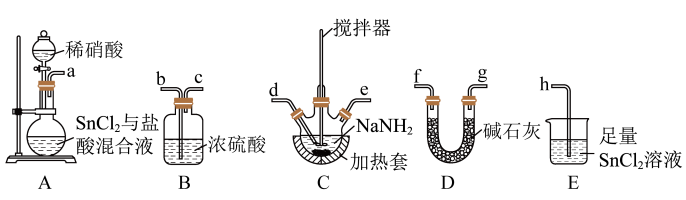
(1)按气流方向,上述装置合理的连接顺序为___________ (填仪器接口字母)。
(2)D的作用为___________ 。
(3)实验时E中生成 沉淀,反应的化学方程式为
沉淀,反应的化学方程式为___________ 。
Ⅱ.用如图所示装置测定产品纯度
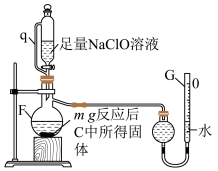
(4)仪器F的名称为___________ ;其中反应的离子方程式为___________ 。
(5)管q的作用为___________ 。
(6)若G的初始读数为 、末读数为
、末读数为 ,本实验条件下气体摩尔体积为
,本实验条件下气体摩尔体积为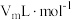 ,则产品中
,则产品中 的质量分数为
的质量分数为___________ 。
 )是一种防腐剂和分析试剂,在有机合成和汽车行业有着重要应用。学习小组对叠氮化钠的制备和产品纯度测定进行相关探究。
)是一种防腐剂和分析试剂,在有机合成和汽车行业有着重要应用。学习小组对叠氮化钠的制备和产品纯度测定进行相关探究。查阅资料:
①氨基钠(
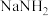 )熔点为208℃,易潮解和氧化;
)熔点为208℃,易潮解和氧化; 有强氧化性,不与酸、碱反应;叠氮酸(
有强氧化性,不与酸、碱反应;叠氮酸( )不稳定,易分解爆炸;
)不稳定,易分解爆炸;②
 ,
, 。
。回答下列问题:
I.制备


(1)按气流方向,上述装置合理的连接顺序为
(2)D的作用为
(3)实验时E中生成
 沉淀,反应的化学方程式为
沉淀,反应的化学方程式为Ⅱ.用如图所示装置测定产品纯度

(4)仪器F的名称为
(5)管q的作用为
(6)若G的初始读数为
 、末读数为
、末读数为 ,本实验条件下气体摩尔体积为
,本实验条件下气体摩尔体积为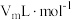 ,则产品中
,则产品中 的质量分数为
的质量分数为
您最近一年使用:0次
名校
5 . 实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料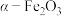 。其主要实验流程如下:
。其主要实验流程如下:
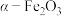 。其主要实验流程如下:
。其主要实验流程如下:
| A.酸浸:用一定浓度的硫酸浸取铁泥,能提高铁元素浸出率的措施有适当升高温度,加快搅拌速度 |
B.还原:向“酸浸”后的滤液中加入过量铁粉,可用KSCN溶液检验 是否完全还原 是否完全还原 |
C.沉铁:将提纯后的 溶液与氨水 溶液与氨水 混合溶液反应,生成 混合溶液反应,生成 沉淀的离子方程式为 沉淀的离子方程式为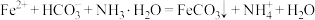 |
D.沉铁步骤中为防止生成 ,应在搅拌下向氨水 ,应在搅拌下向氨水 混合溶液中缓慢加入 混合溶液中缓慢加入 溶液 溶液 |
您最近一年使用:0次
2024-02-29更新
|
607次组卷
|
5卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题
名校
6 . 某小组通过下列实验测定可逆反应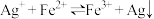 的平衡常数。
的平衡常数。
(1)配制 溶液
溶液
由 固体配制
固体配制 溶液,需要的仪器有烧杯、药匙、玻璃棒、
溶液,需要的仪器有烧杯、药匙、玻璃棒、___________ (从下列图中选择,写出名称)。

(2)验证反应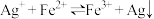 是可逆反应
是可逆反应
实验I:将 溶液和
溶液和 溶液
溶液
等体积混合,产生灰黑色沉淀,溶液呈黄色。
①取实验I反应后的上层清液或沉淀进行实验,将表格补充完整。
实验2中灰黑色沉淀溶解的离子方程式为___________ 。
②至少完成表格中实验___________ (选填1、2、3、4),可证明该反应为可逆反应。
(3)测定反应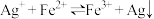 的平衡常数
的平衡常数
查阅资料:通过氧化还原滴定法可测定平衡时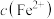 ,再计算得出
,再计算得出 和
和 ,进而求算出平衡常数K。
,进而求算出平衡常数K。
实验Ⅱ:室温下,待实验I中反应达到平衡状态时,取 上层清液,用
上层清液,用 标准溶液滴定
标准溶液滴定 ,达到滴定终点记录消耗
,达到滴定终点记录消耗 标准溶液的体积。重复实验3次,平均消耗
标准溶液的体积。重复实验3次,平均消耗 标准溶液的体积为
标准溶液的体积为 。
。
①计算平衡时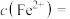
___________ ,平衡常数
___________ (用含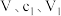 的计算式表示)。
的计算式表示)。
②若取实验Ⅰ中的浊液进行实验Ⅱ,会使测得的平衡常数 值
值___________ (填“偏高”“偏低”或“不受影响”),原因是___________ (用化学平衡移动原理解释)。
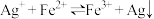 的平衡常数。
的平衡常数。(1)配制
 溶液
溶液由
 固体配制
固体配制 溶液,需要的仪器有烧杯、药匙、玻璃棒、
溶液,需要的仪器有烧杯、药匙、玻璃棒、
(2)验证反应
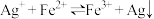 是可逆反应
是可逆反应实验I:将
 溶液和
溶液和 溶液
溶液
等体积混合,产生灰黑色沉淀,溶液呈黄色。
①取实验I反应后的上层清液或沉淀进行实验,将表格补充完整。
| 实验序号 | 操作及现象 | 结论 |
| 1 | 取上层清液,上层清液呈黄色 | 存在 |
| 2 | 取少量灰黑色沉淀,滴加浓硝酸,沉淀溶解,出现红棕色气体 | 存在 |
| 3 | 取上层清液,滴加 溶液,产生 溶液,产生 | 存在 |
| 4 | 取上层清液,滴加 | 存在 |
②至少完成表格中实验
(3)测定反应
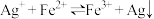 的平衡常数
的平衡常数查阅资料:通过氧化还原滴定法可测定平衡时
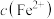 ,再计算得出
,再计算得出 和
和 ,进而求算出平衡常数K。
,进而求算出平衡常数K。实验Ⅱ:室温下,待实验I中反应达到平衡状态时,取
 上层清液,用
上层清液,用 标准溶液滴定
标准溶液滴定 ,达到滴定终点记录消耗
,达到滴定终点记录消耗 标准溶液的体积。重复实验3次,平均消耗
标准溶液的体积。重复实验3次,平均消耗 标准溶液的体积为
标准溶液的体积为 。
。①计算平衡时
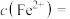

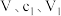 的计算式表示)。
的计算式表示)。②若取实验Ⅰ中的浊液进行实验Ⅱ,会使测得的平衡常数
 值
值
您最近一年使用:0次
名校
解题方法
7 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.常温下,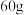 乙酸与甲酸甲酯的混合物中,含有的碳原子数为 乙酸与甲酸甲酯的混合物中,含有的碳原子数为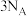 |
B.浓硝酸热分解生成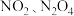 共 共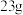 时,转移电子数为 时,转移电子数为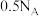 |
C.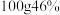 的乙醇溶液中含有 的乙醇溶液中含有 键的数目为 键的数目为 |
D.标准状况下,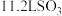 中含有 中含有 个硫原子 个硫原子 |
您最近一年使用:0次
名校
解题方法
8 . 锌及锌合金(如黄铜)广泛应用于生产、生活。某小组拟以锌矿(主要成分是ZnS,含少量FeS等杂质)为原料采用多种方法冶炼锌,流程如图。回答下列问题:
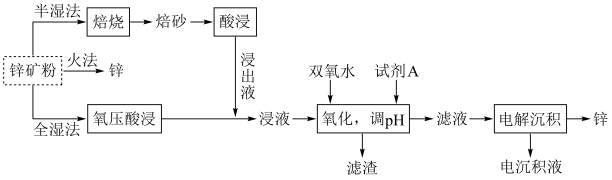
已知:① 是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
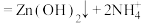 ,
,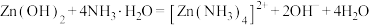 。
。
②常温下,几种金属离子转化成氢氧化物沉淀的pH如表:
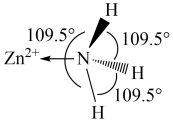
(1)已知 的部分结构如图所示,
的部分结构如图所示, 中
中 采用
采用 杂化,则
杂化,则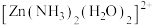 有
有_____ 种结构。 分子中的
分子中的 键角比
键角比 中的小的原因是
中的小的原因是_______ 。
(2)明代宋应星著的《天工开物》中有关“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内,封裹泥固,∙∙∙∙∙∙然后,逐层用煤炭饼垫盛,其底铺薪,发火煅红∙∙∙∙∙∙冷定,毁罐取出。∙∙∙∙∙∙即倭铅也。”(炉甘石主要成分是 ,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的
,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的_______ (填标号,下同)。从环保的角度来看,这三种方法中,最佳方法是_______ 。
a.半湿法 b.火法 c.全湿法
(3)“氧压酸浸”是在稀硫酸中加入锌矿粉,并在加压下通入 ,除生成
,除生成 外,还能回收非金属单质。ZnS参与反应的离子方程式为
外,还能回收非金属单质。ZnS参与反应的离子方程式为_________ 。
(4)“氧化,调pH”时试剂A不宜选择NaOH溶液,也不宜选择氨水,原因是________ 。
(5)“电解沉积”(以惰性材料为电极)时阳极的电极反应式为________ 。航母外壳常镶嵌一些锌块,这种保护航母的方法叫_______ 。
(6)通常认为离子浓度 mol⋅L
mol⋅L 时表示该离子已完全除尽。根据表格数据计算
时表示该离子已完全除尽。根据表格数据计算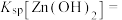
_____ 。

已知:①
 是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
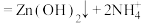 ,
,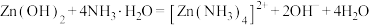 。
。②常温下,几种金属离子转化成氢氧化物沉淀的pH如表:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 6.5 | 9.7 |
 | 5.4 | 8.0 |
 | 2.3 | 4.1 |
(1)已知
 的部分结构如图所示,
的部分结构如图所示, 中
中 采用
采用 杂化,则
杂化,则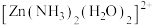 有
有 分子中的
分子中的 键角比
键角比 中的小的原因是
中的小的原因是
(2)明代宋应星著的《天工开物》中有关“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内,封裹泥固,∙∙∙∙∙∙然后,逐层用煤炭饼垫盛,其底铺薪,发火煅红∙∙∙∙∙∙冷定,毁罐取出。∙∙∙∙∙∙即倭铅也。”(炉甘石主要成分是
 ,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的
,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的a.半湿法 b.火法 c.全湿法
(3)“氧压酸浸”是在稀硫酸中加入锌矿粉,并在加压下通入
 ,除生成
,除生成 外,还能回收非金属单质。ZnS参与反应的离子方程式为
外,还能回收非金属单质。ZnS参与反应的离子方程式为(4)“氧化,调pH”时试剂A不宜选择NaOH溶液,也不宜选择氨水,原因是
(5)“电解沉积”(以惰性材料为电极)时阳极的电极反应式为
(6)通常认为离子浓度
 mol⋅L
mol⋅L 时表示该离子已完全除尽。根据表格数据计算
时表示该离子已完全除尽。根据表格数据计算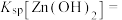
您最近一年使用:0次
2024-02-25更新
|
159次组卷
|
3卷引用:湖南省张家界市2023-2024学年高三上学期期末联考化学试题
名校
解题方法
9 . 衣食住行皆化学。下列物质在生活中的用途与其性质具有对应关系的是
| 选项 | 用途 | 性质 |
| A | 明矾净水 | 铝离子能够杀菌消毒 |
| B | 石英光纤用于通信 | 石英光纤传输光信号损耗低,带宽大,重量轻 |
| C | 氧化铝用于电解制取铝 | 氧化铝熔点高 |
| D | 茶叶常用于饼干类保鲜 | 茶叶酚具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-25更新
|
160次组卷
|
4卷引用:湖南省张家界市2023-2024学年高三上学期期末联考化学试题
名校
10 . 科学家设计了一种具有石墨正极的高容量可充电 电池,原理如图所示。氯化铝(
电池,原理如图所示。氯化铝( )溶解在亚硫酰氯(
)溶解在亚硫酰氯( )中,以氟化物(LiFSI)为溶剂。下列叙述正确的是
)中,以氟化物(LiFSI)为溶剂。下列叙述正确的是
 电池,原理如图所示。氯化铝(
电池,原理如图所示。氯化铝( )溶解在亚硫酰氯(
)溶解在亚硫酰氯( )中,以氟化物(LiFSI)为溶剂。下列叙述正确的是
)中,以氟化物(LiFSI)为溶剂。下列叙述正确的是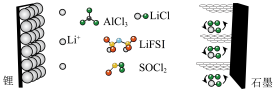
A.放电时,电解质溶液可以是 水溶液 水溶液 |
B.放电时,石墨极的电极反应式为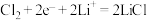 |
| C.充电时,石墨极与电源负极连接 |
D.充电时,转移 个电子时锂电极理论上消耗14g锂 个电子时锂电极理论上消耗14g锂 |
您最近一年使用:0次
2024-02-25更新
|
193次组卷
|
6卷引用:湖南省张家界市2023-2024学年高三上学期期末联考化学试题



