解题方法
1 . 某种胃药的有效成分为碳酸钙,为测定其含量,现将2.0g该药片溶于50mL稀盐酸中充分反应(药片中的其他成分不与盐酸反应),产生标准状况下 气体。
气体。
(1)若盐酸恰好完全反应,则其物质的量浓度为___________ 。
(2)药片中碳酸钙的质量分数为___________ 。
 气体。
气体。(1)若盐酸恰好完全反应,则其物质的量浓度为
(2)药片中碳酸钙的质量分数为
您最近一年使用:0次
名校
解题方法
2 . 硫氰化钾( )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如图所示:

已知:① 不溶于
不溶于 ,
, 为密度比水大且不溶于水的液体;
为密度比水大且不溶于水的液体;
②三颈烧瓶内盛放 、水和催化剂;
、水和催化剂;
③在水溶液中 受热易分解,
受热易分解, 在高于
在高于 时易分解。
时易分解。
回答下列问题:
Ⅰ.制备 溶液:反应原理:
溶液:反应原理: ,反应缓慢。
,反应缓慢。
(1)实验前,经检验装置的气密性良好。其中装置B的试剂为________ ,三颈烧瓶内的导气管必须插入下层 液体中,目的是
液体中,目的是_______ 。
(2)实验开始时,打开K,加热装置A、D,使A中产生的气体缓缓通入D中,当看到三颈烧瓶内______ 现象时说明该反应接近完全,熄灭装置A中的酒精灯,待D中无气泡时关闭 。
。
Ⅱ.制备 晶体:
晶体:
保持 关闭,维持三颈烧瓶内液温
关闭,维持三颈烧瓶内液温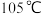 一段时间,使
一段时间,使 完全分解而除去,防止
完全分解而除去,防止 受热分解。然后打开
受热分解。然后打开 ,继续保持液温
,继续保持液温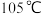 ,缓缓滴入适量的
,缓缓滴入适量的 溶液,装置D中生成
溶液,装置D中生成 ,放出。
,放出。
(3)E吸收 产生一种无污染气体,写出反应的离子方程式:
产生一种无污染气体,写出反应的离子方程式:___________ 。
滤去三颈烧瓶中的固体催化剂,减压蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到 晶体。
晶体。
Ⅲ.测定晶体中 的含量:
的含量:
(4)称取 样品,配成
样品,配成 溶液。从中量取
溶液。从中量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴_____ (填序号)溶液作指示剂,用 标准溶液重复滴定3次,滴定时发生的反应为
标准溶液重复滴定3次,滴定时发生的反应为 (白色)。当滴入最后一滴硝酸银溶液时,溶液血红色褪去,且
(白色)。当滴入最后一滴硝酸银溶液时,溶液血红色褪去,且 内不变色。即到达滴定终点。滴定三次,平均消耗
内不变色。即到达滴定终点。滴定三次,平均消耗 标准溶液的体积为
标准溶液的体积为 。则样品中
。则样品中 的质量分数为
的质量分数为_____ 。(用含m、c、V的式子表示)
A. B.
B. C.
C. D.
D. E.
E.
(5) 的化学性质与卤素离子相似,为探究
的化学性质与卤素离子相似,为探究 还原性与
还原性与 还原性强弱,某同学设计了如图装置。
还原性强弱,某同学设计了如图装置。
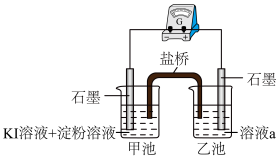
①则溶液a为________ 。
②一段时间后,当甲池中观察到________ 时,表明 还原性强于
还原性强于 还原性。
还原性。
 )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如图所示:
已知:①
 不溶于
不溶于 ,
, 为密度比水大且不溶于水的液体;
为密度比水大且不溶于水的液体;②三颈烧瓶内盛放
 、水和催化剂;
、水和催化剂;③在水溶液中
 受热易分解,
受热易分解, 在高于
在高于 时易分解。
时易分解。回答下列问题:
Ⅰ.制备
 溶液:反应原理:
溶液:反应原理: ,反应缓慢。
,反应缓慢。(1)实验前,经检验装置的气密性良好。其中装置B的试剂为
 液体中,目的是
液体中,目的是(2)实验开始时,打开K,加热装置A、D,使A中产生的气体缓缓通入D中,当看到三颈烧瓶内
 。
。Ⅱ.制备
 晶体:
晶体:保持
 关闭,维持三颈烧瓶内液温
关闭,维持三颈烧瓶内液温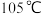 一段时间,使
一段时间,使 完全分解而除去,防止
完全分解而除去,防止 受热分解。然后打开
受热分解。然后打开 ,继续保持液温
,继续保持液温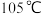 ,缓缓滴入适量的
,缓缓滴入适量的 溶液,装置D中生成
溶液,装置D中生成 ,放出。
,放出。(3)E吸收
 产生一种无污染气体,写出反应的离子方程式:
产生一种无污染气体,写出反应的离子方程式:滤去三颈烧瓶中的固体催化剂,减压蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到
 晶体。
晶体。Ⅲ.测定晶体中
 的含量:
的含量:(4)称取
 样品,配成
样品,配成 溶液。从中量取
溶液。从中量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴 标准溶液重复滴定3次,滴定时发生的反应为
标准溶液重复滴定3次,滴定时发生的反应为 (白色)。当滴入最后一滴硝酸银溶液时,溶液血红色褪去,且
(白色)。当滴入最后一滴硝酸银溶液时,溶液血红色褪去,且 内不变色。即到达滴定终点。滴定三次,平均消耗
内不变色。即到达滴定终点。滴定三次,平均消耗 标准溶液的体积为
标准溶液的体积为 。则样品中
。则样品中 的质量分数为
的质量分数为A.
 B.
B. C.
C. D.
D. E.
E.
(5)
 的化学性质与卤素离子相似,为探究
的化学性质与卤素离子相似,为探究 还原性与
还原性与 还原性强弱,某同学设计了如图装置。
还原性强弱,某同学设计了如图装置。
①则溶液a为
②一段时间后,当甲池中观察到
 还原性强于
还原性强于 还原性。
还原性。
您最近一年使用:0次
解题方法
3 . 某兴趣小组为测定某铝合金(含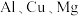 )样品中铝的含量,将
)样品中铝的含量,将 该铝合金溶于足量的
该铝合金溶于足量的 溶液中,收集到标准状况下
溶液中,收集到标准状况下 气体,则该铝合金中铝的质量分数为
气体,则该铝合金中铝的质量分数为
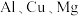 )样品中铝的含量,将
)样品中铝的含量,将 该铝合金溶于足量的
该铝合金溶于足量的 溶液中,收集到标准状况下
溶液中,收集到标准状况下 气体,则该铝合金中铝的质量分数为
气体,则该铝合金中铝的质量分数为A.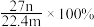 | B.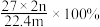 | C. | D. |
您最近一年使用:0次
解题方法
4 . 硫酸亚铁晶体 在医药上可以用作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量,实验步骤如图所示。下列说法不正确的是
在医药上可以用作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量,实验步骤如图所示。下列说法不正确的是
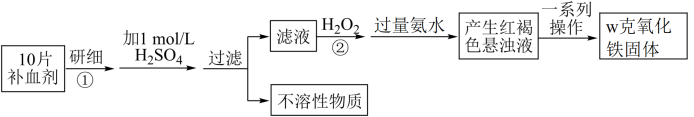
 在医药上可以用作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量,实验步骤如图所示。下列说法不正确的是
在医药上可以用作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量,实验步骤如图所示。下列说法不正确的是
| A.过滤时需要用到的玻璃仪器为:烧杯、漏斗、玻璃棒 |
B.步骤②中加入 的目的是将 的目的是将 完全转化为 完全转化为 ,可用酸性 ,可用酸性 溶液检验该目的是否达到 溶液检验该目的是否达到 |
| C.步骤中的“一系列操作”指过滤、洗涤、灼烧、冷却、称量 |
D.实验中铁元素无损耗,假设10片补血剂的质量为a克,则补血剂中铁元素的质量分数为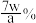 |
您最近一年使用:0次
名校
5 . 物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角, 与
与 都属于过氧化物。过氧化钙是一种难溶于水、可与水缓慢反应、能溶于酸的白色固体,广泛用于果蔬保鲜、空气净化、污水处理等方面。以下是一种制备过氧化钙的实验方法。
都属于过氧化物。过氧化钙是一种难溶于水、可与水缓慢反应、能溶于酸的白色固体,广泛用于果蔬保鲜、空气净化、污水处理等方面。以下是一种制备过氧化钙的实验方法。

已知: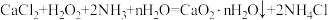
回答下列问题:
(1) 中氧元素化合价为
中氧元素化合价为___________ 。
(2)操作Ⅰ、Ⅱ为___________ 。
(3) 可用于长途运输鱼苗,利用了
可用于长途运输鱼苗,利用了 的性质有
的性质有___________ 。
A.能缓慢供氧 B.能潮解 C.能抑菌
(4)检验“洗涤”是否合格的方法是:取最后一次洗涤液少许于试管中,先滴加稀硝酸酸化,然后滴入___________ 溶液,看是否产生白色沉淀。
(5)工业的无水过氧化钙通常含有部分 ,实验室常采用以酸为介质,用高锰酸钾测定过氧化钙的含量。称取
,实验室常采用以酸为介质,用高锰酸钾测定过氧化钙的含量。称取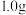 样品用稀硫酸溶解,滴加
样品用稀硫酸溶解,滴加 的酸性
的酸性 溶液,恰好完全反应时,消耗酸性
溶液,恰好完全反应时,消耗酸性 溶液的体积为
溶液的体积为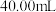 ,则该反应中还原剂为
,则该反应中还原剂为___________ , 的质量分数为
的质量分数为___________ 。(已知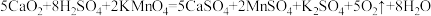 )
)
 与
与 都属于过氧化物。过氧化钙是一种难溶于水、可与水缓慢反应、能溶于酸的白色固体,广泛用于果蔬保鲜、空气净化、污水处理等方面。以下是一种制备过氧化钙的实验方法。
都属于过氧化物。过氧化钙是一种难溶于水、可与水缓慢反应、能溶于酸的白色固体,广泛用于果蔬保鲜、空气净化、污水处理等方面。以下是一种制备过氧化钙的实验方法。
已知:
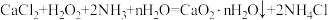
回答下列问题:
(1)
 中氧元素化合价为
中氧元素化合价为(2)操作Ⅰ、Ⅱ为
(3)
 可用于长途运输鱼苗,利用了
可用于长途运输鱼苗,利用了 的性质有
的性质有A.能缓慢供氧 B.能潮解 C.能抑菌
(4)检验“洗涤”是否合格的方法是:取最后一次洗涤液少许于试管中,先滴加稀硝酸酸化,然后滴入
(5)工业的无水过氧化钙通常含有部分
 ,实验室常采用以酸为介质,用高锰酸钾测定过氧化钙的含量。称取
,实验室常采用以酸为介质,用高锰酸钾测定过氧化钙的含量。称取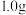 样品用稀硫酸溶解,滴加
样品用稀硫酸溶解,滴加 的酸性
的酸性 溶液,恰好完全反应时,消耗酸性
溶液,恰好完全反应时,消耗酸性 溶液的体积为
溶液的体积为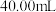 ,则该反应中还原剂为
,则该反应中还原剂为 的质量分数为
的质量分数为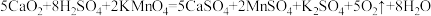 )
)
您最近一年使用:0次
2022-01-19更新
|
252次组卷
|
3卷引用:云南省玉溪市第二中学2022-2023学年高一下学期期末考试 化学试题
名校
6 . X、Y、Z、Q四种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳中含量(质量分数)最多的元素,Q的核电荷数是X与Z的核电荷数之和。请回答下列问题。
(1)X、Y的元素符号依次为___________ 、___________ 。
(2)XZ2与YZ2分别属于___________ (填“极性分子”或“非极性分子”,下同)和___________ 。
(3)Q的元素符号是___________ ,它位于第___________ 周期,它的基态原子的核外电子排布式为___________ ,在形成化合物时它的最高化合价为___________ 。
(1)X、Y的元素符号依次为
(2)XZ2与YZ2分别属于
(3)Q的元素符号是
您最近一年使用:0次
2021-07-09更新
|
87次组卷
|
3卷引用:云南省玉溪师范学院附属中学2021-2022学年高二上学期期末考试化学试题
名校
解题方法
7 . NaCl是一种化工原料,可以制备多种物质,如图所示。
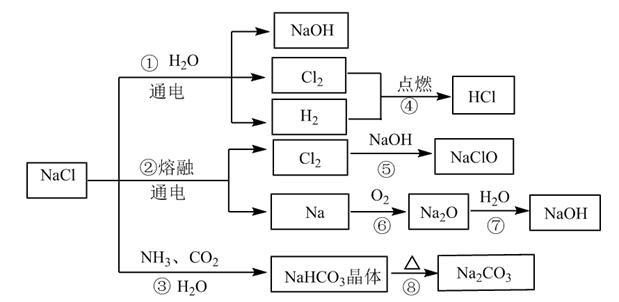
请回答下列问题:
(1)图所列物质中属于电解质的有___________ 种,转化反应中属于氧化还原反应的有___________ (填图中序号)
(2)工业上制取NaOH主要采用反应①,而不采用反应⑦的方法,主要原因是___________ 。
(3)反应④的现象是___________ ;反应⑤的化学方程式为___________ 。
(4)NaClO是“84消毒液”的有效成分,在抗击新冠肺炎疫情中发挥了重要作用。某同学购买了一瓶某品牌的“84消毒液”,查看相关资料及包装说明可获得以下信息:原液净含量为600g、密度约为1.1g/cm3、有效成分NaClO的质量分数约为1.9%(通过有效氯含量折算而得)。该同学从中取出100mL原液,按包装说明稀释30倍(体积之比)后用于家庭一般物体表面消毒,稀释后的溶液中c(NaClO)=___________ mol/L(结果保留两位小数);“84消毒液”不能与“洁厕灵(主要成分是HCl)”混合使用,否则会产生黄绿色的有毒气体引起安全事故,其反应的离子方程式是___________ 。

请回答下列问题:
(1)图所列物质中属于电解质的有
(2)工业上制取NaOH主要采用反应①,而不采用反应⑦的方法,主要原因是
(3)反应④的现象是
(4)NaClO是“84消毒液”的有效成分,在抗击新冠肺炎疫情中发挥了重要作用。某同学购买了一瓶某品牌的“84消毒液”,查看相关资料及包装说明可获得以下信息:原液净含量为600g、密度约为1.1g/cm3、有效成分NaClO的质量分数约为1.9%(通过有效氯含量折算而得)。该同学从中取出100mL原液,按包装说明稀释30倍(体积之比)后用于家庭一般物体表面消毒,稀释后的溶液中c(NaClO)=
您最近一年使用:0次
2021-11-13更新
|
358次组卷
|
2卷引用:云南省教育联盟2022-2023学年高一上学期期末学业水平测试化学试题
名校
8 . 某研究小组设计如图所示实验装置(夹持装置已略去)分别探究NO与铜粉、Na2O2的反应。
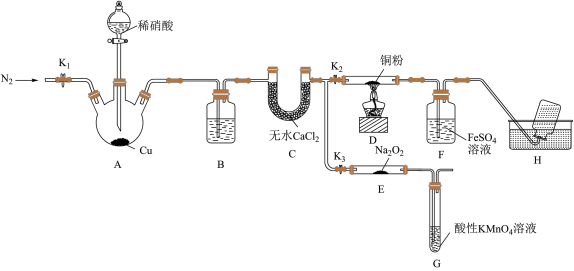
已知:①NO与Na2O2可发生反应2NO+Na2O2 =2NaNO2。
②NO、NO 能被酸性高锰酸钾溶液氧化为
能被酸性高锰酸钾溶液氧化为
③在溶液中存在平衡FeSO4+NO Fe(NO)SO4(棕色)
Fe(NO)SO4(棕色)
I.关闭K3,打开K2,探究NO与铜粉的反应并检验NO。
(1)反应开始前,打开K1,通入一段时间N2,其目的是________ 。
(2)装置B中盛放的试剂为水,其作用是________ 。
(3)装置F中的实验现象为______ 。装置H中收集的气体为N2和_______ (填化学式)。
Ⅱ.关闭K2,打开K3,探究NO与Na2O2的反应并制备NaNO2。
(4)装置G的作用是________ 。
(5)若省略装置C,则进入装置G中的气体除N2、NO外,可能还有NO2和_____ (填化学式)。
(6)测定反应后装置E中NaNO2的含量。已知;在酸性条件下,NO 可将MnO
可将MnO 还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
①判断滴定终点的方法________ 。
②样品中NaNO2的质量分数为___________ (用含有a、b的代数式表示)。
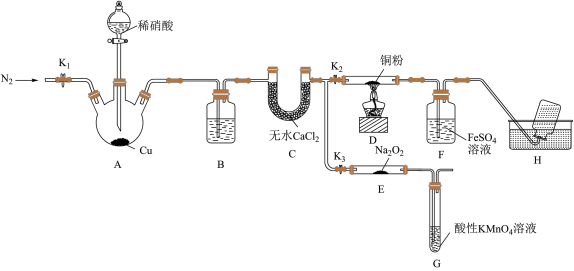
已知:①NO与Na2O2可发生反应2NO+Na2O2 =2NaNO2。
②NO、NO
 能被酸性高锰酸钾溶液氧化为
能被酸性高锰酸钾溶液氧化为
③在溶液中存在平衡FeSO4+NO
 Fe(NO)SO4(棕色)
Fe(NO)SO4(棕色)I.关闭K3,打开K2,探究NO与铜粉的反应并检验NO。
(1)反应开始前,打开K1,通入一段时间N2,其目的是
(2)装置B中盛放的试剂为水,其作用是
(3)装置F中的实验现象为
Ⅱ.关闭K2,打开K3,探究NO与Na2O2的反应并制备NaNO2。
(4)装置G的作用是
(5)若省略装置C,则进入装置G中的气体除N2、NO外,可能还有NO2和
(6)测定反应后装置E中NaNO2的含量。已知;在酸性条件下,NO
 可将MnO
可将MnO 还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。①判断滴定终点的方法
②样品中NaNO2的质量分数为
您最近一年使用:0次
2020-11-04更新
|
690次组卷
|
5卷引用:云南省普洱市景东县第一中学2021届高三上学期期末考试化学试题
名校
9 . 某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)称取样品ag。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有___ 离子,滤渣中含有___ ;在溶解过滤时使用的仪器有___ 。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的离子方程式____ 。
(4)在第(3)步的滤液中通入足量CO2过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。有关反应的化学方程式为____ 。
(5)计算该样品中铝的质量分数的表达式为___ 。
(6)若第(3)步中加入NaOH溶液的量不足时,会使测定的结果___ (“偏高”“偏低”或“无影响”,下同)。若第(4)步对沉淀的灼烧不充分时,会使测定的结果___ 。若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果____ 。
(1)称取样品ag。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的离子方程式
(4)在第(3)步的滤液中通入足量CO2过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。有关反应的化学方程式为
(5)计算该样品中铝的质量分数的表达式为
(6)若第(3)步中加入NaOH溶液的量不足时,会使测定的结果
您最近一年使用:0次
2020-01-07更新
|
163次组卷
|
5卷引用:云南省师宗县第二中学2019-2020学年高一上学期期末考试化学试题
2014高三·全国·专题练习
名校
解题方法
10 . 2008年10月8日,瑞典皇家科学院宣布将诺贝尔化学奖授予日本科学家下村修、美国科学家马丁•沙尔菲与美籍华裔科学家钱永健,以表彰三人因在发现和研究绿色荧光蛋白方面做出的贡献。蛋白质是一类复杂的含氮化合物,每种蛋白质都有其恒定的含氮量[约在14%~18%(本题涉及的含量均为质量分数)],故食品中蛋白质的含量测定常用凯氏定氮法,其测定原理是:
Ⅰ.蛋白质中的氮(用氨基表示)在强热和CuSO4、浓H2SO4作用下,生成一种无机含氮化合物,反应式为:2(-NH2)+H2SO4+2H+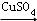 ;
;
Ⅱ.该无机化合物在凯氏定氮器中与碱作用,通过蒸馏释放出NH3,收集于H3BO3溶液中,生成(NH4)2B4O7;
Ⅲ.用已知浓度的HCl标准溶液滴定,根据HCl消耗的量计算出氮的含量,然后乘以相应的换算系数,即得蛋白质的含量。
(1)上述原理第Ⅰ步生成的无机含氮化合物化学式为_________ ;
(2)乳制品的换算系数为6.38,即若检测出氮的含量为1%,蛋白质的含量则为6.38%.不法分子通过在低蛋白含量的奶粉中加入三聚氰胺(Melamine)来“提高”奶粉中的蛋白质含量,导致许多婴幼儿肾结石。
①三聚氰胺的结构如图所示,其化学式为_________ ,含氮量(氮元素的质量分数)为_________ ;
②下列关于三聚氰胺的说法中,正确的有_________ ;
A.三聚氰胺是一种白色结晶粉末,无色无味,所以掺入奶粉后不易被发现
B.三聚氰胺分子中所有原子可能在同一个平面上
C.三聚氰胺呈弱碱性,可以和酸反应生成相应的盐
③假定奶粉中蛋白质含量为16%即为合格,不法分子在一罐总质量为500g、蛋白质含量为0的假奶粉中掺入_________ g的三聚氰胺就可使奶粉“达标”。

Ⅰ.蛋白质中的氮(用氨基表示)在强热和CuSO4、浓H2SO4作用下,生成一种无机含氮化合物,反应式为:2(-NH2)+H2SO4+2H+
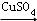 ;
;Ⅱ.该无机化合物在凯氏定氮器中与碱作用,通过蒸馏释放出NH3,收集于H3BO3溶液中,生成(NH4)2B4O7;
Ⅲ.用已知浓度的HCl标准溶液滴定,根据HCl消耗的量计算出氮的含量,然后乘以相应的换算系数,即得蛋白质的含量。
(1)上述原理第Ⅰ步生成的无机含氮化合物化学式为
(2)乳制品的换算系数为6.38,即若检测出氮的含量为1%,蛋白质的含量则为6.38%.不法分子通过在低蛋白含量的奶粉中加入三聚氰胺(Melamine)来“提高”奶粉中的蛋白质含量,导致许多婴幼儿肾结石。
①三聚氰胺的结构如图所示,其化学式为
②下列关于三聚氰胺的说法中,正确的有
A.三聚氰胺是一种白色结晶粉末,无色无味,所以掺入奶粉后不易被发现
B.三聚氰胺分子中所有原子可能在同一个平面上
C.三聚氰胺呈弱碱性,可以和酸反应生成相应的盐
③假定奶粉中蛋白质含量为16%即为合格,不法分子在一罐总质量为500g、蛋白质含量为0的假奶粉中掺入

您最近一年使用:0次
2020-02-05更新
|
183次组卷
|
5卷引用:云南省马关县第二中学2019-2020学年高二上学期期末考试化学试题
云南省马关县第二中学2019-2020学年高二上学期期末考试化学试题云南省普洱市镇沅县第一中学2019—2020学年高二上学期期末考试化学试题云南省丽江市玉龙县第一中学2019—2020学年高二上学期期末考试化学广西武宣县第二中学2019-2020学年高二上学期期末考试化学试题(已下线)2014高考化学苏教版总复习 专题9有机化合物的获取与应用练习卷



