名校
解题方法
1 . 1~18号元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数等于其L层电子数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是
| A.C>D>B>A | B.D>B>A>C | C.A>D>C>B | D.B>A>C>D |
您最近一年使用:0次
2024-04-13更新
|
32次组卷
|
23卷引用:陕西省西安市蓝田县乡镇学校联考2023-2024学年高一上学期1月期末化学试题
陕西省西安市蓝田县乡镇学校联考2023-2024学年高一上学期1月期末化学试题云南省广南县二中2019-2020学年高一上学期期末考试化学试题甘肃省张掖市2021-2022学年高一上学期期末学业水平质量检测化学试题宁夏石嘴山第三中学2021-2022学年高一下学期期末考试化学试题北京市第一六六中学2022-2023学年高一上学期期末考试化学试题2015-2016学年贵州省遵义一中高一下第二次联考化学试卷河南省安阳市第三十六中学2016-2017学年高一5月月考化学试题吉林省长春市德惠市实验中学2018-2019学年高一下学期期初检测化学试题步步为赢 初高中衔接教材化学暑假作业:第1课时 人类对原子结构的认识鲁科版(2019)高一必修第二册 第1章 原子结构 元素周期律章末综合检测卷湖南省长沙县第九中学2019-2020学年高一上学期第一次月考化学试题江苏省盐城市响水中学2020-2021学年高一上学期期中考试化学试题(已下线)4.1.1 原子结构 元素周期表 核素(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)江苏省如皋中学2020-2021学年高一上学期第二次阶段考试化学试题广东省普宁二中实验学校2021-2022学年高三上学期第一次月考化学试题(已下线)易错专题26 原子的构成-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)云南省楚雄州民族中学2021-2022学年高一下学期2月开学考试化学试题第一节 原子结构与元素周期表 第1课时 原子结构 核素山东省菏泽市郓城县第一中学2021-2022学年高一下学期3月阶段性检测化学试题江苏省邳州市宿羊山高级中学2021-2022学年高一上学期第二次学情检测化学试题(已下线)4.1.2 原子核外电子排布规律-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)福建省政和县第二中学2022-2023学年高一下学期第一次月考化学试题广西壮族自治区玉林市五校2022-2023学年高二下学期5月联考化学试题
名校
2 . 某科学研究小组制备硝基苯的实验装置如图所示,相关数据见下表。
已知该实验中存在的主要副反应是:在温度稍高的情况下会生成间二硝基苯。
取20mL浓硫酸与足量浓硝酸配制成混合酸,将混合酸小心加入B中。取17.7mL(约15.60g)苯加入A中。在室温下,向苯中逐滴加入混合酸,边滴加边搅拌,混合均匀加热,使其在50-60℃下发生反应,直至反应结束。将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。在分出的产物中加入无水CaCl2颗粒,静置片刻,过滤,对滤液进行蒸馏纯化,收集205~210℃的馏分,得到纯硝基苯18g。
回答下列问题:
(1)图中装置C的作用是___________ 。
(2)制备硝基苯的化学方程式为___________ 。
(3)配制混合酸时,能否将浓硝酸加入浓硫酸中?___________ (填“能”或“不能”)。
(4)为了使反应在50~60℃下进行,常采用的加热方法是___________ 。反应结束并冷却至室温后A中液体为粗硝基苯,粗硝基苯呈黄色的原因是___________ 。
(5)在洗涤操作中,第二次水洗的目的是___________ 。
(6)本实验所得到的硝基苯(硝基苯的摩尔质量为123g/mol)的产率是___________ (保留两位有效数字)。
已知该实验中存在的主要副反应是:在温度稍高的情况下会生成间二硝基苯。
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 不溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 42 | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | 10.4 | 338 | 1.84 | 易溶于水 |

取20mL浓硫酸与足量浓硝酸配制成混合酸,将混合酸小心加入B中。取17.7mL(约15.60g)苯加入A中。在室温下,向苯中逐滴加入混合酸,边滴加边搅拌,混合均匀加热,使其在50-60℃下发生反应,直至反应结束。将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。在分出的产物中加入无水CaCl2颗粒,静置片刻,过滤,对滤液进行蒸馏纯化,收集205~210℃的馏分,得到纯硝基苯18g。
回答下列问题:
(1)图中装置C的作用是
(2)制备硝基苯的化学方程式为
(3)配制混合酸时,能否将浓硝酸加入浓硫酸中?
(4)为了使反应在50~60℃下进行,常采用的加热方法是
(5)在洗涤操作中,第二次水洗的目的是
(6)本实验所得到的硝基苯(硝基苯的摩尔质量为123g/mol)的产率是
您最近一年使用:0次
2024-02-19更新
|
242次组卷
|
2卷引用:陕西师范大学附属中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
3 . 硒化锌是一种重要的半导体材料,其晶胞结构如图甲所示,已知晶胞参数为pnm,图乙为晶胞的俯视图。下列说法正确的是
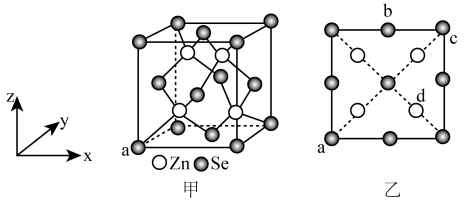
| A.晶胞中硒原子的配位数为8 | B.晶胞中d点原子分数坐标为( , ,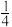 , ,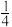 ) ) |
| C.硒位于第四周期第ⅣA族 | D.Zn和Se的最短距离为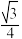 pnm pnm |
您最近一年使用:0次
2024-02-19更新
|
418次组卷
|
2卷引用:陕西师范大学附属中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
4 . 38.4gCu与一定量浓硝酸恰好完全反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到 和
和 的混合溶液,反应过程及有关数据如图所示
的混合溶液,反应过程及有关数据如图所示
 和
和 的混合溶液,反应过程及有关数据如图所示
的混合溶液,反应过程及有关数据如图所示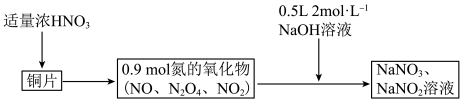
| A.硝酸在反应中既体现氧化性又体现酸性 |
| B.氮的氧化物和NaOH溶液反应时,NO作还原剂 |
C.混合气体中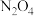 的物质的量是0.2mol 的物质的量是0.2mol |
| D.若浓硝酸体积为200mL,则其物质的量浓度为11mol/L |
您最近一年使用:0次
2024-02-17更新
|
1369次组卷
|
14卷引用:陕西省西安铁一中学2023-2024学年高一上学期期末考试化学试题
陕西省西安铁一中学2023-2024学年高一上学期期末考试化学试题陕西省商洛市商州区高级中学2023-2024学年高一下学期3月月考化学试题重庆市第七中学校2023-2024学年高一下学期第一次月考化学试卷广东省佛山市顺德区容山中学2023-2024学年高一下学期3月月考化学试题(已下线)安徽省皖北县中联盟2023-2024学年高一下学期3月月考化学试题内蒙古自治区乌兰浩特第一中学2023-2024学年高一下学期第一次月考化学试题山东省临沂第四中学2023-2024学年高一下学期3月月考化学试题江西省抚州市金溪县第一中学2023-2024学年高一下学期第一次月考化学试卷江西省宜春市丰城中学2023-2024学年高一下学期3月月考化学试题安徽省淮南市第二中2023-2024学年高一下学期第一次月考化学试题四川省射洪中学校强基班2023-2024学年高一下学期4月第一次月考化学试题黑龙江省哈尔滨市第六中学校2023-2024学年高一下学期4月测试化学试卷山东省淄博第十一中学2023-2024学年高一下学期4月阶段性考试化学试卷江西省宜春市上高二中2023-2024学年高一下学期3月月考化学试题
5 . 氨氮废水造成湖泊富营养化,某研究团队设计处理流程如下: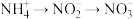 转化,在反硝化过程中实现
转化,在反硝化过程中实现 转化。下列说法正确的是
转化。下列说法正确的是

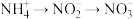 转化,在反硝化过程中实现
转化,在反硝化过程中实现 转化。下列说法正确的是
转化。下列说法正确的是| A.硝化过程中,含氮物质均发生还原反应 |
| B.反硝化过程属于氮的固定 |
| C.在一定条件下向废水中加入甲醇(CH3OH)可实现反硝化过程,甲醇中某元素的化合价会升高 |
| D.HNO3完全转化成1molN2时,转移的电子数为5NA |
您最近一年使用:0次
2024-02-03更新
|
498次组卷
|
7卷引用:陕西省渭南市2023-2024学年高一上学期1月期末考试化学试题
名校
解题方法
6 . 298K时,向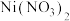 、
、 、
、 的混合液中滴加KCN溶液,混合液中lgx与
的混合液中滴加KCN溶液,混合液中lgx与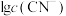 的关系如图所示,
的关系如图所示, 或
或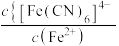 或
或 。下列叙述正确的是
。下列叙述正确的是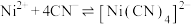
 ;
;
②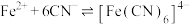
 ;
;
③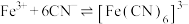
 ,且
,且 。
。
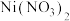 、
、 、
、 的混合液中滴加KCN溶液,混合液中lgx与
的混合液中滴加KCN溶液,混合液中lgx与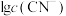 的关系如图所示,
的关系如图所示, 或
或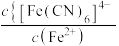 或
或 。下列叙述正确的是
。下列叙述正确的是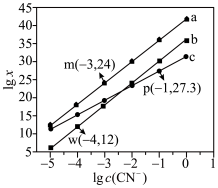
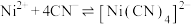
 ;
;②
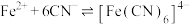
 ;
;③
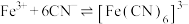
 ,且
,且 。
。A.直线c代表 与 与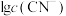 的关系 的关系 |
B.根据图像可计算平衡常数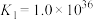 |
C.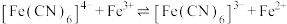 的平衡常数 的平衡常数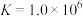 |
D.向含相同浓度的 和 和 的溶液中滴加KCN溶液,先生成 的溶液中滴加KCN溶液,先生成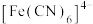 |
您最近一年使用:0次
2024-02-01更新
|
307次组卷
|
5卷引用:陕西省西安市鄠邑区2023-2024学年高三上学期期末考试理科综合试题-高中化学
7 . 盐酸和草酸是生活中常见的酸,回答下列问题:
Ⅰ.某学生用0.2000mol/L的标准NaOH溶液滴定未知浓度的盐酸,操作如下:
a.用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
b.固定好滴定管并使滴定管尖嘴处充满液体;
c.调节液面至“0”或“0”刻度线以下,并记下读数;
d.移取20.00L待测液注入洁净的存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
e.用标准液滴定至终点,记下滴定管液面读数。
(1)以上步骤中有错误的是___________ (填字母)。
(2)该同学将中和滴定原理应用到葡萄酒中抗氧化剂残留量(以游离 计算)的测定中:
计算)的测定中:
准确量取100.00L葡萄酒样品,加酸蒸馏出抗氧化剂成分,取馏分于锥形瓶中,滴加少量淀粉溶液,用0.0100mo/L标准 溶液滴定至终点,重复操作三次,平均消耗标准溶液22.50mL。(已知滴定过程中所发生的反应是
溶液滴定至终点,重复操作三次,平均消耗标准溶液22.50mL。(已知滴定过程中所发生的反应是 )
)
①滴定前需排放装有标准溶液的滴定管尖嘴处的气泡,其正确的图示为___________ (填字母)。
A. B.
B. 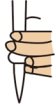 C.
C. 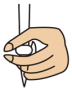 D.
D.
②判断达到滴定终点的依据是___________ ;所测100.00mL葡萄酒样品中抗氧化剂的残留量为___________ mg/L。
Ⅱ.已知常温下的电离平衡常数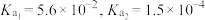 ,某化学小组研究草酸
,某化学小组研究草酸 及其盐的性质。
及其盐的性质。
(3) 中
中 的杂化类型是
的杂化类型是___________ 。
(4)常温下,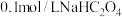 溶液中各离子浓度由大到小的顺序为
溶液中各离子浓度由大到小的顺序为___________ 。
(5)下列 溶液中离子浓度的关系不正确的是
溶液中离子浓度的关系不正确的是___________ (填字母)。
A.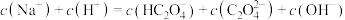
B.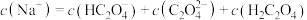
C.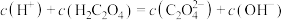
(6)探究 和
和 在溶液中的反应。
在溶液中的反应。
【资料】i.三水三草酸合铁酸钾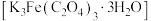 为翠绿色晶体,光照易分解,其水溶液中存在:
为翠绿色晶体,光照易分解,其水溶液中存在: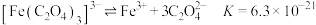 。
。
ii.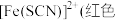
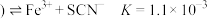 。
。
进行如下实验:
经检验,上述实验中 和
和 未发生氧化还原反应。
未发生氧化还原反应。
取实验中少量晶体洗净,配成溶液波,滴加 溶液,不变红,原因是
溶液,不变红,原因是___________ (结合资料,用必要的化学用语和数据解释原因),继续加入硫酸,溶液变红,说明加入硫酸, 与
与 结合使反应
结合使反应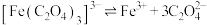 平衡
平衡___________ (填“正向”或“逆向”)移动。
(7)设计实验证明草酸的酸性比碳酸强:___________ 。
Ⅰ.某学生用0.2000mol/L的标准NaOH溶液滴定未知浓度的盐酸,操作如下:
a.用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
b.固定好滴定管并使滴定管尖嘴处充满液体;
c.调节液面至“0”或“0”刻度线以下,并记下读数;
d.移取20.00L待测液注入洁净的存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
e.用标准液滴定至终点,记下滴定管液面读数。
(1)以上步骤中有错误的是
(2)该同学将中和滴定原理应用到葡萄酒中抗氧化剂残留量(以游离
 计算)的测定中:
计算)的测定中:准确量取100.00L葡萄酒样品,加酸蒸馏出抗氧化剂成分,取馏分于锥形瓶中,滴加少量淀粉溶液,用0.0100mo/L标准
 溶液滴定至终点,重复操作三次,平均消耗标准溶液22.50mL。(已知滴定过程中所发生的反应是
溶液滴定至终点,重复操作三次,平均消耗标准溶液22.50mL。(已知滴定过程中所发生的反应是 )
)①滴定前需排放装有标准溶液的滴定管尖嘴处的气泡,其正确的图示为
A.
 B.
B.  C.
C.  D.
D.
②判断达到滴定终点的依据是
Ⅱ.已知常温下的电离平衡常数
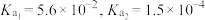 ,某化学小组研究草酸
,某化学小组研究草酸 及其盐的性质。
及其盐的性质。(3)
 中
中 的杂化类型是
的杂化类型是(4)常温下,
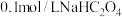 溶液中各离子浓度由大到小的顺序为
溶液中各离子浓度由大到小的顺序为(5)下列
 溶液中离子浓度的关系不正确的是
溶液中离子浓度的关系不正确的是A.
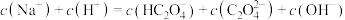
B.
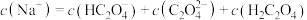
C.
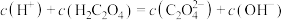
(6)探究
 和
和 在溶液中的反应。
在溶液中的反应。【资料】i.三水三草酸合铁酸钾
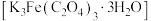 为翠绿色晶体,光照易分解,其水溶液中存在:
为翠绿色晶体,光照易分解,其水溶液中存在: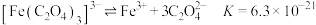 。
。ii.
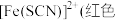
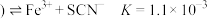 。
。进行如下实验:
| 操作 | 现象 |
在避光处,向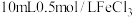 溶液中缓慢加入 溶液中缓慢加入  溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 | 得到翠绿色溶液和翠绿色晶体 |
 和
和 未发生氧化还原反应。
未发生氧化还原反应。取实验中少量晶体洗净,配成溶液波,滴加
 溶液,不变红,原因是
溶液,不变红,原因是 与
与 结合使反应
结合使反应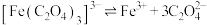 平衡
平衡(7)设计实验证明草酸的酸性比碳酸强:
您最近一年使用:0次
8 . 高铁酸钾(K2FeO4)具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程:
回答下列问题:
(1)写出①中发生反应的离子方程式:___________ 。
(2)②中加入NaOH固体的目的是___________(填字母序号)。
(3)完成④中反应的离子方程式:___________ ,氧化剂与氧化产物的物质的量之比为___________ ;若反应每生成lmol 转移电子的数目为:
转移电子的数目为:___________ 。
(4)从溶液II中得到K2FeO4晶体的操作是___________ 、洗涤、千燥。
(5)⑥中洗涤时,洗涤剂最好选用___________(填字母序号)。

| 溶解性 | 溶于水,微溶于浓KOH溶液,难溶于有机物 |
| 稳定性 | 温度为0~5℃或强碱性溶液中能稳定存在;酸性或中性溶液中放出O2 |
(1)写出①中发生反应的离子方程式:
(2)②中加入NaOH固体的目的是___________(填字母序号)。
| A.为后续反应提供碱性环境 |
| B.加入NaOH固体做氧化剂有利于除去NaCl |
| C.NaOH固体溶解时会放出较多的热量,有利于后续生成K2FeO4 |
| D.与溶液I中过量的Cl2继续反应,生成更多的NaClO |
(3)完成④中反应的离子方程式:
 转移电子的数目为:
转移电子的数目为:(4)从溶液II中得到K2FeO4晶体的操作是
(5)⑥中洗涤时,洗涤剂最好选用___________(填字母序号)。
| A.KOH溶液 | B.乙醇 | C.H2O | D.FeCl2溶液 |
您最近一年使用:0次
名校
解题方法
9 . 室温下,下列实验的探究方案能够达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 室温下,向一定量的饱和 溶液中通入足量的 溶液中通入足量的 气体,观察是否有晶体析出 气体,观察是否有晶体析出 | 探究室温下 固体和 固体和 固体在水中的溶解度大小 固体在水中的溶解度大小 |
| B | 向两支试管中各加入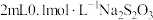 溶液,分别放入盛有冷水和热水的两个烧杯中,再同时分别向两支试管中加入 溶液,分别放入盛有冷水和热水的两个烧杯中,再同时分别向两支试管中加入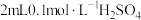 溶液,振荡,观察现象 溶液,振荡,观察现象 | 探究温度对化学反应速率的影响 |
| C | 向 的蔗糖溶液中加入少量稀 的蔗糖溶液中加入少量稀 ,加热,再加入新制氢氧化铜溶液,观察现象 ,加热,再加入新制氢氧化铜溶液,观察现象 | 探究蔗糖的水解条件 |
| D | 以 为电极,以酸化的 为电极,以酸化的 的 的 溶液作电解质溶液,连接成原电池装置,过一段时间,从 溶液作电解质溶液,连接成原电池装置,过一段时间,从 电极区取少量溶液于试管中,再向试管中滴入2滴 电极区取少量溶液于试管中,再向试管中滴入2滴 溶液,观察现象 溶液,观察现象 | 探究牺牲阳极的阴极保护法 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-15更新
|
457次组卷
|
2卷引用:陕西省西安市西北工业大学附属中学2023-2024学年高二上学期期末质量检化学试题
名校
解题方法
10 . 向一定量的Fe和 的混合物中加入100mL0.1mol/L的稀硫酸,固体恰好完全溶解且有气体放出,所得溶液滴加KSCN无明显现象;若用足量的
的混合物中加入100mL0.1mol/L的稀硫酸,固体恰好完全溶解且有气体放出,所得溶液滴加KSCN无明显现象;若用足量的 在高温下去还原相同质量的此混合物,充分反应后,得到的固体的质量为
在高温下去还原相同质量的此混合物,充分反应后,得到的固体的质量为
 的混合物中加入100mL0.1mol/L的稀硫酸,固体恰好完全溶解且有气体放出,所得溶液滴加KSCN无明显现象;若用足量的
的混合物中加入100mL0.1mol/L的稀硫酸,固体恰好完全溶解且有气体放出,所得溶液滴加KSCN无明显现象;若用足量的 在高温下去还原相同质量的此混合物,充分反应后,得到的固体的质量为
在高温下去还原相同质量的此混合物,充分反应后,得到的固体的质量为| A.0.28g | B.0.56g | C.0.84g | D.1.12g |
您最近一年使用:0次
2023-11-15更新
|
817次组卷
|
3卷引用:陕西省西安铁一中学2023-2024学年高一上学期期末考试化学试题



