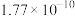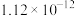1 . 纯碱是一种重要的化工原料,具有广泛的用途。实验室利用氯化钠和碳酸氢铵制备纯碱并测定产品中碳酸氢钠的含量,具体步骤如下:
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
步骤ⅱ.制备纯碱
在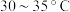 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸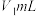 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。
已知:相关物质的溶解度如下
说明:“—”表示该物质在相应温度下已开始分解。
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为________________ ;
(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为________________ ;
(3)步骤ⅱ中,选择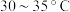 水浴的原因为
水浴的原因为________________ ;
(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为________________ ;
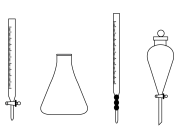
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的________ (填仪器名称);________ ;滴定过程中,盐酸需要逐滴加入并不断振荡的原因为________________ ;选择指示剂N时,滴定终点溶液颜色变化为________________ ;
(7)产品中碳酸氢钠的质量分数为________ (用含字母的代数式表示)。
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和
 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。步骤ⅱ.制备纯碱
在
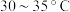 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用
 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸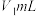 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。已知:相关物质的溶解度如下
温度 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| 15.8 | 21.0 | 27.0 | — | — | — | — |
| 8.15 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
| 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为
 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为
(3)步骤ⅱ中,选择
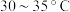 水浴的原因为
水浴的原因为(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的
(7)产品中碳酸氢钠的质量分数为
您最近一年使用:0次
2024-06-01更新
|
153次组卷
|
3卷引用:T15-实验综合题
解题方法
2 . Be是一种重要的战略性金属,以铍矿石、方解石( )为原料制备硫酸铝铵和铍的工艺流程如下:
)为原料制备硫酸铝铵和铍的工艺流程如下: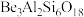 ,还含有
,还含有 ;铍玻璃体为混合物,主要成分为
;铍玻璃体为混合物,主要成分为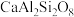 、
、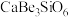 、
、 ,还含有
,还含有 和
和 .
.
(2)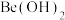 具有两性;
具有两性; 时,
时,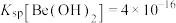 (已知:常温下,溶液中离子浓度低于
(已知:常温下,溶液中离子浓度低于 即可认为该离子被除尽);
即可认为该离子被除尽); .
.
回答下列问题:
(1)“配料熔化”时,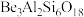 发生反应的化学方程式为
发生反应的化学方程式为________________ ;铍玻璃体属于________ (“晶体”或“非晶体”);
(2)“酸溶”时,从铍玻璃体进入到滤渣1中的元素为________ (填元素符号);
(3)“调pH”时,发生氧化还原反应的离子方程式为________________ ;
(4)“沉铍”时,需控制溶液的pH不低于________ 才能将 沉淀完全;若将氨水换成
沉淀完全;若将氨水换成 溶液也可沉铍,但需控制溶液的pH不能过高,否则会因生成
溶液也可沉铍,但需控制溶液的pH不能过高,否则会因生成________ (填化学式)导致铍的产率降低;
(5)“电解”时的工作原理如图所示,其中燃料电池负极的电极反应式为________________ ;该制铍工艺的缺点除能耗高外,还有________________ ;
 )为原料制备硫酸铝铵和铍的工艺流程如下:
)为原料制备硫酸铝铵和铍的工艺流程如下:
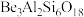 ,还含有
,还含有 ;铍玻璃体为混合物,主要成分为
;铍玻璃体为混合物,主要成分为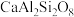 、
、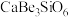 、
、 ,还含有
,还含有 和
和 .
.(2)
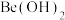 具有两性;
具有两性; 时,
时,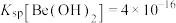 (已知:常温下,溶液中离子浓度低于
(已知:常温下,溶液中离子浓度低于 即可认为该离子被除尽);
即可认为该离子被除尽); .
.回答下列问题:
(1)“配料熔化”时,
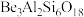 发生反应的化学方程式为
发生反应的化学方程式为(2)“酸溶”时,从铍玻璃体进入到滤渣1中的元素为
(3)“调pH”时,发生氧化还原反应的离子方程式为
(4)“沉铍”时,需控制溶液的pH不低于
 沉淀完全;若将氨水换成
沉淀完全;若将氨水换成 溶液也可沉铍,但需控制溶液的pH不能过高,否则会因生成
溶液也可沉铍,但需控制溶液的pH不能过高,否则会因生成(5)“电解”时的工作原理如图所示,其中燃料电池负极的电极反应式为

您最近一年使用:0次
2024-06-01更新
|
219次组卷
|
3卷引用:T16-工业流程题
解题方法
3 . 酯化反应可用通式表示为 。在酸性条件下,
。在酸性条件下, ,
, 。假设整个过程中无环酯生成,不出现分层现象。
。假设整个过程中无环酯生成,不出现分层现象。
将 投入反应容器中,发生如下反应:
投入反应容器中,发生如下反应:
二聚: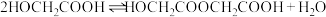
n聚: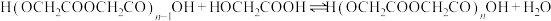
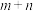 聚:
聚: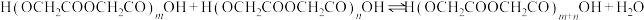 以上反应中每一步的速率常数近似认为相同,记平衡常数
以上反应中每一步的速率常数近似认为相同,记平衡常数 。
。
Ⅰ.反应平衡体系分析
(1) 按系统命名法命名为
按系统命名法命名为______ 。
(2)定义反应程度 ,其中
,其中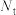 为时刻t时反应体系中-OH或者-COOH的数目,
为时刻t时反应体系中-OH或者-COOH的数目,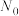 为初始反应体系中-OH或-COOH的数目。若
为初始反应体系中-OH或-COOH的数目。若 ,则
,则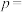
______ 。
(3)最终产物中存在多种聚合度的缩聚产物,平均聚合度 与平衡常数K的关系
与平衡常数K的关系
______ 。
(4)为了使平均聚合度增大,下列方法可行的是______ (填标号)。
A.及时移去 B.升高温度(
B.升高温度( )
)
C.提高 浓度 D.提高
浓度 D.提高 浓度
浓度
E.先将单体预聚合成低聚物,然后将低聚物进一步聚合
Ⅱ.在实际生产过程中,通常会将反应生成的水及时移去。
(5)加入少量 催化与不加入
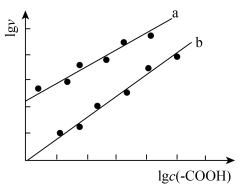
催化与不加入 催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为
催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为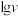 与
与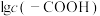 的关系]。
的关系]。
a、b两条曲线的理论斜率之比更接近______ 。 B.
B. C.
C.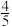 D.
D.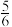
当温度升高时,b线斜率将______ (填“变大”、“变小”或“不变”)。
(6)加入少量 催化时,实验测得反应过程中平均聚合度
催化时,实验测得反应过程中平均聚合度 与反应时间t的关系为:
与反应时间t的关系为: ,其中
,其中 为反应初始时
为反应初始时 浓度,k为常数。0~t时,酯基生成的平均速率
浓度,k为常数。0~t时,酯基生成的平均速率
______ (用k、 、t表示,忽略移去水对溶液体积的影响)。
、t表示,忽略移去水对溶液体积的影响)。
 。在酸性条件下,
。在酸性条件下, ,
, 。假设整个过程中无环酯生成,不出现分层现象。
。假设整个过程中无环酯生成,不出现分层现象。将
 投入反应容器中,发生如下反应:
投入反应容器中,发生如下反应:二聚:
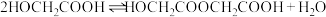
n聚:
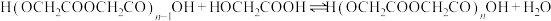
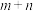 聚:
聚: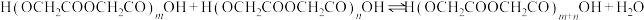 以上反应中每一步的速率常数近似认为相同,记平衡常数
以上反应中每一步的速率常数近似认为相同,记平衡常数 。
。Ⅰ.反应平衡体系分析
(1)
 按系统命名法命名为
按系统命名法命名为(2)定义反应程度
 ,其中
,其中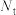 为时刻t时反应体系中-OH或者-COOH的数目,
为时刻t时反应体系中-OH或者-COOH的数目,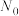 为初始反应体系中-OH或-COOH的数目。若
为初始反应体系中-OH或-COOH的数目。若 ,则
,则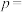
(3)最终产物中存在多种聚合度的缩聚产物,平均聚合度
 与平衡常数K的关系
与平衡常数K的关系
(4)为了使平均聚合度增大,下列方法可行的是
A.及时移去
 B.升高温度(
B.升高温度( )
)C.提高
 浓度 D.提高
浓度 D.提高 浓度
浓度E.先将单体预聚合成低聚物,然后将低聚物进一步聚合
Ⅱ.在实际生产过程中,通常会将反应生成的水及时移去。
(5)加入少量
 催化与不加入
催化与不加入 催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为
催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为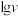 与
与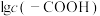 的关系]。
的关系]。a、b两条曲线的理论斜率之比更接近
 B.
B. C.
C.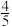 D.
D.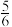
当温度升高时,b线斜率将
(6)加入少量
 催化时,实验测得反应过程中平均聚合度
催化时,实验测得反应过程中平均聚合度 与反应时间t的关系为:
与反应时间t的关系为: ,其中
,其中 为反应初始时
为反应初始时 浓度,k为常数。0~t时,酯基生成的平均速率
浓度,k为常数。0~t时,酯基生成的平均速率
 、t表示,忽略移去水对溶液体积的影响)。
、t表示,忽略移去水对溶液体积的影响)。
您最近一年使用:0次
解题方法
4 .  是生产金属钛及其化合物的重要中间体,常温下为液体且有毒,暴露在空气中会发烟,极易水解。模拟工业上以
是生产金属钛及其化合物的重要中间体,常温下为液体且有毒,暴露在空气中会发烟,极易水解。模拟工业上以 、木炭和
、木炭和 为原料制备
为原料制备 的装置如图(夹持装置略)。
的装置如图(夹持装置略)。 的制备
的制备
(ⅰ)连接仪器,检验装置的气密性,盛装药品;(ⅱ)打开 ,……(ⅲ)打开
,……(ⅲ)打开 ,加入适量浓盐酸,接通冷凝装置,加热管式炉开始反应。回答下列问题:
,加入适量浓盐酸,接通冷凝装置,加热管式炉开始反应。回答下列问题:
(1)操作(ⅱ)的后续操作为________________ 。
(2)装置D的产物均为有毒化合物,则该反应的化学方程式为________________ ;判断该反应结束的实验现象是________________ 。
(3)A中反应结束后,再通入适量 的目的是
的目的是________________ ;图示装置存在的两处缺陷是________________ 。
Ⅱ. 含量的测定
含量的测定
将m g样品的水解液配成 溶液,取
溶液,取 于锥形瓶中,滴加2~3滴
于锥形瓶中,滴加2~3滴 溶液为指示剂,用
溶液为指示剂,用 的
的 标准溶液滴定至终点,消耗溶液
标准溶液滴定至终点,消耗溶液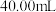 。
。
已知:
(4)该产品纯度为________ 。
(5)下列实验操作会导致产品纯度测定结果偏低的有________(填字母)。
 是生产金属钛及其化合物的重要中间体,常温下为液体且有毒,暴露在空气中会发烟,极易水解。模拟工业上以
是生产金属钛及其化合物的重要中间体,常温下为液体且有毒,暴露在空气中会发烟,极易水解。模拟工业上以 、木炭和
、木炭和 为原料制备
为原料制备 的装置如图(夹持装置略)。
的装置如图(夹持装置略)。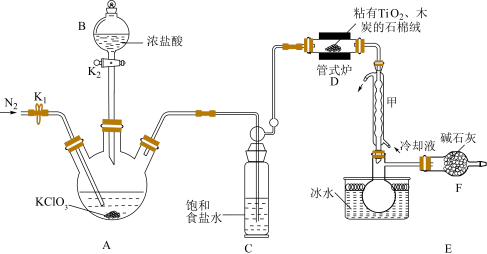
 的制备
的制备(ⅰ)连接仪器,检验装置的气密性,盛装药品;(ⅱ)打开
 ,……(ⅲ)打开
,……(ⅲ)打开 ,加入适量浓盐酸,接通冷凝装置,加热管式炉开始反应。回答下列问题:
,加入适量浓盐酸,接通冷凝装置,加热管式炉开始反应。回答下列问题:(1)操作(ⅱ)的后续操作为
(2)装置D的产物均为有毒化合物,则该反应的化学方程式为
(3)A中反应结束后,再通入适量
 的目的是
的目的是Ⅱ.
 含量的测定
含量的测定将m g样品的水解液配成
 溶液,取
溶液,取 于锥形瓶中,滴加2~3滴
于锥形瓶中,滴加2~3滴 溶液为指示剂,用
溶液为指示剂,用 的
的 标准溶液滴定至终点,消耗溶液
标准溶液滴定至终点,消耗溶液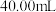 。
。已知:
难溶物 |
|
|
颜色 | 白 | 砖红 |
|
|
|
(4)该产品纯度为
(5)下列实验操作会导致产品纯度测定结果偏低的有________(填字母)。
| A.用待测液润洗锥形瓶 | B.样品暴露在空气中时间较长 |
| C.滴定终点时仰视读数 | D.滴加指示剂的量过多 |
您最近一年使用:0次
5 . 丙烯是一种重要的化工原料。利用丙烷脱氢制备丙烯的原理为:
直接脱氢: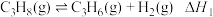
回答下列问题:
(1)各化学键的键能如表所示,则
__________  。
。
(2)计算机模拟直接脱氢的反应历程如图所示:__________ (填“>”“<”或“=”)第二步。
②依据该历程图推测丙烷脱氢可能会产生的副产物为__________ (填分子式)。
(3)一种提高丙烷转化率的催化剂—膜系统,能让部分氢气透过膜后与反应体系分离,其工作原理如图所示:__________ 。
②在T、p0条件下, 丙烷通入无膜反应器,丙烷的平衡转化率为
丙烷通入无膜反应器,丙烷的平衡转化率为 ,该反应的压强平衡常数Kp=
,该反应的压强平衡常数Kp=__________ ;在相同条件下,若换成如图所示有膜反应器,丙烷的平衡转化率为 ,则相同时间内出口
,则相同时间内出口 和出口
和出口 的氢气质量之比为
的氢气质量之比为__________ 。
(4)丙烯还可通过丙烷氧化脱氢的方法制备,其原理为:
氧化脱氢: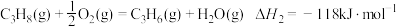
相比直接脱氢,氧化脱氢制备丙烯的优点为__________ ,缺点为__________ (各写1点即可)。
直接脱氢:
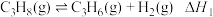
回答下列问题:
(1)各化学键的键能如表所示,则

 。
。| 化学键 | C-H | C-C(π键) | H-H |
键能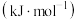 | 413 | 271 | 436 |
(2)计算机模拟直接脱氢的反应历程如图所示:
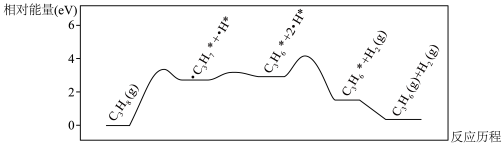
②依据该历程图推测丙烷脱氢可能会产生的副产物为
(3)一种提高丙烷转化率的催化剂—膜系统,能让部分氢气透过膜后与反应体系分离,其工作原理如图所示:
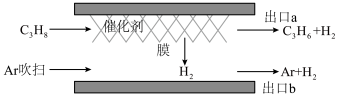
②在T、p0条件下,
 丙烷通入无膜反应器,丙烷的平衡转化率为
丙烷通入无膜反应器,丙烷的平衡转化率为 ,该反应的压强平衡常数Kp=
,该反应的压强平衡常数Kp= ,则相同时间内出口
,则相同时间内出口 和出口
和出口 的氢气质量之比为
的氢气质量之比为(4)丙烯还可通过丙烷氧化脱氢的方法制备,其原理为:
氧化脱氢:
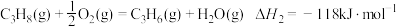
相比直接脱氢,氧化脱氢制备丙烯的优点为
您最近一年使用:0次
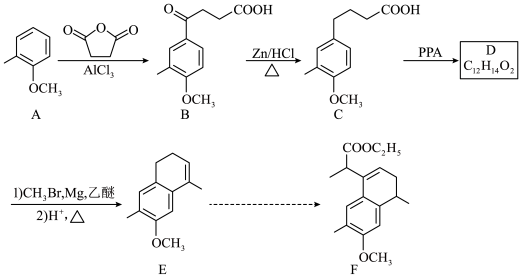
6 . 化合物F是合成药物的重要中间体,其合成路线如图所示。
(1)B→C的反应类型是__________ 。
(2)C中官能团的名称是__________ 。
(3)D的结构简式为__________ 。
(4)F中有__________ 个手性碳原子。
(5)A的同分异构体中,遇 溶液显色的共有
溶液显色的共有__________ 种。
(6)以苯、乙烯和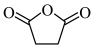 为含碳原料,利用上述原理,合成化合物
为含碳原料,利用上述原理,合成化合物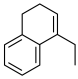 。
。
①相关步骤涉及到烯烃制卤代烃的反应,其化学方程式为__________ 。
②最后一步转化中与卤代烃反应的有机物的结构简式为__________ 。
已知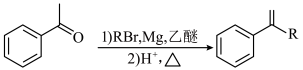
(1)B→C的反应类型是
(2)C中官能团的名称是
(3)D的结构简式为
(4)F中有
(5)A的同分异构体中,遇
 溶液显色的共有
溶液显色的共有(6)以苯、乙烯和
 为含碳原料,利用上述原理,合成化合物
为含碳原料,利用上述原理,合成化合物 。
。①相关步骤涉及到烯烃制卤代烃的反应,其化学方程式为
②最后一步转化中与卤代烃反应的有机物的结构简式为
您最近一年使用:0次
解题方法
7 . 尼拉帕尼(J)是一种安全高效抗癌药,根据该药物的两条合成路线,回答下列问题。
已知:______ 。
(2)C→D的反应类型是______ 。D→E引入Boc基团的作用为______ 。
(3)符合下列条件的D的同分异构体有______ 种。
①有一个含两个氮原子的六元环,且两个氮原子处于对位
②有一个苯环和一个甲基 ③仅有一个碳原子不参与成环
(4)H→I反应的化学方程式为______ 。
路线二:______ 。L的分子式为______ 。
(6)N→I反应的化学方程式为______ 。
已知:


(2)C→D的反应类型是
(3)符合下列条件的D的同分异构体有
①有一个含两个氮原子的六元环,且两个氮原子处于对位
②有一个苯环和一个甲基 ③仅有一个碳原子不参与成环
(4)H→I反应的化学方程式为
路线二:

(6)N→I反应的化学方程式为
您最近一年使用:0次
名校
解题方法
8 . 锂离子电池作为重要储能设备在手机、汽车等行业得到了大规模应用。一种基于微波辅助低共熔溶剂的回收方法可实现对废旧锂离子电池中 的回收利用,其主要工艺流程如下:
的回收利用,其主要工艺流程如下: 在溶液中常以
在溶液中常以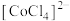 (蓝色)和
(蓝色)和 (粉红色)形式存在;
(粉红色)形式存在;
②25℃时,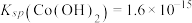 。
。
回答下列问题:
(1) 中Co的化合价为
中Co的化合价为___________ 。
(2)微波具有选择性加热和穿透性强的特点,采用微波共熔技术的优点除了可以减少杂质溶解还有___________ 。
(3)低共熔溶剂中含有一定量的草酸,其作用为___________ ;已知在水浸过程中溶液由蓝色变为粉红色,写出该变化的离子反应方程式___________ 。
(4)25℃时,沉钴反应完成后,溶液的pH=10,此时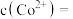
___________ mg/L。
(5)滤饼1在空气中煅烧得 ,写出该反应的化学反应方程式
,写出该反应的化学反应方程式___________ 。
(6)高温烧结过程中需通入空气,该反应中氧化剂与还原剂物质的量之比为___________ ,若通入空气过多过快,造成的不利影响是___________ 。
 的回收利用,其主要工艺流程如下:
的回收利用,其主要工艺流程如下: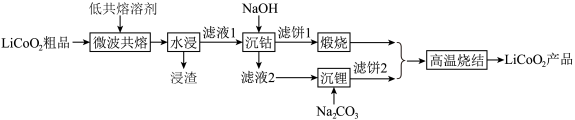
 在溶液中常以
在溶液中常以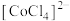 (蓝色)和
(蓝色)和 (粉红色)形式存在;
(粉红色)形式存在;②25℃时,
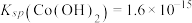 。
。回答下列问题:
(1)
 中Co的化合价为
中Co的化合价为(2)微波具有选择性加热和穿透性强的特点,采用微波共熔技术的优点除了可以减少杂质溶解还有
(3)低共熔溶剂中含有一定量的草酸,其作用为
(4)25℃时,沉钴反应完成后,溶液的pH=10,此时
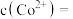
(5)滤饼1在空气中煅烧得
 ,写出该反应的化学反应方程式
,写出该反应的化学反应方程式(6)高温烧结过程中需通入空气,该反应中氧化剂与还原剂物质的量之比为
您最近一年使用:0次
解题方法
9 . 乙酸相对乙醇廉价易得,乙酸催化加氢制乙醇的反应如下:
主反应: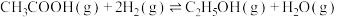

副反应: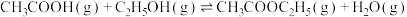

已知:Ⅰ.该副反应的热效应很小;
Ⅱ.S表示产物选择性,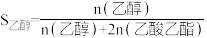 ,
,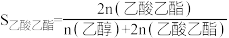
回答下列问题:
(1)一定温度下,将1mol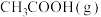 、2mol
、2mol 通入恒压密闭容器中(不考虑副反应)。达到平衡时
通入恒压密闭容器中(不考虑副反应)。达到平衡时 的转化率为10%,该反应放热QkJ,则
的转化率为10%,该反应放热QkJ,则
_______  。
。
(2)在恒温、恒压下,原料气通过某催化剂发生上述反应,投料比对反应的影响如图甲所示。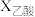 表示乙酸的转化率,最佳投料比
表示乙酸的转化率,最佳投料比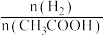 为
为_______ 。当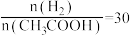 时,
时, 曲线可延伸至E、F、G中的
曲线可延伸至E、F、G中的_______ 点;投料比=20时, 的转化率=
的转化率=_______ 。
(3)当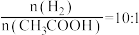 时在不同条件下达到平衡。在
时在不同条件下达到平衡。在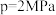 下的
下的 、
、 ~t在
~t在 下的
下的 、
、 ~p如图乙所示:
~p如图乙所示: 随t变化的曲线是
随t变化的曲线是_______ (填标号),曲线 变化的原因是
变化的原因是_______ 。A、B、C三点对应的 的转化率由大到小的顺序为
的转化率由大到小的顺序为_______ 。已知B点时对应 的转化率为
的转化率为 ,则B点时副反应的平衡常数
,则B点时副反应的平衡常数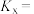
_______ 。150℃, 和
和 反应一段时间后,
反应一段时间后, 的选择性位于M点,不改变反应时间和温度,一定能提高
的选择性位于M点,不改变反应时间和温度,一定能提高 选择性的措施为
选择性的措施为_______ (填一条即可)。
主反应:
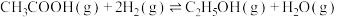

副反应:
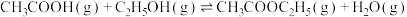

已知:Ⅰ.该副反应的热效应很小;
Ⅱ.S表示产物选择性,
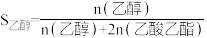 ,
,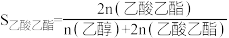
回答下列问题:
(1)一定温度下,将1mol
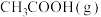 、2mol
、2mol 通入恒压密闭容器中(不考虑副反应)。达到平衡时
通入恒压密闭容器中(不考虑副反应)。达到平衡时 的转化率为10%,该反应放热QkJ,则
的转化率为10%,该反应放热QkJ,则
 。
。(2)在恒温、恒压下,原料气通过某催化剂发生上述反应,投料比对反应的影响如图甲所示。
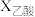 表示乙酸的转化率,最佳投料比
表示乙酸的转化率,最佳投料比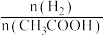 为
为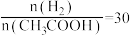 时,
时, 曲线可延伸至E、F、G中的
曲线可延伸至E、F、G中的 的转化率=
的转化率=(3)当
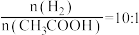 时在不同条件下达到平衡。在
时在不同条件下达到平衡。在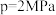 下的
下的 、
、 ~t在
~t在 下的
下的 、
、 ~p如图乙所示:
~p如图乙所示: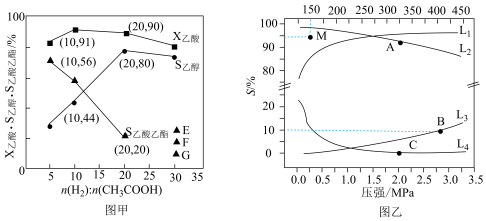
 随t变化的曲线是
随t变化的曲线是 变化的原因是
变化的原因是 的转化率由大到小的顺序为
的转化率由大到小的顺序为 的转化率为
的转化率为 ,则B点时副反应的平衡常数
,则B点时副反应的平衡常数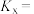
 和
和 反应一段时间后,
反应一段时间后, 的选择性位于M点,不改变反应时间和温度,一定能提高
的选择性位于M点,不改变反应时间和温度,一定能提高 选择性的措施为
选择性的措施为
您最近一年使用:0次
解题方法
10 . 据国际权威学术期刊《自然》报道,我国科学家选择碲化锆( )和砷化镉(
)和砷化镉( )为材料验证了三维量子霍尔效应。
)为材料验证了三维量子霍尔效应。
(1)Zr与Ti同族且在Ti的下一周期。Zr位于元素周期表的第_______ 周期,第_______ 族。
(2)Te是第五周期的氧族元素,推测它可能具有的性质是_______ (填序号)。
a.室温下单质为固体
b.单质具有半导体性能
c.单质在常温下可与氢气化合
d.最高价氧化物的水化物的酸性比硫酸强
(3) 与
与 可形成离子
可形成离子 。
。
① 中存在
中存在_______ (填序号)。
a.氢键 b.σ键 c.π键 d.配位键
②已知该离子中2个 被2个
被2个 替代只得到一种结构,则该离子的空间结构为
替代只得到一种结构,则该离子的空间结构为_______ 。
(4)某种掺杂CaO的 晶胞如图所示,Ca位于晶胞的面心。
晶胞如图所示,Ca位于晶胞的面心。_______ 个。
②已知该晶胞为立方晶胞,晶胞棱长为apm,设阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为_______ 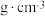 。
。
(5)若锆石中含Zr元素的质量分数是36.4%,在制备 的过程中会损失10%的锆元素,则1kg锆石理论上能够制得
的过程中会损失10%的锆元素,则1kg锆石理论上能够制得 的质量是
的质量是_______ g。
 )和砷化镉(
)和砷化镉( )为材料验证了三维量子霍尔效应。
)为材料验证了三维量子霍尔效应。(1)Zr与Ti同族且在Ti的下一周期。Zr位于元素周期表的第
(2)Te是第五周期的氧族元素,推测它可能具有的性质是
a.室温下单质为固体
b.单质具有半导体性能
c.单质在常温下可与氢气化合
d.最高价氧化物的水化物的酸性比硫酸强
(3)
 与
与 可形成离子
可形成离子 。
。①
 中存在
中存在a.氢键 b.σ键 c.π键 d.配位键
②已知该离子中2个
 被2个
被2个 替代只得到一种结构,则该离子的空间结构为
替代只得到一种结构,则该离子的空间结构为(4)某种掺杂CaO的
 晶胞如图所示,Ca位于晶胞的面心。
晶胞如图所示,Ca位于晶胞的面心。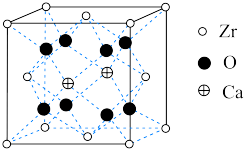
②已知该晶胞为立方晶胞,晶胞棱长为apm,设阿伏加德罗常数的值为
 ,则该晶体的密度为
,则该晶体的密度为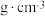 。
。(5)若锆石中含Zr元素的质量分数是36.4%,在制备
 的过程中会损失10%的锆元素,则1kg锆石理论上能够制得
的过程中会损失10%的锆元素,则1kg锆石理论上能够制得 的质量是
的质量是
您最近一年使用:0次