名校
1 . 下列说法正确的是
| A.某非金属元素从化合态变为游离态时,该非金属元素一定被氧化 |
| B.有单质参加、生成的反应一定是氧化还原反应 |
| C.高效火箭推进剂N(NO2)3既有氧化性又有还原性 |
| D.失电子的反应物在反应中作还原剂,反应中被还原 |
您最近一年使用:0次
名校
2 . 下列有关硫及其化合物的说法不正确的是
| A.硫单质与足量热的强碱溶液反应时氧化剂与还原剂物质的量之比为2∶1 |
| B.铜片溶于热的浓硫酸,体现了浓硫酸的酸性和强氧化性 |
C.向溶液中滴加酸化的 溶液出现白色沉淀,不能说明该溶液中一定有 溶液出现白色沉淀,不能说明该溶液中一定有 |
D. 气体通入 气体通入 溶液中产生 溶液中产生 白色沉淀 白色沉淀 |
您最近一年使用:0次
名校
解题方法
3 . 草酸亚铁晶体( ,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
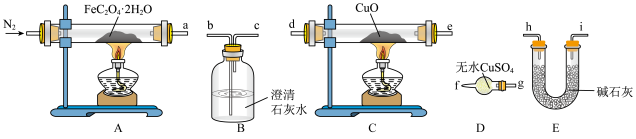
I.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:
①装置D的名称为___________ 。
②按照气流从左到右的方向,上述装置的连接顺序为___________ →尾气处理装置(填仪器接口的字母编号)。
③实验前先通入一段时间 ,其目的为
,其目的为___________ 。
④实验证明气体产物中含有CO,依据的实验现象为___________ 。
(2)固体产物成分的探究。充分反应后,A处以应管中残留黑色固体。查阅资料可知,黑色固体可能为Fe或FeO。小组成员设计实验证明了其成分只有FeO,其操作及现象为___________ 。
(3)依据(1)和(2)中结论,可知A处反应管中发生反应的化学方程式为___________ 。
II.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有 杂质,测定其纯度的步骤如下:
杂质,测定其纯度的步骤如下:
步骤1:称取m g草酸亚铁晶体样品并溶于稀 中,配成250mL溶液;
中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用c
 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液 mL;
mL;
步骡3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀 ,再用c
,再用c
 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 mL。
mL。
(4)步骤3中加入锌粉的目的为___________ 。
(5)草酸亚铁晶体样品的纯度为___________ (列出计算式即可,不必化简);
若步骤1配制溶液时部分 被氧化,则测定结果将
被氧化,则测定结果将___________ (填“偏高”“偏低”或“不变”)。
 ,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:
①装置D的名称为
②按照气流从左到右的方向,上述装置的连接顺序为
③实验前先通入一段时间
 ,其目的为
,其目的为④实验证明气体产物中含有CO,依据的实验现象为
(2)固体产物成分的探究。充分反应后,A处以应管中残留黑色固体。查阅资料可知,黑色固体可能为Fe或FeO。小组成员设计实验证明了其成分只有FeO,其操作及现象为
(3)依据(1)和(2)中结论,可知A处反应管中发生反应的化学方程式为
II.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有
 杂质,测定其纯度的步骤如下:
杂质,测定其纯度的步骤如下:步骤1:称取m g草酸亚铁晶体样品并溶于稀
 中,配成250mL溶液;
中,配成250mL溶液;步骤2:取上述溶液25.00mL,用c

 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液 mL;
mL;步骡3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀
 ,再用c
,再用c
 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 mL。
mL。(4)步骤3中加入锌粉的目的为
(5)草酸亚铁晶体样品的纯度为
若步骤1配制溶液时部分
 被氧化,则测定结果将
被氧化,则测定结果将
您最近一年使用:0次
解题方法
4 . 易混易错题组:离子方程式的书写
(1)量变引起离子方程式的变化
将少量NaHSO4溶液滴加到Ba(OH)2溶液中,当恰好沉淀时,反应的离子方程式为______________ 。
向Ca(HCO3)2溶液中滴加过量NaOH溶液,反应的离子方程式__________________ 。
(学法题)书写此类离子方程式的关键是,抓住______________ 量物质。
(2)反应顺序引起的变化
向NH4HCO3溶液中,滴加过量的NaOH溶液,反应的离子方程式为___________________ 。
在FeI2溶液中,滴加少量稀硝酸。该反应的离子方程式是:____________ 。
(学法题)书写此类离子方程式的关键是,抓住反应物中离子的__________ 顺序。
(3)反应介质的影响
①在酸性条件下,向含铬废水中加入FeSO4,可将 还原为Cr3+,该过程的离子反应方程式为
还原为Cr3+,该过程的离子反应方程式为_________________ 。
②在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,离子方程式为___________________________ 。
③在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,离子方程式是_______________ 。
④对比②和③实验所得的结果,将I2、ClO-、 按氧化性由强到弱的顺序排列为
按氧化性由强到弱的顺序排列为___________ 。
(1)量变引起离子方程式的变化
将少量NaHSO4溶液滴加到Ba(OH)2溶液中,当恰好沉淀时,反应的离子方程式为
向Ca(HCO3)2溶液中滴加过量NaOH溶液,反应的离子方程式
(学法题)书写此类离子方程式的关键是,抓住
(2)反应顺序引起的变化
向NH4HCO3溶液中,滴加过量的NaOH溶液,反应的离子方程式为
在FeI2溶液中,滴加少量稀硝酸。该反应的离子方程式是:
(学法题)书写此类离子方程式的关键是,抓住反应物中离子的
(3)反应介质的影响
①在酸性条件下,向含铬废水中加入FeSO4,可将
 还原为Cr3+,该过程的离子反应方程式为
还原为Cr3+,该过程的离子反应方程式为②在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,离子方程式为
③在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,离子方程式是
④对比②和③实验所得的结果,将I2、ClO-、
 按氧化性由强到弱的顺序排列为
按氧化性由强到弱的顺序排列为
您最近一年使用:0次
名校
5 . 下列叙述正确的是
A.还原性: | B.第一电离能: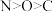 |
C.碱性: | D.熔点:晶体硅>碳化硅 |
您最近一年使用:0次
2021-01-19更新
|
327次组卷
|
4卷引用:天津经济技术开发区第一中学2023-2024学年高三上学期开学检测化学试题
名校
解题方法
6 . 铁及其化合物在生产生活中有重要应用。
Ⅰ.高铁酸钾(K2FeO4)是一种新型的污水处理剂。
(1)K2FeO4的制备:

①ⅰ中反应的离子方程式是___________
②将ⅱ中反应的离子方程式补充完整:

___________
③ⅲ中反应说明溶解度:
___________  (填“>”或“<”)。
(填“>”或“<”)。
(2)K2FeO4的性质:
ⅰ.将K2FeO4固体溶于蒸馏水中,有少量无色气泡产生,经检验为O2,液体有丁达尔效应。
ⅱ.将K2FeO4固体溶于浓KOH溶液中,放置2小时无明显变化。
ⅲ.将K2FeO4固体溶于硫酸中,产生无色气泡的速率明显比ⅰ快。
①K2FeO4溶于蒸馏水的化学反应方程式是___________ 。
②K2FcO4的氧化性与溶液pH的关系是___________ 。
(3)K2FeO4的应用。K2FeO4可用于生活垃圾渗透液的脱氮(将含氮物质转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如下:

K2FeO4脱氮的最佳pH是___________ 。
Ⅱ.请回答:
(4)Fe、Co、Ni能与Cl2反应,其中Co和为Ni均生成二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为___________ 。Co(OH)3与盐酸反应有黄绿色气体生成,写出反应的离子方程式:___________ 。
Ⅰ.高铁酸钾(K2FeO4)是一种新型的污水处理剂。
(1)K2FeO4的制备:

①ⅰ中反应的离子方程式是
②将ⅱ中反应的离子方程式补充完整:

③ⅲ中反应说明溶解度:

 (填“>”或“<”)。
(填“>”或“<”)。(2)K2FeO4的性质:
ⅰ.将K2FeO4固体溶于蒸馏水中,有少量无色气泡产生,经检验为O2,液体有丁达尔效应。
ⅱ.将K2FeO4固体溶于浓KOH溶液中,放置2小时无明显变化。
ⅲ.将K2FeO4固体溶于硫酸中,产生无色气泡的速率明显比ⅰ快。
①K2FeO4溶于蒸馏水的化学反应方程式是
②K2FcO4的氧化性与溶液pH的关系是
(3)K2FeO4的应用。K2FeO4可用于生活垃圾渗透液的脱氮(将含氮物质转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如下:

K2FeO4脱氮的最佳pH是
Ⅱ.请回答:
(4)Fe、Co、Ni能与Cl2反应,其中Co和为Ni均生成二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为
您最近一年使用:0次
名校
7 . 已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是
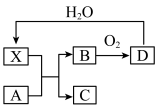
| A.X使蔗糖变黑的现象主要体现了X的强氧化性 |
| B.若A为铁,则足量A与X在室温下即可完全反应 |
| C.若A为碳单质,则将C通入少量的澄清石灰水中,最后有白色沉淀产生 |
| D.工业上,B转化为D的反应条件为加热、使用催化剂 |
您最近一年使用:0次
2023-03-07更新
|
482次组卷
|
5卷引用:天津市武清区杨村一中2023-2024学年高三上学期开学检测化学试题
名校
8 . 下列各组性质比较中,不正确的是
A.离子还原性: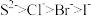 | B.热稳定性: |
C.离子半径: | D.酸性: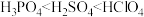 |
您最近一年使用:0次
2021-03-04更新
|
191次组卷
|
2卷引用:天津市第二中学2020-2021学年高一下学期2月开学考试化学试题
名校
解题方法
9 . 下列各组性质比较中,正确的是( )
①沸点:HF>HCl>HBr>HI ②离子还原性:S2->Cl->Br->I- ③酸性:HClO4>HBrO4>HIO4
④金属性:K>Na>Mg>Al ⑤气态氢化物稳定性:HF>HCl>H2S ⑥半径:O2->F->Na+>Mg2+
①沸点:HF>HCl>HBr>HI ②离子还原性:S2->Cl->Br->I- ③酸性:HClO4>HBrO4>HIO4
④金属性:K>Na>Mg>Al ⑤气态氢化物稳定性:HF>HCl>H2S ⑥半径:O2->F->Na+>Mg2+
| A.③④⑤⑥ | B.①②③ | C.②③④ | D.①③④⑤⑥ |
您最近一年使用:0次
2020-05-12更新
|
289次组卷
|
28卷引用:天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题
天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题天津滨海新区2020届高三4月份统考化学试题2016-2017学年河北省邯郸市成安县第一中学高一下学期第一次月考化学试卷安徽省淮北市第一中学2016-2017学年高二下学期期中考试化学试题陕西省西安中学2016-2017学年高一(实验班)下学期期中考试化学试题河南省林州一中分校(林虑中学)2017-2018学年高一4月调研考试化学试题【全国百强校】浙江省余姚中学2018-2019学年高一下学期3月月考化学试题湖北省襄阳市东风中学2018-2019学年高一下学期3月月考化学试题【全国百强校】安徽省黄山市屯溪第一中学2018-2019学年高一下学期期中考试化学试题【全国百强校】安徽省铜陵市第一中学2018-2019学年高一5月月考化学试题内蒙古北京八中乌兰察布分校2018-2019学年高一下学期期中考试化学试题河北省秦皇岛市六校2020届高三上学期期初检测联考化学试题湖北名师联盟(人教版)2019-2020学年高三上学期第二次月考精编仿真金卷化学试题辽宁省大连市第三中学2019-2020学年高三上学期第三次月考化学试题辽宁省锦州市滨海实验中学2019-2020学年高一上学期期末考试化学试题(2019新人教版)人教版高一化学必修2同步练习:第一章第二节第一课时《元素周期律》江苏省南通市如皋市白蒲高级中学2019-2020学年高二下学期第一周测试化学试题山东省临朐县实验中学2020年高一下学期第一次月结学情考试化学试题山东省济南外国语学校2019-2020学年高一3月份月考化学试题江苏省宿迁市宿豫中学2019-2020学年高一下学期四月调研试(奥赛班)化学试题四川省仁寿县文宫中学2019-2020学年高一5月月考化学试题(已下线)【南昌新东方】2020 新建二中 高一(下) 第一次月考 005新疆维吾尔自治区喀什第二中学2019-2020学年高一4月月考化学试题(已下线)【南昌新东方】2019-2020 雷氏中学 高一下 周练江西省抚州市2020-2021学年高一下学期期末考试化学试题内蒙古包头市第四中学2020-2021学年高一下学期4月月考化学试题广西贺州市钟山县钟山中学2020-2021学年高一下学期第一次月考理科化学试题河北省邢台市第二中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
10 . Fe、Co、Ni是三种重要的金属元素。回答下列问题:
(1)Ni在周期表中的位置为______ ,基态Fe2+原子的电子排布式为______ 。
(2)CoO的面心立方晶胞如图所示。设阿伏加德罗常数的值为NA,则CoO晶体的密度为______ g·cm−3。三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为______ 。

(3)Fe、Co、Ni能与Cl2反应,其中Co和Ni均生成二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为______ ,Co(OH)3与盐酸反应有黄绿色气体生成,写出反应的离子方程式:_____ 。
(4)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,则第一种配合物的化学式为______ ,如果在第二种配合物溶液中滴加AgNO3溶液时,产生______ 现象。
(1)Ni在周期表中的位置为
(2)CoO的面心立方晶胞如图所示。设阿伏加德罗常数的值为NA,则CoO晶体的密度为

(3)Fe、Co、Ni能与Cl2反应,其中Co和Ni均生成二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为
(4)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,则第一种配合物的化学式为
您最近一年使用:0次



