1 . 高铁酸钾( )是一种新型、高效、多功能水处理剂,且不会造成二次污染。
)是一种新型、高效、多功能水处理剂,且不会造成二次污染。
查阅资料:
① 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
② 与
与 溶液在20℃以下反应生成
溶液在20℃以下反应生成 ,在较高温度下则生成
,在较高温度下则生成 。
。
(1)实验室常利用氯气制备 后与
后与 、
、 反应制备
反应制备 。根据下列仪器,请你组装合理、简洁的实验装置,所用装置的接口连接顺序是
。根据下列仪器,请你组装合理、简洁的实验装置,所用装置的接口连接顺序是________ 。
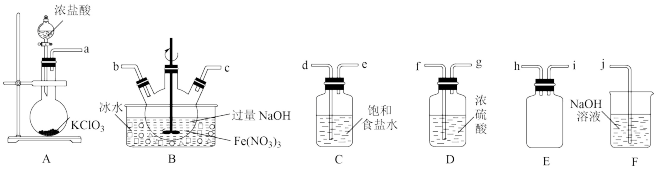
(2)写出装置A中发生反应的离子方程式________ 。
(3)三颈烧瓶用冰水浴的原因是________ ,A处盛放 的仪器名称是
的仪器名称是________ 。
(4)将实验得到的 再加入饱和
再加入饱和 溶液中,可析出紫黑色的
溶液中,可析出紫黑色的 粗晶体,其原因是
粗晶体,其原因是________ 。
(5)用滴定法测定所制粗 的纯度(杂质与
的纯度(杂质与 不反应):取
不反应):取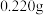 粗
粗 样品,加入足量硫酸酸化的
样品,加入足量硫酸酸化的 溶液,充分反应后,用
溶液,充分反应后,用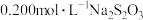 标准溶液滴定生成的I2,滴定消耗标准溶液的体积为
标准溶液滴定生成的I2,滴定消耗标准溶液的体积为 。涉及的反应有:
。涉及的反应有: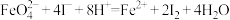 ,
, 。
。
①滴定时选用的指示剂是________ ,滴定终点的现象是________ 。
②制得粗 的纯度是
的纯度是________ 。
 )是一种新型、高效、多功能水处理剂,且不会造成二次污染。
)是一种新型、高效、多功能水处理剂,且不会造成二次污染。查阅资料:
①
 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。②
 与
与 溶液在20℃以下反应生成
溶液在20℃以下反应生成 ,在较高温度下则生成
,在较高温度下则生成 。
。(1)实验室常利用氯气制备
 后与
后与 、
、 反应制备
反应制备 。根据下列仪器,请你组装合理、简洁的实验装置,所用装置的接口连接顺序是
。根据下列仪器,请你组装合理、简洁的实验装置,所用装置的接口连接顺序是
(2)写出装置A中发生反应的离子方程式
(3)三颈烧瓶用冰水浴的原因是
 的仪器名称是
的仪器名称是(4)将实验得到的
 再加入饱和
再加入饱和 溶液中,可析出紫黑色的
溶液中,可析出紫黑色的 粗晶体,其原因是
粗晶体,其原因是(5)用滴定法测定所制粗
 的纯度(杂质与
的纯度(杂质与 不反应):取
不反应):取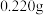 粗
粗 样品,加入足量硫酸酸化的
样品,加入足量硫酸酸化的 溶液,充分反应后,用
溶液,充分反应后,用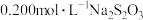 标准溶液滴定生成的I2,滴定消耗标准溶液的体积为
标准溶液滴定生成的I2,滴定消耗标准溶液的体积为 。涉及的反应有:
。涉及的反应有: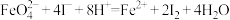 ,
, 。
。①滴定时选用的指示剂是
②制得粗
 的纯度是
的纯度是
您最近一年使用:0次
2020-07-10更新
|
243次组卷
|
2卷引用:西藏拉萨市2020届高三第二次模拟考试理科综合化学试题
2 . 二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
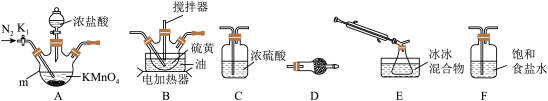
①仪器m的名称为___ ,装置F中试剂的作用是___ 。
②装置连接顺序:A→___ →E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___ 。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___ 。
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___ 。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案___ (填“可行”或“不可行”),原因是___ 。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:
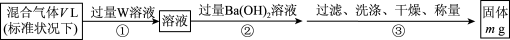
①W溶液可以是___ (填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为____ (用含V、m的式子表示)。
| 物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
| 剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
| 化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2  2SCl2; 2SCl2;③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。

①仪器m的名称为
②装置连接顺序:A→
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是
④为了提高S2Cl2的纯度,实验的关键是控制好温度和
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:
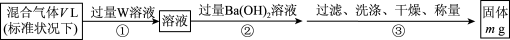
①W溶液可以是
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为
您最近一年使用:0次
2019-12-10更新
|
578次组卷
|
7卷引用:西藏山南市第二高级中学2020届高三第三次模拟考试理综化学试题
名校
解题方法
3 . 葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6 2CH3CH2OH+2CO2↑)。
2CH3CH2OH+2CO2↑)。
Ⅰ.已知:实验室制乙烯原理为CH3CH2OH CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
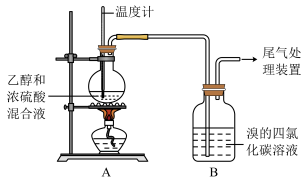
(1)溶液“渐渐变黑”,说明浓硫酸具有___ 性。
(2)对产生的气体进行分析,甲认为是C2H4,乙认为不能排除SO2的作用。
①写出实验室制取SO2的化学反应方程式是___ ;
②乙根据现象认为实验中产生的SO2和___ ,使B中有色物质反应褪色。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色。
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)

现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色。
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是___ ;乙设计的实验D中盛放的试剂是___ ,装置连接顺序为___ (用仪器接口字母编号)。
b.能说明确实是SO2使E中溶液褪色的实验是___ 。
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是___ 。由此可得出的干燥的SO2不能使Br2的四氯化碳溶液褪色。
Ⅱ.葡萄酒中常用Na2S2O5做抗氧化剂。
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。写出Na2S2O5溶于水时溶液中离子浓度由大到小的排列顺序___ 。
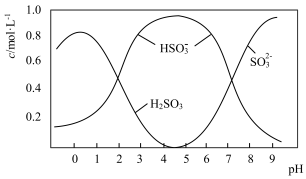
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤___ mol·L-1。
 2CH3CH2OH+2CO2↑)。
2CH3CH2OH+2CO2↑)。Ⅰ.已知:实验室制乙烯原理为CH3CH2OH
 CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
| 操作 | 现象 |
| 点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| …… | |
| 实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(2)对产生的气体进行分析,甲认为是C2H4,乙认为不能排除SO2的作用。
①写出实验室制取SO2的化学反应方程式是
②乙根据现象认为实验中产生的SO2和
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色。
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)

现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色。
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是
b.能说明确实是SO2使E中溶液褪色的实验是
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是
Ⅱ.葡萄酒中常用Na2S2O5做抗氧化剂。
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。写出Na2S2O5溶于水时溶液中离子浓度由大到小的排列顺序

(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤
您最近一年使用:0次
2020-04-13更新
|
181次组卷
|
2卷引用:西藏自治区拉萨市那曲第二高级中学2020届高三全真模拟联考理综化学试题
名校
4 . 实验室进行二氧化硫制备与性质实验的组合装置如图所示,部分夹持装置未画出。
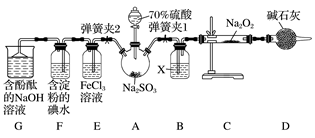
请回答下列问题:
(1)在组装好装置后,首先要进行的实验操作为_______________ 。
(2)为检验SO2与Na2O2的反应是否有氧气生成,装置B中盛放的试剂X应为________ ,装置D中碱石灰的作用是_______________________________________________ 。
(3)关闭弹簧夹2,打开弹簧夹1,注入70%的硫酸至浸没三颈烧瓶中的固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是_____________________________________ 。
(4)关闭弹簧夹1,打开弹簧夹2,残余气体进入装置E、F、G中,能说明I-的还原性弱于SO2的现象为_________________ 。发生反应的离子方程式是_______________ 。
(5)为了验证装置E中SO2与FeCl3发生了氧化还原反应,某学生设计了如下实验:取少量装置E中的溶液于试管中,向其中加入稀硝酸酸化的BaCl2溶液,产生白色沉淀,并由此判断SO2与FeCl3发生了氧化还原反应。上述方案是否合理?________ (填“合理”或“不合理”),原因是________ 。

请回答下列问题:
(1)在组装好装置后,首先要进行的实验操作为
(2)为检验SO2与Na2O2的反应是否有氧气生成,装置B中盛放的试剂X应为
(3)关闭弹簧夹2,打开弹簧夹1,注入70%的硫酸至浸没三颈烧瓶中的固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是
(4)关闭弹簧夹1,打开弹簧夹2,残余气体进入装置E、F、G中,能说明I-的还原性弱于SO2的现象为
(5)为了验证装置E中SO2与FeCl3发生了氧化还原反应,某学生设计了如下实验:取少量装置E中的溶液于试管中,向其中加入稀硝酸酸化的BaCl2溶液,产生白色沉淀,并由此判断SO2与FeCl3发生了氧化还原反应。上述方案是否合理?
您最近一年使用:0次
2017-06-03更新
|
607次组卷
|
5卷引用:西藏山南地区第二高级中学2017届高三第三次模拟考试理综化学试题
西藏山南地区第二高级中学2017届高三第三次模拟考试理综化学试题【全国百强校】陕西省西安中学2019届高三上学期期中考试化学试题陕西省咸阳百灵中学2020届高三上学期期中考试化学试题浙江省杭州地区(含周边)重点中学2020-2021学年高一下学期期中考试化学试题(已下线)【2023】【高一下】【其他】【杭高-期中复习卷】【高中化学】【刘尼尼收集】
名校
5 . 2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(ClO2)就是其中一种高效消毒灭菌剂。氯酸钠还原法是目前使用较为广泛的ClO2制备方法,其中一种是用NaClO3与CH3OH在催化剂、60℃时,发生反应得到ClO2,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
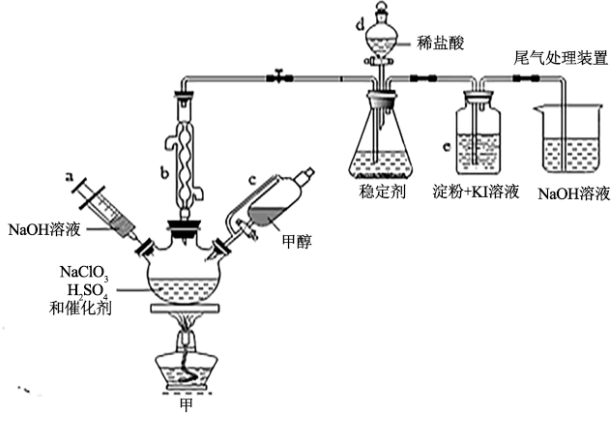
已知:①ClO2的浓度较大时易分解爆炸,一般用CO2或空气稀释到10%以下,实验室也常用稳定剂吸收ClO2,生成NaClO2,使用时加酸只释放出ClO2一种气体;
②ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O
③有关物质沸点如下表;
请回答:
(1)仪器b的名称是___________ ,在装置中的作用是___________ ;比较仪器c和d,实验中c的优点是___________ 。
(2)根据反应条件判断制备装置甲中需改进的一项措施是___________ 。
(3)反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式:___________ 。该制备法可选用不同的还原性物质作为还原剂例如草酸(草酸的氧化产物为CO2),相比甲醇法,草酸法的优点是___________ 。
(4)下列有关说法正确的是___________ 。
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的ClO2
B.装置e主要用于检验是否有Cl2生成
C.在ClO2释放实验中,发生的离子反应方程式是:4H++5 =Cl-+4ClO2↑+2H2O
=Cl-+4ClO2↑+2H2O
D.ClO2和Cl2都为强氧化剂,在相同条件下,等物质的量时,Cl2的氧化能力是ClO2的2.5倍
(5)采用以下方法可以测定所制备的ClO2的量:
Ⅰ.将足量KI用100mL水溶解后加入到锥形瓶,再加3mL稀 ;
;
Ⅱ.将生成的ClO2气体通过导管在锥形瓶中被吸收
Ⅲ.滴加几滴淀粉溶液,用cmol/L的 标准溶液滴定(
标准溶液滴定( ),共用去
),共用去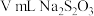 溶液:
溶液:
①达到滴定终点的现象是___________ 。
②实验测得所通入的ClO2的质量为___________ 。

已知:①ClO2的浓度较大时易分解爆炸,一般用CO2或空气稀释到10%以下,实验室也常用稳定剂吸收ClO2,生成NaClO2,使用时加酸只释放出ClO2一种气体;
②ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O
③有关物质沸点如下表;
| 物质 | CH3OH | HCOOH | ClO2 |
| 沸点 | 64.7℃ | 100.8℃ | 11℃ |
(1)仪器b的名称是
(2)根据反应条件判断制备装置甲中需改进的一项措施是
(3)反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式:
(4)下列有关说法正确的是
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的ClO2
B.装置e主要用于检验是否有Cl2生成
C.在ClO2释放实验中,发生的离子反应方程式是:4H++5
 =Cl-+4ClO2↑+2H2O
=Cl-+4ClO2↑+2H2OD.ClO2和Cl2都为强氧化剂,在相同条件下,等物质的量时,Cl2的氧化能力是ClO2的2.5倍
(5)采用以下方法可以测定所制备的ClO2的量:
Ⅰ.将足量KI用100mL水溶解后加入到锥形瓶,再加3mL稀
 ;
;Ⅱ.将生成的ClO2气体通过导管在锥形瓶中被吸收
Ⅲ.滴加几滴淀粉溶液,用cmol/L的
 标准溶液滴定(
标准溶液滴定( ),共用去
),共用去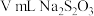 溶液:
溶液:①达到滴定终点的现象是
②实验测得所通入的ClO2的质量为
您最近一年使用:0次
2021-05-23更新
|
612次组卷
|
2卷引用:西藏自治区昌都市第一高级中学2021届高三第一次仿真考试理科综合化学试题
解题方法
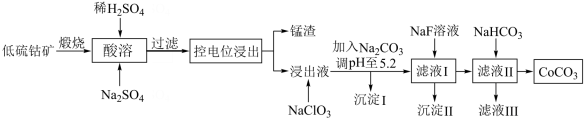
6 . 钴具有广泛用途,其正三价化合物具有强氧化性。利用低硫钴矿(含Ca、Fe、Al、Mn、Mg、Co等元素的硫化物及SiO2)可以制取多种化工试剂,采用以下工艺流程可利用低硫钴矿制备CoCO3。
已知下列信息:
①常温下,Ksp(CaF2)=4.9×10-10,Ksp(MgF2)=6.4×10-12;
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)进行“酸溶”时,能提高“酸溶”速率的方法有___________ (任写1种)。
(2)酸溶时Co2O3被还原为Co2+,同时还有___________ 离子被还原。写出Co2O3转化为Co2+反应的离子方程式___________ 。
(3)加入NaClO的作用是___________ 。
(4)加入Na2CO3调pH至5.2,目的是___________ 。沉淀的I主要成分为___________
(5)为了将Mg2+、Ca2+除去[c(Mg2+)、c(Ca2+)≤1×10-5mol/L],加入NaF使“滤液I”中c(F-)最小为___________ mol/L。
(6)“沉钴”步骤的离子方程式是___________ 。

已知下列信息:
①常温下,Ksp(CaF2)=4.9×10-10,Ksp(MgF2)=6.4×10-12;
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 1.9 | 7.0 | 7.6 | 3.0 | 8.1 |
| 完全沉淀 | 3.2 | 9.0 | 9.2 | 4.7 | 10.1 |
(1)进行“酸溶”时,能提高“酸溶”速率的方法有
(2)酸溶时Co2O3被还原为Co2+,同时还有
(3)加入NaClO的作用是
(4)加入Na2CO3调pH至5.2,目的是
(5)为了将Mg2+、Ca2+除去[c(Mg2+)、c(Ca2+)≤1×10-5mol/L],加入NaF使“滤液I”中c(F-)最小为
(6)“沉钴”步骤的离子方程式是
您最近一年使用:0次
7 . 如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是
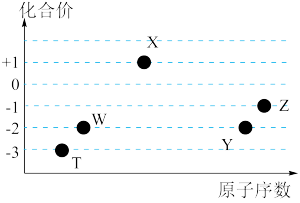

| A.X的氢化物具有很强的还原性 |
| B.YW2、ZW2、X2W2都能使品红溶液褪色,且褪色原理相同 |
| C.Y、Z元素的最高价氧化物对应的水化物都呈酸性,而且酸性:HZO4 > H2YO4 |
| D.元素W、T的氢化物的沸点比同主族中相邻的氢化物高,是因为这两种氢化物分子间存在氢键 |
您最近一年使用:0次
2020-02-06更新
|
177次组卷
|
2卷引用:西藏自治区昌都市第一高级中学2020届高三下学期第二次模拟考试理综化学试题
8 . 化学与社会、生产、生活密切相关。下列说法正确的是
| A.碳纤维是一种新开发的合成有机高分子材料 |
| B.次氯酸具有强氧化性,可用于除去水中杂质 |
| C.“雾霾”与“风雨雷电”一样属于一种自然现象 |
| D.漂白粉长期暴露在空气中,会变质甚至失效 |
您最近一年使用:0次
9 . 四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z-与某稀有气体具有相同的电子层结构。下列说法正确的是
| A.简单离子半径:W<X<Z | B.W与X形成的化合物溶于水后溶液呈碱性 |
| C.气态氢化物的热稳定性:W<Y | D.最高价氧化物的水化物的酸性:Y>Z |
您最近一年使用:0次
2021-06-23更新
|
5396次组卷
|
89卷引用:西藏山南市三校2019届高三5月模拟考试理综化学试题
西藏山南市三校2019届高三5月模拟考试理综化学试题2017届江苏省南通市高三高考全真模拟(五)化学 试卷2017届广东省广雅中学、江西省南昌二中高三下学期联合测试理综化学试卷宁夏石嘴山市第三中学2017届高三下学期第三次模拟考试理综化学试题河南省林州市第一中学2018届高三10月调研化学试题四川省南充高级中学2018届高三上学期第四次检测理综化学试题吉林省长春市普通高中2018届高三质量监测(二)理综化学试题陕西省榆林市2020届高三第三次模拟考试理综化学试题(已下线)2021年高考全国乙卷化学试题变式题2021年海南高考化学试题变式题1-102015-2016学年河北省正定中学高二下期末化学试卷2016年全国普通高等学校招生统一考试化学(新课标3卷精编版)2015-2016学年湖南省洞口县高二下学期期末化学试卷2015-2016学年山东省桓台二中高二下期末化学试卷2015-2016学年山西省临汾一中高一下期末化学试卷2017届河北沧州市第一中学高三上学期第一次月考化学试题2017届河南省部分重点中学高三上第一次联考化学试卷2017届贵州省思南中学高三上半期考试化学试卷2016-2017学年四川省简阳市高二上学期期末化学试卷2017届山东省菏泽市高三上学期期末学分认定考试B卷化学试卷2016-2017学年四川省成都简阳市高二上学期期末检测化学试卷江西省景德镇市第一中学2016-2017学年高一(16班)下学期期中考试化学试题新疆生产建设兵团第二中学2016-2017学年高二下学期第二次月考化学试题四川省成都七中实验学校2016-2017学年高二下学期期中考试化学试题四川省彭州市五校2016-2017学年高二下学期期中联考化学试题河南省南阳市第一中学2018届高三上学期第二次考试化学试题黑龙江省哈尔滨市第十八中学2018届高三第一次月考化学试题山西省忻州市第一中学2017-2018学年高二上学期摸底考试化学试题福建省闽侯第六中学2017-2018学年高二上学期第一次月考化学试题河北省邱县第一中学2018届高三上学期第一次月考化学试题福建省诗山县2018届高三上学期期中化学试题(已下线)二轮复习 专题7 物质结构与元素周期律 押题专练北京市人大附中2017-2018学年下学期高一第一次月考 化学试卷(已下线)【中等生百日捷进提升系列-基础练测】专题2.6 物质结构、元素周期表和元素周期律河北省保定市保定三中2016-2017学年度第二学期3月月考高二化学试题云南民族大学附属中学2017-2018学年高二下学期第一次月考化学试题河北省邢台市第二中学2017-2018学年高二下学期第一次月考化学试题安徽省滁州市民办高中2017-2018学年高一下学期第二次月考化学试题(已下线)《考前20天终极攻略》-5月19日 物质结构 元素周期律【全国百强校】广西陆川县中学2017-2018学年高二5月月考化学试题(已下线)解密07 物质结构和元素周期律(教师版)——备战2018年高考化学之高频考点解密安徽省肥东高级中学2017-2018学年高一下学期第二学段考试化学试题山西省临猗县临晋中学2017-2018学年高二下学期期末考试化学试题(已下线)第05天 元素周期律——《每日一题·2018快乐暑假》高二化学安徽省滁州市定远县育才学校2018-2019学年高二(实验班)上学期第一次月考化学试题【全国百强校】江苏省海安高级中学2019届高三上学期第二次月考化学试题【全国百强校】宁夏回族自治区吴忠中学2019届高三上学期第三次月考(期中)化学试题山东省微山县第二中学2019届高三上学期第三学段教学质量监测化学试题(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(押题专练)(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(教学案)2016年全国普通高等学校招生统一考试化学(全国3卷参考版)(已下线)考点07 元素周期律和元素周期表——备战2019年浙江新高考化学考点【全国百强校】宁夏回族自治区育才中学勤行校区2018-2019学年高二下学期3月月考化学试题宁夏回族自治区银川市长庆高级中学2018-2019学年高二下学期第二次月考化学试题上海交通大学附属中学2019届高三第一学期期中考试化学试题上海市南汇中学2019届高三下学期3月等级月考卷化学试题上海市上海交大附中2017-2018高二上期末化学题四川省成都市龙泉第二中学2019-2020学年高三上学期1月月考理科综合化学试题贵州省镇远县二中2019-2020学年高三上学期期末考试化学试题(已下线)专题八 物质结构与元素周期律(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训黑龙江省哈尔滨市第六中学校2019-2020学年高二下学期期中考试化学试题辽宁省阜新市第二高级中学2019-2020学年高二下学期第一次月考化学试题安徽省定远县民族中学2019-2020学年高二6月月考化学试题黑龙江省鸡西市鸡东县第二中学2019-2020学年高一下学期期末考试化学试题苏教版(2020)高一必修第一册专题5 总结检测人教版(2019)高一必修第一册 第四章素养检测(已下线)期末模拟卷(一)-2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)甘肃省平凉市庄浪县第一中学2021届高三上学期第一次模拟化学试题河北省武安市第三中学2021届高三上学期期中考试化学试题(已下线)4.2.1 元素性质的周期性变化规律(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)(已下线)4.2.1 元素性质的周期性变化规律-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)四川省成都经开区实验中学2021届高三上学期12月月考理科综合化学试题(已下线)练习7 原子结构与元素周期律2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)(鲁科版2019)必修第二册 第1章 原子结构 元素周期律 学科素养提升甘肃省平凉市庄浪县第一中学2021届高三第四次模拟化学试题(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练四川省绵阳市南山中学2020-2021学年高一下学期3月月考化学试题新疆维吾尔自治区乌鲁木齐市第四中学2020-2021学年高一下学期期中考试化学试题四川省内江市威远中学2020-2021学年高一下学期第一次月考化学试题新疆新源县2020-2021学年高一5月联考化学试题安徽芜湖市无为华星学校 2020-2021学年高一下学期期末测试化学试题内蒙古自治区通辽市科左中旗实验高级中学2020-2021学年高一下学期期末考试化学试题云南省罗平县第二中学2021-2022学年高二上学期期中化学试题黑龙江省佳木斯市第八中学2021-2022学年高三上学期第三次调研(期末)考试理科综合化学试题河北省石家庄市第二中学2022-2023学年高一下学期3月月考化学试题四川省宜宾市第四中学校2023-2024学年高一上学期1月期末化学试题云南省红河哈尼族彝族自治州蒙自市第一高级中学2023-2024学年高一下学期开学化学试题南阳华龙高级中学2023-2024学年高一下学期3月月考化学试题
名校
10 . 下表中相关物质的信息都正确的一项是
| 选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
| A | NaClO | 离子键、共价键 | 强氧化性 | 消毒液 |
| B | H2O2 |  | 不稳定,易分解 | 医用消毒剂 |
| C | NH3 | 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
| D | NaHCO3 | 离子键 | 受热易分解 | 泡沫灭火器 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-02-04更新
|
648次组卷
|
5卷引用:2016届西藏日喀则一中高三下学期二模考试理综化学试卷
2016届西藏日喀则一中高三下学期二模考试理综化学试卷【全国百强校】山东省山东师范大学附属中学2019届高三上学期第五次模拟考试化学试题新疆巴音郭楞蒙古自治州第一中学2021届高三上学期期中考试化学试题(已下线)第13讲 原子结构 化学键(练)-2023年高考化学一轮复习讲练测(新教材新高考)陕西省渭南市华州区咸林中学2020-2021学年高三下学期第1次教学质量检测化学试题



