名校
解题方法
1 . 某小组同学用如图所示装置来完成浓硫酸和木炭反应的实验以及检验生成的CO2和SO2气体。
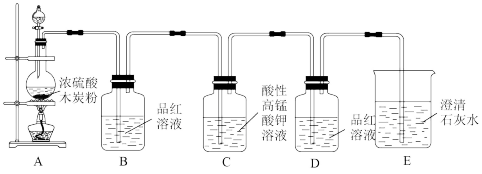
(1)装置A中反生反应的化学方程式为____ 。
(2)装置B中观察到的现象是____ ,说明这种物质具有____ (填“酸性”或“漂白性”)。
(3)装置C中酸性KMnO4溶液用于除去SO2,是利用了SO2具有____ (填“氧化性”或“还原性”),其目的是____ ,装置C中发生的方程式____ 。装置D的作用是____ 。

(1)装置A中反生反应的化学方程式为
(2)装置B中观察到的现象是
(3)装置C中酸性KMnO4溶液用于除去SO2,是利用了SO2具有
您最近一年使用:0次
解题方法
2 . 下列关于金属或其化合物的说法中不正确的是
| A.工业上在高温下可用CO还原含Fe2O3的铁矿石炼铁 |
| B.过氧化钠具有强氧化性,可以用作漂白剂 |
| C.铝制容器一般不能装酸性或碱性试剂 |
| D.氯化铁溶液有较强氧化性,故可用作净水剂 |
您最近一年使用:0次
2020-12-03更新
|
136次组卷
|
2卷引用:西藏拉萨那曲第二高级中学2021届高三第二次月考化学试题
10-11高三·西藏拉萨·阶段练习
名校
3 . 原子序数依次增大的四种常见元素W、X、Y、Z,均可形成一种或多种氧化物。其中W、Y的氧化物是导致酸雨的主要物质,X的氧化物既可以和强酸、亦可以和强碱反应,Z则具有砖红色和黑色的两种氧化物。
(1)W元素在元素周期表的位置为____________ ,用电子式表示其气态氢化物________ 。
(2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是_____________ 。
(3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性。设计实验,验证该氧化物具有还原性,其操作方法是______________ 。
(4)一定物质的量的稀硝酸恰能将Z的砖红色的氧化物氧化,自身被还原成NO。则反应中氧化剂与还原剂的物质的量的比为____________ 。
(1)W元素在元素周期表的位置为
(2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是
(3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性。设计实验,验证该氧化物具有还原性,其操作方法是
(4)一定物质的量的稀硝酸恰能将Z的砖红色的氧化物氧化,自身被还原成NO。则反应中氧化剂与还原剂的物质的量的比为
您最近一年使用:0次
4 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,有极强的还原性。受热、遇水都会发生分解反应放出大量的热,甚至引起燃烧。不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。
(1)保险粉应如何保存?_______________________________________ 。
(2)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:
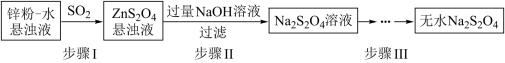
①步骤I中SO2表现了____________ (填“氧化性”、“还原性”或“酸性”);若用Na2SO3固体和某酸反应制备SO2气体,你认为下列最适宜选用的酸是____________
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4悬浊液中c(Zn2+)=0.1mol·L-1,则应加氢氧化钠溶液调至pH≥_________ ,才能使Zn(OH)2沉淀完全(已知离子浓度≤1.0×10-5mol·L-1,即沉淀完全;Ksp[Zn(OH)2]=1.0×10-17)
③步骤Ⅲ过程较为复杂,其中涉及过滤,洗涤,干燥等过程,请写出洗涤过程:_______________ .
(3)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)、碳酸钠溶于乙醇中,再通入足量的SO2气体,析出Na2S2O4固体。完成反应的化学方程式:_________________
____HCOONa+____SO2+___Na2CO3=____Na2S2O4↓+___H2O+______
(4)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或 ②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。____________________________ .
(1)保险粉应如何保存?
(2)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:

①步骤I中SO2表现了
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4悬浊液中c(Zn2+)=0.1mol·L-1,则应加氢氧化钠溶液调至pH≥
③步骤Ⅲ过程较为复杂,其中涉及过滤,洗涤,干燥等过程,请写出洗涤过程:
(3)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)、碳酸钠溶于乙醇中,再通入足量的SO2气体,析出Na2S2O4固体。完成反应的化学方程式:
____HCOONa+____SO2+___Na2CO3=____Na2S2O4↓+___H2O+______
(4)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或 ②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。
您最近一年使用:0次
2016-12-09更新
|
478次组卷
|
2卷引用:西藏自治区拉萨中学2018届高三上学期第三次月考理综化学试题
5 . 某研究性学习小组利用所示装置探究二氧化硫的性质。(装置中固定仪器未画出)
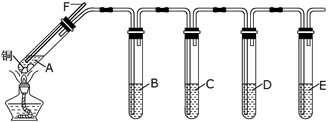
(1)A中所装试剂为铜片和____________ 。(填试剂名称)。
(2)D中试剂为0.5 mol/L BaCl2溶液,实验中无明显现象,若改为同浓度的Ba(NO3)2溶液,则出现白色沉淀,此沉淀的化学式为_______________ ,证明SO2具有_____________ 性。
(3)装置B用于验证SO2的漂白性,则其中所装溶液可以为______________ 。
(4)实验时,B中溶液褪色,并有大量气泡冒出,但始终未见C中饱和澄清石灰水出现浑浊或沉淀。请推测可能原因,并设计实验验证。
可能原因:___________________________ 。
实验验证:___________________________ 。
(5)E中Na2S溶液用于验证SO2的氧化性,预期观察到的现象为______________________ 。
(6)指出上述装置中一处明显的不足:___________________ 。
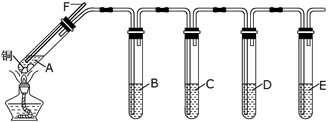
(1)A中所装试剂为铜片和
(2)D中试剂为0.5 mol/L BaCl2溶液,实验中无明显现象,若改为同浓度的Ba(NO3)2溶液,则出现白色沉淀,此沉淀的化学式为
(3)装置B用于验证SO2的漂白性,则其中所装溶液可以为
| A.酸性高锰酸钾溶液 | B.品红溶液 | C.石蕊试液 | D.蓝色的碘—淀粉溶液 |
可能原因:
实验验证:
(5)E中Na2S溶液用于验证SO2的氧化性,预期观察到的现象为
(6)指出上述装置中一处明显的不足:
您最近一年使用:0次
名校
6 . 某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
【初步探究】
(1)为探究温度对反应速率的影响,实验②中试剂A应为_________ 。
(2)写出实验③中 反应的离子方程式:
反应的离子方程式:_________________ 。
(3)对比实验②③④,可以得出结论:_________________ 。
【继续探究】溶液 对反应速率的影响
对反应速率的影响
查阅资料:i.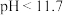 时,
时, 能被
能被 氧化为I2。
氧化为I2。
ii.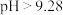 时,
时, 发生歧化反应:
发生歧化反应: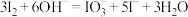 ,
, 越大,歧化速率越快。
越大,歧化速率越快。
(4)小组同学用4支试管在装有 的储气瓶中进行实验,装置如图所示。
的储气瓶中进行实验,装置如图所示。
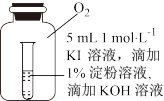
分析⑦和⑧中颜色无明显变化的原因:________ 。
(5)甲同学利用原电池原理设计实验证实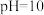 的条件下确实可以发生
的条件下确实可以发生 被
被 氧化为I2的反应,如图所示,请你填写试剂和实验现象
氧化为I2的反应,如图所示,请你填写试剂和实验现象____________ 。
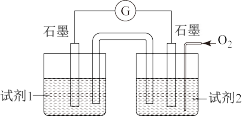
【深入探究】较高温度对反应速率的影响
小组同学分别在敞口试管和密闭试管中进行了实验⑨和⑩。
(6)对比实验⑨和⑩的现象差异,该小组同学经过讨论对实验⑨中的现象提出两种假设,请你补充假设1。
假设1:_____________ 。
假设2:45℃以上I2易升华,70℃水浴时,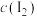 太小难以显现黄色。
太小难以显现黄色。
【初步探究】
| 示意图 | 序号 | 温度 | 试剂A | 现象 |
 | ① | 0℃ | 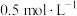 稀硫酸 稀硫酸 | 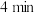 左右出现蓝色 左右出现蓝色 |
| ② | 20℃ | 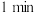 左右出现蓝色 左右出现蓝色 | ||
| ③ | 20℃ | 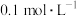 稀硫酸 稀硫酸 |  左右出现蓝色 左右出现蓝色 | |
| ④ | 20℃ | 蒸馏水 | 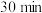 左右出现蓝色 左右出现蓝色 |
(2)写出实验③中
 反应的离子方程式:
反应的离子方程式:(3)对比实验②③④,可以得出结论:
【继续探究】溶液
 对反应速率的影响
对反应速率的影响查阅资料:i.
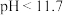 时,
时, 能被
能被 氧化为I2。
氧化为I2。ii.
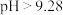 时,
时, 发生歧化反应:
发生歧化反应: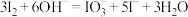 ,
, 越大,歧化速率越快。
越大,歧化速率越快。(4)小组同学用4支试管在装有
 的储气瓶中进行实验,装置如图所示。
的储气瓶中进行实验,装置如图所示。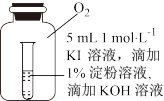
| 序号 | ⑤ | ⑥ | ⑦ | ⑧ |
| 试管中溶液的pH | 8 | 9 | 10 | 11 |
| 放置10小时后的现象 | 出现蓝色 | 颜色无明显变化 | ||
(5)甲同学利用原电池原理设计实验证实
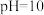 的条件下确实可以发生
的条件下确实可以发生 被
被 氧化为I2的反应,如图所示,请你填写试剂和实验现象
氧化为I2的反应,如图所示,请你填写试剂和实验现象
【深入探究】较高温度对反应速率的影响
小组同学分别在敞口试管和密闭试管中进行了实验⑨和⑩。
| 序号 | 温度 | 试剂 | 现象 |
| ⑨敞口试管 | 水浴70°C | 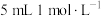  溶液 溶液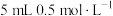 稀硫酸 稀硫酸 |  仍保持无色,冷却至室温后滴加淀粉溶液出现蓝色 仍保持无色,冷却至室温后滴加淀粉溶液出现蓝色 |
| ⑩密闭试管 | 溶液迅速出现黄色,且黄色逐渐加深,冷却至室温后滴加淀粉溶液出现蓝色 |
假设1:
假设2:45℃以上I2易升华,70℃水浴时,
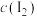 太小难以显现黄色。
太小难以显现黄色。
您最近一年使用:0次
9-10高一下·广东河源·期末
名校
解题方法
7 . 随着卤素原子(氟、氯、溴、碘)核电荷数的增大,下列递变规律正确的是
| A.单质的溶沸点逐渐降低 | B.卤素离子的还原性逐渐增强 |
| C.气态氢化物的稳定性逐渐增强 | D.单质的氧化性逐渐增强 |
您最近一年使用:0次
2022-03-22更新
|
621次组卷
|
33卷引用:2017届西藏山南二中高三上11月月考化学试卷
2017届西藏山南二中高三上11月月考化学试卷(已下线)2012-2013学年海南省琼海市嘉积中学高一下学期第一次月考化学试卷内蒙古北京八中乌兰察布分校2017-2018学年高一下学期第一次调考化学试题青海省西宁二十一中2017-2018学年高一下学期3月月考化学试题安徽省白泽湖中学2018-2019学年高一下学期第一次月考化学试题内蒙古通辽市实验中学2018-2019学年高一下学期第一次月考化学试题四川省威远中学2018-2019学年高一下学期第二次月考化学试题陕西省宝鸡市渭滨中学2021-2022学年高一下学期第一次月考化学试题(已下线)2010年广东省龙川一中高一下学期期末考试化学试题(已下线)2010-2011学年江苏省启东中学高二上学期期中考试化学试卷(已下线)2012-2013学年云南省玉溪一中高一下学期期中考试化学试卷(已下线)2013-2014黑龙江省哈六中高一下学期期末考试化学试卷2014-2015学年广东省惠州市高一下学期期末考试化学文科试卷2015-2016学年广西桂林十八中高一下期中化学试卷2015-2016学年广东省广州市南沙区高一下学期期末考试化学试卷广东省佛山市超盈实验中学2016-2017学年高一下学期期末模拟化学试题安徽省池州市江南中学2016-2017学年高一下学期期末考试化学试题河南省安阳市第三十五中学2016-2017学年高一下学期期末考试化学试题四川省成都市龙泉中学2016-2017学年高一暑假作业综合训练(一)化学试题上海市浦东区浦东中学2019届高三上学期期中考试化学试题吉林省辽源市田家炳高级中学2018-2019学年高一下学期期中考试化学试题云南省丽江县第三中学2019—2020学年高一上学期期末考试化学试题贵州省施秉县一中2019-2020学年高一上学期期末考试化学试题广东省郁南县连滩中学2019-2020学年高一下学期期中考试化学试题辽宁省丹东市2018-2019学年高一下学期期末质量监测化学试题广西桂林市第十八中学2019-2020学年高一下学期开学考试化学试题内蒙古自治区呼和浩特市开来中学2019-2020学年高一下学期期末考试化学试题上海市延安中学2021-2022学年高一上学期期末考试化学试题上海市市北中学2021-2022学年高一下学期期中考试化学试题上海市崇明区横沙中学2021-2022学年高二上学期期末考试化学试题新疆霍城县第二中学2021-2022学年高一下学期期中考试化学试题上海市延安中学 2022-2023学年高一上学期期末考试化学试题四川省泸州市龙马潭区2023-2024学年高一下学期5月期中考试化学试题
8 . 由下列实验及现象不能推出相应结论的是
| 实验 | 现象 | 结论 | |
| A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
| B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
| C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
| D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一支试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-08-08更新
|
10611次组卷
|
24卷引用:西藏拉萨北京实验中学2018届高三第五次月考理科综合化学试题
西藏拉萨北京实验中学2018届高三第五次月考理科综合化学试题西藏自治区拉萨市拉萨中学2020届高三第七次月考试理综化学试题四川省双流中学2018届高三11月月考理科综合化学试题广东省揭阳市第一中学2018届高三上学期第二次阶段考试化学试题四川省广安市岳池中学2018届高三上学期第三次月考理综化学试题安徽省淮北市第一中学2017-2018学年高二下学期第一次月考化学试题1北京市101中学2018届高三3月月考化学试题江苏省常州市第一中学2019届高三第一学期期初(8月)考试化学试题陕西省西安市远东第一中学2019届高三上学期10月月考化学试题江苏师范大学附属实验学校2019届高三上学期10月学情调研化学试题黑龙江省哈尔滨市第六中学2020届高三上学期第三次调研考试化学试题河北省石家庄市第二中学2020届高三下学期教学质量检测模拟考试理综化学试题湖北省黄冈市黄梅国际育才高级中学2019-2020学年高二上学期10月月考化学试题四川省成都附属实验中学2021届高三上学期11月月考理科综合化学试题四川省内江市威远中学2020-2021学年高三12月月考化学试题河南省商丘市夏邑县第一高级中学2021-2022学年高二下学期6月份月考化学试题辽宁省锦州市渤海大学附属高级中学2023-2024学年高三上学期第三次考试化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅱ卷精编版)百所名校联考-金属及其化合物湖北省鄂州市2019-2020学年高二上学期期末考试化学试题黑龙江省大庆铁人中学2020届高三考前模拟训练(一)理科综合化学试题四川省成都市龙泉中学2021届高三上学期开学考试化学试题福建师范大学第二附属中学2019-2020学年高二上学期期末考试化学试题(已下线)考向34 物质的检验、分离和提纯-备战2022年高考化学一轮复习考点微专题
名校
解题方法
9 . 1.A、B、C、D四种物质之间有如图所示的转化关系。已知:A是空气中的主要成分之一,B、C、D均为化合物,且C为一种红棕色气体。
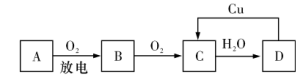
请回答下列问题:
(1)写出B的化学式:___ 。
(2)在D→C的过程中,D表现出强___ (填“氧化性”或“还原性”)。
(3)写出C→D的化学方程式:___ 。
2.汽车尾气中含有NO,在汽车尾气排放管中安装一个“催化转换器”(用铂、钯合金作催化剂),可将尾气中另一种有害气体CO跟NO反应转化为无毒气体。写出CO与NO反应的化学方程式:___ 。
3.控制或者减少城市汽车尾气污染的方法还可以有___ 。
a.开发氢能源 b.使用电动车 c.使用含铅汽油 d.严禁车辆行驶

请回答下列问题:
(1)写出B的化学式:
(2)在D→C的过程中,D表现出强
(3)写出C→D的化学方程式:
2.汽车尾气中含有NO,在汽车尾气排放管中安装一个“催化转换器”(用铂、钯合金作催化剂),可将尾气中另一种有害气体CO跟NO反应转化为无毒气体。写出CO与NO反应的化学方程式:
3.控制或者减少城市汽车尾气污染的方法还可以有
a.开发氢能源 b.使用电动车 c.使用含铅汽油 d.严禁车辆行驶
您最近一年使用:0次
2021-04-29更新
|
459次组卷
|
4卷引用:西藏拉萨中学2021-2022学年高二上学期第一次月考理综化学试题
西藏拉萨中学2021-2022学年高二上学期第一次月考理综化学试题黑龙江省大庆市肇州县肇州中学2020-2021学年高一下学期期中考试化学试题(已下线)专题02 氮及其化合物【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版2019必修第二册)云南省昆明市第一中学2021-2022学年高一下学期期中考试化学试题
10 . 下表标出的是元素周期表前四周期的部分元素。

强调:必须用相应的化学符号回答下列问题
(1)表中用字母标出的14种元素中,化学性质最不活泼的元素是____________ ,属于过渡元素的是_____________ (该空用字母表示)。
(2)G元素原子结构示意图为___________ 。K元素简单离子结构示意图为__________ 。
(3)D、G、I、L简单离子半径大小顺序是________________ 。(用离子符号表示)
(4)C、D、H的气态氢化物的稳定性大小顺序是_______________ 。(用分子式表示)
(5)表中所给元素的最高价氧化物水化物中碱性最强的是_________ 。(填化学式)
(6)E、F、G简单离子的氧化性大小顺序是________________ 。(用离子符号表示)
(7)写出元素G的氧化物与E的氢氧化物反应的离子方程式________________ 。
(8)I的某种氧化物和J单质的水溶液发生反应的方程式________________ 。

强调:必须用相应的化学符号回答下列问题
(1)表中用字母标出的14种元素中,化学性质最不活泼的元素是
(2)G元素原子结构示意图为
(3)D、G、I、L简单离子半径大小顺序是
(4)C、D、H的气态氢化物的稳定性大小顺序是
(5)表中所给元素的最高价氧化物水化物中碱性最强的是
(6)E、F、G简单离子的氧化性大小顺序是
(7)写出元素G的氧化物与E的氢氧化物反应的离子方程式
(8)I的某种氧化物和J单质的水溶液发生反应的方程式
您最近一年使用:0次



