1 . 工业上以海水为原料富集镁并冶炼金属镁,其流程如图:
(1)海水中含有大量MgCl2、NaCl和CaCl2,它们属于______ (填“酸”或“盐”)。
(2)熟石灰溶于水,所得的溶液呈______ (填“酸性”或“碱性”)。
(3)冶炼镁(操作Ⅱ)的方法属于______ (填“电解法”或“热分解法”)。
(4)工业上制取光气(COCl2)的反应: 。某体积为2 L的恒容反应器中发生上述反应,Cl2的物质的量与时间的关系如图。则:
。某体积为2 L的恒容反应器中发生上述反应,Cl2的物质的量与时间的关系如图。则:______  ;
;
②其他条件不变时,往反应器中通入氩气(不参与反应),该反应的反应速率______ (填“增大”或“不变”)。

(1)海水中含有大量MgCl2、NaCl和CaCl2,它们属于
(2)熟石灰溶于水,所得的溶液呈
(3)冶炼镁(操作Ⅱ)的方法属于
(4)工业上制取光气(COCl2)的反应:
 。某体积为2 L的恒容反应器中发生上述反应,Cl2的物质的量与时间的关系如图。则:
。某体积为2 L的恒容反应器中发生上述反应,Cl2的物质的量与时间的关系如图。则: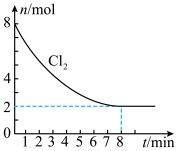
 ;
;②其他条件不变时,往反应器中通入氩气(不参与反应),该反应的反应速率
您最近一年使用:0次
名校
解题方法
2 . 甲基丙烯酸甲酯(MMA)可合成有机玻璃,MMA的一种合成方法如下:
(1)MMA的分子式为___________ 。
(2)MMA中官能团的名称为___________ 和___________ 。
(3)MMA合成有机玻璃( )的反应类型为
)的反应类型为___________ 。
(4)甲基丙烯酸与甲醇反应生成MMA的化学方程式为___________ 。

(1)MMA的分子式为
(2)MMA中官能团的名称为
(3)MMA合成有机玻璃(
 )的反应类型为
)的反应类型为(4)甲基丙烯酸与甲醇反应生成MMA的化学方程式为
您最近一年使用:0次
名校
解题方法
3 . 锌在工业中有重要作用,也是人体必需的微量元素。请回答:
(1)基态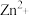 的价层电子排布式
的价层电子排布式_______ , 中阴离子空间结构为
中阴离子空间结构为_______ 。
(2)下列说法正确的是_______。
(3)已知: 和
和 的熔点数据如下表:
的熔点数据如下表:
 熔点明显高于
熔点明显高于 ,原因是
,原因是_______ 。
(4)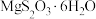 的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。
的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。 个数为
个数为_______ 。已知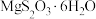 的摩尔质量是
的摩尔质量是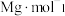 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为_______  。(
。(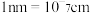 )
)
(1)基态
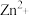 的价层电子排布式
的价层电子排布式 中阴离子空间结构为
中阴离子空间结构为(2)下列说法正确的是_______。
A.电负性: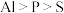 | B.离子半径: |
| C.Fe位于元素周期表的第四周期第Ⅷ族 | D.Cr在元素周期表中处于d区 |
(3)已知:
 和
和 的熔点数据如下表:
的熔点数据如下表:| 物质 | 熔点/℃ |
 | 800.7 |
 |  |
 熔点明显高于
熔点明显高于 ,原因是
,原因是(4)
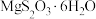 的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。
的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。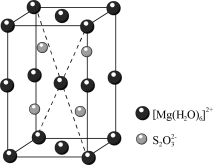
 个数为
个数为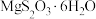 的摩尔质量是
的摩尔质量是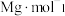 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为 。(
。(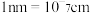 )
)
您最近一年使用:0次
解题方法
4 . 探究是创新的源泉,某化学兴趣小组进行了制备氯气并探究卤素性质的实验。
(1)用二氧化锰与浓盐酸制备氯气,应选择的发生装置是_______ (填字母代号),该反应体现了浓盐酸的酸性和_______ (填“氧化性”或“还原性”)。
①甲中反应的离子方程式为_______ ,向反应后的橙黄色溶液中滴加 KI-淀粉溶液,溶液变为蓝色,通过上述实验_______ (填“能”或“不能”)得出氧化性:Cl2>Br2>I2。
②乙装置中 NaOH 溶液的作用为_______ ,其主要反应的化学方程式为_______ 。
(1)用二氧化锰与浓盐酸制备氯气,应选择的发生装置是
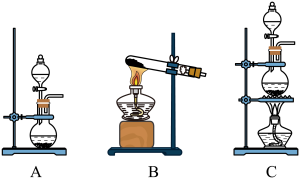
①甲中反应的离子方程式为
②乙装置中 NaOH 溶液的作用为
您最近一年使用:0次
名校
解题方法
5 . 下图为实验室制取乙酸乙酯的装置。
(1)仪器组装好后首先进行的操作是___________ 。
(2)浓硫酸的作用是___________ 。
(3)竖直试管中的导管应处在饱和碳酸钠溶液的液面以上,原因是___________ 。
(4)该实验中饱和碳酸钠能溶解乙醇,中和乙酸,有利于乙酸乙酯的析出。现实验室需配制180ml 2.70mol/L的饱和碳酸钠溶液。
①该实验需要使用的玻璃仪器有烧杯、玻璃棒、量筒、___________ 和___________ 。
②定容操作时,仰视刻度线,导致碳酸钠溶液的浓度___________ (填“变大”或“变小”)。

(1)仪器组装好后首先进行的操作是
(2)浓硫酸的作用是
(3)竖直试管中的导管应处在饱和碳酸钠溶液的液面以上,原因是
(4)该实验中饱和碳酸钠能溶解乙醇,中和乙酸,有利于乙酸乙酯的析出。现实验室需配制180ml 2.70mol/L的饱和碳酸钠溶液。
①该实验需要使用的玻璃仪器有烧杯、玻璃棒、量筒、
②定容操作时,仰视刻度线,导致碳酸钠溶液的浓度
您最近一年使用:0次
6 . 兴趣小组模拟工业废卤水(主要含 、
、 、
、 )固定
)固定 并回收钠盐的过程,实验流程如下:
并回收钠盐的过程,实验流程如下:
(1)“调pH”的目的是使废卤水呈碱性,则X可以为___________。
(2)“固定”过程中___________。
(3)“过滤”需要使用的仪器有___________。
(4)“操作a”除对滤液调pH外,还包括___________。
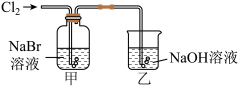
(5) 可由如图装置制备。下列说法正确的是___________。
可由如图装置制备。下列说法正确的是___________。
 、
、 、
、 )固定
)固定 并回收钠盐的过程,实验流程如下:
并回收钠盐的过程,实验流程如下:
(1)“调pH”的目的是使废卤水呈碱性,则X可以为___________。
| A.CaO | B.HCl | C.NaOH | D. |
(2)“固定”过程中___________。
| A.溶液pH下降 | B.有HCl放出 |
C.需通入适量的 | D. 浓度减小 浓度减小 |
(3)“过滤”需要使用的仪器有___________。
| A.漏斗 | B.研钵 | C.烧杯 | D.玻璃棒 |
(4)“操作a”除对滤液调pH外,还包括___________。
| A.加热蒸发 | B.搅拌 | C.冷却 | D.干燥 |
(5)
 可由如图装置制备。下列说法正确的是___________。
可由如图装置制备。下列说法正确的是___________。
A.Ⅰ中反应为: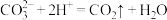 |
B.Ⅰ中装置更换合适试剂后也可用于制备 |
C.Ⅱ中盛放饱和 溶液,用于除去气体中的HCl 溶液,用于除去气体中的HCl |
D.Ⅱ中盛放饱和 溶液,用于除去气体中的HCl 溶液,用于除去气体中的HCl |
您最近一年使用:0次
名校
解题方法
7 . 用Cu+2Ag+ =2Ag + Cu2+反应,设计一个原电池。
(1)正极材料选用:___________ 电极反应式为:_______________
(2)电子由___________ 通过导线流向___________ 。(填材料名称)
(3)溶液中的H+向___________ 移动
(4)导线上有0.2mole-通过时,负极质量减少____________ g
(5)请画出实验装置图,注明电解质溶液名称和正负极材料,标出电子流动方向____________ 。
(1)正极材料选用:
(2)电子由
(3)溶液中的H+向
(4)导线上有0.2mole-通过时,负极质量减少
(5)请画出实验装置图,注明电解质溶液名称和正负极材料,标出电子流动方向
您最近一年使用:0次
解题方法
8 . Fe/Fe3O4复合物是一种高密度磁记录材料,磁记录材料有记录和存储信息的功能。制备该材料的一种流程如下:
Ⅰ、相关反应原理:
①Fe2++2OH-=Fe(OH)2
②3Fe(OH)2=Fe+2Fe(OH)3
③Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O
Ⅱ、25℃时Fe(OH)2的Ksp=8.0×10-16
1.用FeCl2溶液和KOH溶液制备Fe/Fe3O4反应的离子方程式为_____ 。该“反应”中通入氩气的原因_____ 。
2.取少量反应后溶液于试管中,选择试剂_____,可证明FeCl2溶液已反应完全。
3.已知参加反应的FeCl2溶液浓度为lmol·L−1。由题给信息分析,25℃时,当pH<2时,Fe/Fe3O4产率极低的原因_____ 。
下图1为回流时间与Fe/Fe3O4产率的关系图,图2为回流1h所得产品的X射线衍射图。_____ 。
通过Fe3O4和FeO的热化学循环可以利用太阳能,其转化关系如图所示。
6.从绿色化学角度评价该循环过程(说一点)。_____

Ⅰ、相关反应原理:
①Fe2++2OH-=Fe(OH)2
②3Fe(OH)2=Fe+2Fe(OH)3
③Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O
Ⅱ、25℃时Fe(OH)2的Ksp=8.0×10-16
1.用FeCl2溶液和KOH溶液制备Fe/Fe3O4反应的离子方程式为
2.取少量反应后溶液于试管中,选择试剂_____,可证明FeCl2溶液已反应完全。
| A.SO2 | B.铁粉 |
| C.KSCN溶液 | D.KSCN溶液新制氯水 |
下图1为回流时间与Fe/Fe3O4产率的关系图,图2为回流1h所得产品的X射线衍射图。

通过Fe3O4和FeO的热化学循环可以利用太阳能,其转化关系如图所示。
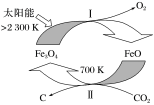
| A.反应物 | B.中间产物 | C.催化剂 | D.产物 |
您最近一年使用:0次
9 . 研究氮及其化合物的性质具有极为重要的意义。
(1)NOx是汽车尾气中的主要污染物之一、NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_______ ,此反应的氧化产物是_______ ,1molNO2反应转移电子_______ mol。
(2)工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,写出实验室用固体加热制取NH3的化学方程式为_______ ,用5.35g NH4Cl固体与足量Ca(OH)2反应,最多可制得标准状况下氨气的体积为_______ L。(NH4Cl的摩尔质量为53.5g·mol-1)
(3)实验室可以用铜与稀硝酸制取NO,写出该反应的离子方程式:_______ 。
(4)工业上采用氨氧化法制取硝酸,写出在催化剂作用下氨气与氧气反应的化学方程式:__ 。
(5)工业合成氨原料气氢气通过碳与水蒸气反应制取。已知1mol水蒸气和炽热的焦炭反应生成水煤气,反应吸热131.4 kJ 。写出该反应的热化学方程式______ 。
(1)NOx是汽车尾气中的主要污染物之一、NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:
(2)工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,写出实验室用固体加热制取NH3的化学方程式为
(3)实验室可以用铜与稀硝酸制取NO,写出该反应的离子方程式:
(4)工业上采用氨氧化法制取硝酸,写出在催化剂作用下氨气与氧气反应的化学方程式:
(5)工业合成氨原料气氢气通过碳与水蒸气反应制取。已知1mol水蒸气和炽热的焦炭反应生成水煤气,反应吸热131.4 kJ 。写出该反应的热化学方程式
您最近一年使用:0次
解题方法
10 . 氮及其化合物在生产、生活中广泛应用。
Ⅰ.氮元素化合价-物质类别关系图如图所示。

(1)图中A可以是__________ (写化学式)。写出一个能够生成B的化学方程式__________ 。
(2)实验室中,检验溶液中是否含有 的操作方法是
的操作方法是__________ 。
(3)水体中硝酸盐含量过高对环境不利,通过电催化法可以将水体中的硝酸盐进行合理转化。写出在中性介质中硝酸盐转化为氮气的阴极电极反应式__________ 。
Ⅱ.下图为实验室模拟尿素法制备水合肼( )的流程图:
)的流程图:
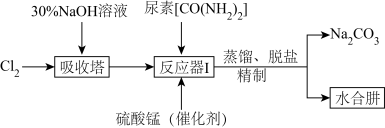
已知:① 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 。
。
②一定条件下,碱性NaClO溶液与尿素溶液反应生成 。
。
回答下列问题:
(4)“吸收塔”内发生反应的离子方程式为__________ 。
(5)写出“反应器Ⅰ”中生成水合肼反应的化学方程式为__________ 。
(6)“反应器Ⅰ”要控制NaClO溶液的用量,其主要目的是__________ 。
Ⅰ.氮元素化合价-物质类别关系图如图所示。

(1)图中A可以是
(2)实验室中,检验溶液中是否含有
 的操作方法是
的操作方法是(3)水体中硝酸盐含量过高对环境不利,通过电催化法可以将水体中的硝酸盐进行合理转化。写出在中性介质中硝酸盐转化为氮气的阴极电极反应式
Ⅱ.下图为实验室模拟尿素法制备水合肼(
 )的流程图:
)的流程图:
已知:①
 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 。
。②一定条件下,碱性NaClO溶液与尿素溶液反应生成
 。
。回答下列问题:
(4)“吸收塔”内发生反应的离子方程式为
(5)写出“反应器Ⅰ”中生成水合肼反应的化学方程式为
(6)“反应器Ⅰ”要控制NaClO溶液的用量,其主要目的是
您最近一年使用:0次



