解题方法
1 . 草酸(H2C2O4)、草酸铵[(NH4)2C2O4]是重要的化合物。回答下列问题:
(1)实验表明,加热条件下,H2C2O4可分解生成CO2、CO和H2O。为了验证产物中的CO,设计如下实验装置:_______________ (装置可重复利用)。装置F中发生的化学反应方程式为_______________ 。
②能证明草酸晶体分解产物中有CO的现象是_______________ 。
(2)H2C2O4能与酸性高锰酸钾溶液反应,离子方程式为 。该反应中,还原剂为
。该反应中,还原剂为______________ (填化学式),若称取mg草酸晶体(H2C2O4·2H2O)粗产品,配成100mL溶液于锥形瓶中,加入V mL a mol·L-1KMnO4溶液,恰好完全反应,则该草酸晶体的纯度为______________ %[M(H2C2O4·2H2O)=126g·mol-1]。
(3)(NH4)2C2O4是良好的Co2+的沉淀剂,如下为(NH4)2C2O4加入CoSO4溶液中制备CoO的流程图:______________ (填化学式)。
②称量mg CoC2O4·2H2O[M(CoC2O4·2H2O)=183g·mol-1]“高温分解”,测得固体的失重率( )与温度的关系曲线如图所示:
)与温度的关系曲线如图所示:_______________ ;“高温分解”需控制的最低温度为_______________ (经测定290~890℃过程中产生的气体只有CO2)。
(1)实验表明,加热条件下,H2C2O4可分解生成CO2、CO和H2O。为了验证产物中的CO,设计如下实验装置:
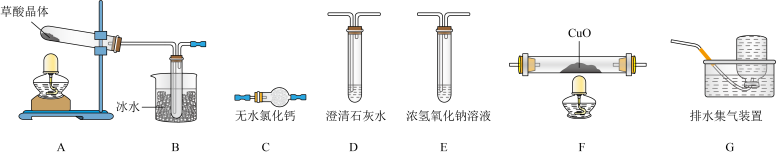
②能证明草酸晶体分解产物中有CO的现象是
(2)H2C2O4能与酸性高锰酸钾溶液反应,离子方程式为
 。该反应中,还原剂为
。该反应中,还原剂为(3)(NH4)2C2O4是良好的Co2+的沉淀剂,如下为(NH4)2C2O4加入CoSO4溶液中制备CoO的流程图:
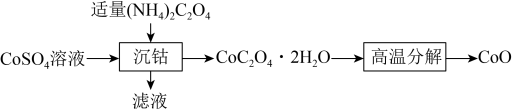
②称量mg CoC2O4·2H2O[M(CoC2O4·2H2O)=183g·mol-1]“高温分解”,测得固体的失重率(
 )与温度的关系曲线如图所示:
)与温度的关系曲线如图所示: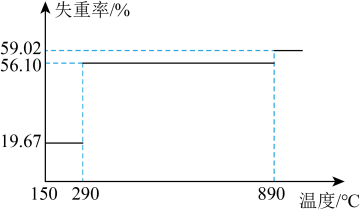
您最近一年使用:0次
2 . 砷化镓(GaAs)是一种重要的半导体材料。回答下列问题:
(1)基态砷原子的电子排布式为___________ ,电子的自旋有顺时针、逆时针两种方向,分别用自旋量子数 、
、 表示,则该原子中两种自旋量子数的代数和为
表示,则该原子中两种自旋量子数的代数和为___________ 。
(2)砷、镓与硒位于同一周期,三者电负性由大到小的顺序为___________ (用元素符号表示)。
(3)如图,a、b、c、d、e分别代表与镓同周期第一电离能较大的前五种元素(Kr元素除外),则c对应的原子序数为___________ ,d对应的元素是___________ (填元素符号),镓的电离能 、
、 、
、 、
、 …前四个电离能中,相邻两电离能之差最大的是
…前四个电离能中,相邻两电离能之差最大的是___________ 。上述五种元素中原子序数较大的两种元素形成的氢化物稳定性较强的是___________ (填分子式)。
(1)基态砷原子的电子排布式为
 、
、 表示,则该原子中两种自旋量子数的代数和为
表示,则该原子中两种自旋量子数的代数和为(2)砷、镓与硒位于同一周期,三者电负性由大到小的顺序为
(3)如图,a、b、c、d、e分别代表与镓同周期第一电离能较大的前五种元素(Kr元素除外),则c对应的原子序数为
 、
、 、
、 、
、 …前四个电离能中,相邻两电离能之差最大的是
…前四个电离能中,相邻两电离能之差最大的是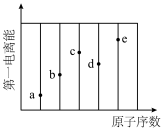
您最近一年使用:0次
解题方法
3 . 磷的单质及其化合物在生产、生活中具有广泛应用。回答下列问题:
(1)基态磷原子价电子排布式为___________ ,核外电子占据的最高能级的电子云轮廓图为___________ 形。
(2)第三周期元素中第一电离能介于硅和磷之间的元素为___________ (填元素符号),离子半径:
___________ (填“>”“<”或“=”) 。
。
(3) 固体属于
固体属于___________ 晶体,键能: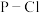
___________ (填“>”“<”或“=”) ,
, 、
、 中键角较大的是
中键角较大的是___________ 。
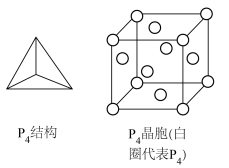
(4)白磷的分子结构及其晶胞结构如图所示,晶胞参数为 。
。 中磷原子的杂化方式为
中磷原子的杂化方式为___________ 。
②白磷晶体中,距离一个 最近的
最近的 个数为
个数为___________ 。
③该晶体的密度=___________  (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)基态磷原子价电子排布式为
(2)第三周期元素中第一电离能介于硅和磷之间的元素为

 。
。(3)
 固体属于
固体属于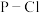
 ,
, 、
、 中键角较大的是
中键角较大的是(4)白磷的分子结构及其晶胞结构如图所示,晶胞参数为
 。
。
 中磷原子的杂化方式为
中磷原子的杂化方式为②白磷晶体中,距离一个
 最近的
最近的 个数为
个数为③该晶体的密度=
 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
4 . 某小组同学欲探究AgNO3溶液与FeSO4溶液的反应,进行如下实验。
查阅资料:i.AgSCN为白色固体, ;
;
ii.
(1)取实验①中灰黑色沉淀,加入浓硝酸,沉淀溶解,产生红棕色气体,说明沉淀中含_____ 。
(2)实验②中未观察到明显变化,说明_______ 。
(3)实验③中,滴入KSCN后溶液先变红的原因是_______ 。稍振荡后红色消失并产生白色沉淀,请结合离子方程式解释现象:_______ 。
(4)综合实验①~③可知,实验①中发生反应的离子方程式为_______ 。
(5)小组同学用KSCN标准溶液作滴定剂,定量测定实验①反应后溶液中的Ag+浓度。能指示滴定终点的现象为_______ 。
(6)滴定时,若取样混入灰黑色沉淀,则测得的c(Ag+)_______ (填“偏高”“偏低”或“无影响”)。
| 序号 | 实验操作 | 实验现象 |
| ① | 将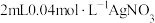 溶液与 溶液与 溶液(调pH=3)混合后密封 溶液(调pH=3)混合后密封 | 观察到产生灰黑色沉淀,溶液变为黄色,数小时后,溶液颜色无变化,沉淀不增加 |
| ② | 将 溶液与 溶液与 溶液(调pH=3)混合后密封 溶液(调pH=3)混合后密封 | 数小时内,未观察到明显现象 |
| ③ | 取少量①中反应后的上层清液,逐滴加入KSCN溶液 | 观察到溶液先变红,稍振荡后红色消失,同时产生白色沉淀。再次滴入KSCN溶液,上述现象再次出现 |
 ;
;ii.

(1)取实验①中灰黑色沉淀,加入浓硝酸,沉淀溶解,产生红棕色气体,说明沉淀中含
(2)实验②中未观察到明显变化,说明
(3)实验③中,滴入KSCN后溶液先变红的原因是
(4)综合实验①~③可知,实验①中发生反应的离子方程式为
(5)小组同学用KSCN标准溶液作滴定剂,定量测定实验①反应后溶液中的Ag+浓度。能指示滴定终点的现象为
(6)滴定时,若取样混入灰黑色沉淀,则测得的c(Ag+)
您最近一年使用:0次
名校
5 . 按要求回答下列问题:
(1)现有以下物质:①Cl2②CO2③Na2O④NaHSO4⑤漂白粉⑥NaOH溶液⑦Ba(OH)2,其中属于酸性氧化物的有
(2)某金属氯化物MClx的摩尔质量为133.5g/mol,取该金属氯化物26.7g配成水溶液,与足量AgNO3溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量为
(3)下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
| 元素代号 | A | B | C | D | E | F | G |
原子半径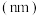 | 0.186 | 0.160 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
①七种元素的最高价氧化物的水化物中,酸性最强的是
②B、E、G的离子半径由大到小的顺序是
③元素G的最简单氢化物的结构式
(4)200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2充分反应后,得到Na2CO3和NaHCO3的混合溶液,向上述所得溶液中,逐滴加入2mol/L的盐酸,所得气体的体积与所加盐酸的体积关系如图所示(不考虑体积变化):
B点时,反应所得溶液中溶质的物质的量浓度是
(5)向浑浊的水中加入明矾(KAl(SO4)2·12H2O)后,水可得到净化。写出硫酸铝钾在水中的电离方程式:
您最近一年使用:0次
名校
解题方法
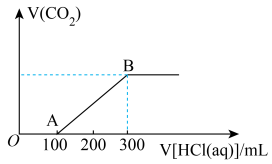
6 . 某化学活动小组利用如下装置制备氯气并进行相关的性质验证。
已知:
① 易溶于有机溶剂四氯化碳(
易溶于有机溶剂四氯化碳( ),且所得溶液呈橙红色;
),且所得溶液呈橙红色;
② 不溶于水,密度比水大。
不溶于水,密度比水大。
(1)装置A中发生反应的化学方程式为
(2)m的作用是
(3)装置C中的现象是
(4)装置D中发生反应的离子方程式为
(5)取少量反应后的B中溶液,向其中加入
 ,振荡后静置,若出现
,振荡后静置,若出现 被氧化。
被氧化。(6)另取少量反应后的B中溶液于试管中,向其中加入少量
 被氧化。
被氧化。(7)已知氧化性
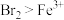 ,向200mL 0.1mol/L
,向200mL 0.1mol/L  溶液中通入标准状况下0.56L
溶液中通入标准状况下0.56L  时反应的离子方程式为
时反应的离子方程式为
您最近一年使用:0次
名校
7 . 含硫化合物在生产、科研中应用广泛。请回答下列问题:
(1)多种多样的盐:
① 在染料工业中用于生产硫化染料,其水溶液显碱性的原因:
在染料工业中用于生产硫化染料,其水溶液显碱性的原因:_____________ (用离子反应方程式表示),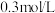 的
的 溶液与
溶液与 的
的 溶液中
溶液中
_____________  (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
② 可应用做医药、照相还原剂、染料中间体等,写出
可应用做医药、照相还原剂、染料中间体等,写出 溶液的质子守恒表达式:
溶液的质子守恒表达式:_____________ [用含离子浓度的关系式表示,用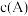 表示粒子A的浓度];③
表示粒子A的浓度];③ 可用作矿物分解助熔剂。已知:
可用作矿物分解助熔剂。已知: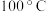 时,
时, 的
的 溶液中水电离的
溶液中水电离的 ,该温度下将
,该温度下将 的
的 溶液
溶液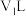 与
与 的
的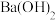 溶液
溶液 混合,所得溶液
混合,所得溶液 ,则
,则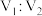 为
为_____________ (忽略溶液混合时的体积变化)。
(2) 可用于金属精制、农药、医药、催化剂再生。常温下,向
可用于金属精制、农药、医药、催化剂再生。常温下,向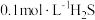 溶液中通入
溶液中通入 气体或加入
气体或加入 固体,测得
固体,测得 与溶液
与溶液 的关系如图所示(忽略体积的变化及)
的关系如图所示(忽略体积的变化及) 挥发)。
挥发)。

①当 时,溶液中
时,溶液中
_____________  ;
;
②当溶液 时,溶液中的
时,溶液中的
_____________  ;
;
③某溶液含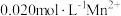 、
、 ,当溶液
,当溶液
_____________ 时, 开始沉淀[已知:
开始沉淀[已知: ]。
]。
(1)多种多样的盐:
①
 在染料工业中用于生产硫化染料,其水溶液显碱性的原因:
在染料工业中用于生产硫化染料,其水溶液显碱性的原因: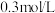 的
的 溶液与
溶液与 的
的 溶液中
溶液中
 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);②
 可应用做医药、照相还原剂、染料中间体等,写出
可应用做医药、照相还原剂、染料中间体等,写出 溶液的质子守恒表达式:
溶液的质子守恒表达式: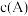 表示粒子A的浓度];③
表示粒子A的浓度];③ 可用作矿物分解助熔剂。已知:
可用作矿物分解助熔剂。已知: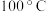 时,
时, 的
的 溶液中水电离的
溶液中水电离的 ,该温度下将
,该温度下将 的
的 溶液
溶液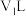 与
与 的
的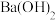 溶液
溶液 混合,所得溶液
混合,所得溶液 ,则
,则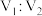 为
为(2)
 可用于金属精制、农药、医药、催化剂再生。常温下,向
可用于金属精制、农药、医药、催化剂再生。常温下,向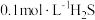 溶液中通入
溶液中通入 气体或加入
气体或加入 固体,测得
固体,测得 与溶液
与溶液 的关系如图所示(忽略体积的变化及)
的关系如图所示(忽略体积的变化及) 挥发)。
挥发)。
①当
 时,溶液中
时,溶液中
 ;
;②当溶液
 时,溶液中的
时,溶液中的
 ;
;③某溶液含
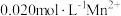 、
、 ,当溶液
,当溶液
 开始沉淀[已知:
开始沉淀[已知: ]。
]。
您最近一年使用:0次
名校
解题方法
8 . 2024年2月国家工业和信息化部指出到2025年初步建立工业领域碳达峰碳中和标准体系, 有效转化是研究“碳中和”的重要方向。实现有效转化的一种常见途径是捕集
有效转化是研究“碳中和”的重要方向。实现有效转化的一种常见途径是捕集 转化为合成气(
转化为合成气( 和
和 ),再转化为烃类及含氧化合物等高附加值化学品(即费-托合成)。
),再转化为烃类及含氧化合物等高附加值化学品(即费-托合成)。
捕集 涉及下列反应:
涉及下列反应:
i.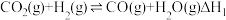
ii.
(1)有关物质能量变化如图所示,设稳定单质的焓(H)为0,则
_____________ ,利于该反应自发进行的条件是_____________ (填“高温”或“低温”)。

(2)在一定条件下,选择合适的催化剂只进行反应i: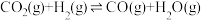 。调整
。调整 和
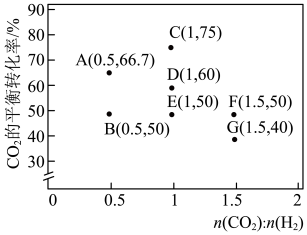
和 初始投料比,测得在一定投料比和一定温度下,该反应
初始投料比,测得在一定投料比和一定温度下,该反应 的平衡转化率如图所示。
的平衡转化率如图所示。
已知: 是以物质的量分数表示的化学平衡常数;对于反应
是以物质的量分数表示的化学平衡常数;对于反应 ,
,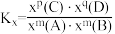 ,x为物质的量分数);反应速率
,x为物质的量分数);反应速率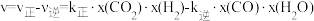 ,
, 分别为正、逆反应速率常数。
分别为正、逆反应速率常数。
①下列关于i反应说法不正确的是_____________ ;
a.催化剂参与了反应,改变了反应的活化能和
b.某温度反应达到平衡状态,升高温度,正反应速率提高的幅度更大
c.恒温恒压,混合气体密度不变可以作为反应达到平衡状态的标志
d.将 液化,及时分离,有利于提高反应物的转化率
液化,及时分离,有利于提高反应物的转化率
②B、E、F三点反应温度最高的是_____________ 点;
③计算E点所示的投料比在从起始到平衡的过程中,当 转化率达到
转化率达到 时,
时,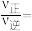
_____________ (用分数表示)。
(3)保持总压为 恒定,初始
恒定,初始 和
和 的物质的量之比
的物质的量之比 ,发生上述i、ii反应,不同温度下平衡组分物质的量分数如图。
,发生上述i、ii反应,不同温度下平衡组分物质的量分数如图。
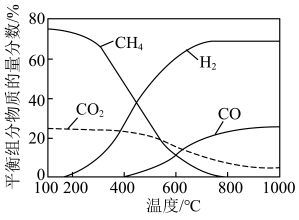
①在 以下时,
以下时, 含量高于
含量高于 的原因为
的原因为_____________ ;
②某温度下平衡体系中 和
和 的物质的量分数均为10%,此时反应i的平衡常数
的物质的量分数均为10%,此时反应i的平衡常数
_____________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 有效转化是研究“碳中和”的重要方向。实现有效转化的一种常见途径是捕集
有效转化是研究“碳中和”的重要方向。实现有效转化的一种常见途径是捕集 转化为合成气(
转化为合成气( 和
和 ),再转化为烃类及含氧化合物等高附加值化学品(即费-托合成)。
),再转化为烃类及含氧化合物等高附加值化学品(即费-托合成)。捕集
 涉及下列反应:
涉及下列反应:i.
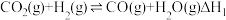
ii.

(1)有关物质能量变化如图所示,设稳定单质的焓(H)为0,则


(2)在一定条件下,选择合适的催化剂只进行反应i:
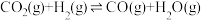 。调整
。调整 和
和 初始投料比,测得在一定投料比和一定温度下,该反应
初始投料比,测得在一定投料比和一定温度下,该反应 的平衡转化率如图所示。
的平衡转化率如图所示。
已知:
 是以物质的量分数表示的化学平衡常数;对于反应
是以物质的量分数表示的化学平衡常数;对于反应 ,
,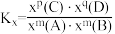 ,x为物质的量分数);反应速率
,x为物质的量分数);反应速率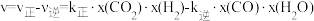 ,
, 分别为正、逆反应速率常数。
分别为正、逆反应速率常数。①下列关于i反应说法不正确的是
a.催化剂参与了反应,改变了反应的活化能和

b.某温度反应达到平衡状态,升高温度,正反应速率提高的幅度更大
c.恒温恒压,混合气体密度不变可以作为反应达到平衡状态的标志
d.将
 液化,及时分离,有利于提高反应物的转化率
液化,及时分离,有利于提高反应物的转化率②B、E、F三点反应温度最高的是
③计算E点所示的投料比在从起始到平衡的过程中,当
 转化率达到
转化率达到 时,
时,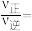
(3)保持总压为
 恒定,初始
恒定,初始 和
和 的物质的量之比
的物质的量之比 ,发生上述i、ii反应,不同温度下平衡组分物质的量分数如图。
,发生上述i、ii反应,不同温度下平衡组分物质的量分数如图。 
①在
 以下时,
以下时, 含量高于
含量高于 的原因为
的原因为②某温度下平衡体系中
 和
和 的物质的量分数均为10%,此时反应i的平衡常数
的物质的量分数均为10%,此时反应i的平衡常数
您最近一年使用:0次
名校
9 . 某铜合金中 的质量分数为80%~90%,还含有
的质量分数为80%~90%,还含有 等。通常用间接碘量法测定其中
等。通常用间接碘量法测定其中 的含量,步骤如下:
的含量,步骤如下:
1.称取 样品,加入稀
样品,加入稀 和
和 溶液使其溶解,煮沸除去过量的
溶液使其溶解,煮沸除去过量的 ,冷却后过滤,将滤液配制成
,冷却后过滤,将滤液配制成 溶液;
溶液;
Ⅱ.取 滤液于锥形瓶中,加入
滤液于锥形瓶中,加入 溶液,将溶液中的
溶液,将溶液中的 转化为无色稳定的
转化为无色稳定的 ,充分反应后,加入过量的
,充分反应后,加入过量的 溶液,生成白色沉淀,加入淀粉做指示剂;
溶液,生成白色沉淀,加入淀粉做指示剂;
Ⅲ.向Ⅱ的锥形瓶中加入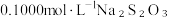 溶液滴定,发生反应:
溶液滴定,发生反应:
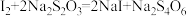 (无色);
(无色);
Ⅳ.平行测定四次,四次滴定实验消耗 标准溶液体积读数如下表所示:
标准溶液体积读数如下表所示:
V.计算铜的质量分数。
已知: 为白色难溶于水的难溶物。
为白色难溶于水的难溶物。
(1)盛装 溶液,应选择下图中的
溶液,应选择下图中的_____________ (填“a”或“b”)。

(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):_______
检漏→蒸馏水洗涤→→→→→→开始滴定。
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下 D.用量筒量取一定体积的溶液倒入锥形瓶中 E.排除气泡 F.用滴定液润洗2至3次G记录起始读数
(3)Ⅱ中 和
和 反应生成
反应生成 白色沉淀和
白色沉淀和 。
。 和
和 反应的离子方程式是
反应的离子方程式是_____________ 。
(4)滴定终点的现象_____________ 。
(5)Ⅳ所消耗的 标准溶液平均体积为
标准溶液平均体积为_____________  ,V计算得到样品中
,V计算得到样品中 的质量分数为
的质量分数为_____________ (结果保留两位小数)。
(6)以下操作造成铜的含量偏高的是_____________ 。
A.滴定管未用标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
F.步骤Ⅱ中未加入 溶液
溶液
 的质量分数为80%~90%,还含有
的质量分数为80%~90%,还含有 等。通常用间接碘量法测定其中
等。通常用间接碘量法测定其中 的含量,步骤如下:
的含量,步骤如下:1.称取
 样品,加入稀
样品,加入稀 和
和 溶液使其溶解,煮沸除去过量的
溶液使其溶解,煮沸除去过量的 ,冷却后过滤,将滤液配制成
,冷却后过滤,将滤液配制成 溶液;
溶液;Ⅱ.取
 滤液于锥形瓶中,加入
滤液于锥形瓶中,加入 溶液,将溶液中的
溶液,将溶液中的 转化为无色稳定的
转化为无色稳定的 ,充分反应后,加入过量的
,充分反应后,加入过量的 溶液,生成白色沉淀,加入淀粉做指示剂;
溶液,生成白色沉淀,加入淀粉做指示剂;Ⅲ.向Ⅱ的锥形瓶中加入
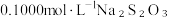 溶液滴定,发生反应:
溶液滴定,发生反应: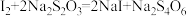 (无色);
(无色);Ⅳ.平行测定四次,四次滴定实验消耗
 标准溶液体积读数如下表所示:
标准溶液体积读数如下表所示:| 滴定次数 | 待测溶液的体积/ |  溶液的体积/ 溶液的体积/ | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 50.00 | 0.00 | 18.02 |
| 第二次 | 50.00 | 0.56 | 18.96 |
| 第三次 | 50.00 | 0.22 | 18.20 |
| 第四次 | 50.00 | 0.35 | 18.35 |
已知:
 为白色难溶于水的难溶物。
为白色难溶于水的难溶物。(1)盛装
 溶液,应选择下图中的
溶液,应选择下图中的
(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→→→→→→开始滴定。
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下 D.用量筒量取一定体积的溶液倒入锥形瓶中 E.排除气泡 F.用滴定液润洗2至3次G记录起始读数
(3)Ⅱ中
 和
和 反应生成
反应生成 白色沉淀和
白色沉淀和 。
。 和
和 反应的离子方程式是
反应的离子方程式是(4)滴定终点的现象
(5)Ⅳ所消耗的
 标准溶液平均体积为
标准溶液平均体积为 ,V计算得到样品中
,V计算得到样品中 的质量分数为
的质量分数为(6)以下操作造成铜的含量偏高的是
A.滴定管未用标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
F.步骤Ⅱ中未加入
 溶液
溶液
您最近一年使用:0次
名校
解题方法
10 . A、B、C、D、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。

已知这些化合物均由前20号元素组成;A为离子化合物,由 或
或 离子构成,阴阳离子数目为1:1;常温下C、Y均为气态双原子分子。
离子构成,阴阳离子数目为1:1;常温下C、Y均为气态双原子分子。
(1)若A中含有非极性共价键,焰色试验显砖红色,则A的电子式为________ ,实验室少量单质X保存在________ 中。
(2)若A中阴阳离子的核外电子排布相同,则阴阳离子的半径大小关系为________ >________ (填化学式)。实验室由反应Ⅰ制备A时可能会混有单质X,利用下图装置进行实验检测A中是否混有X。发生反应的离子方程式为________ ,________ 。

测定气体体积时需要在反应停止后的操作顺序为________ 。
①向下移动漏斗,使漏斗中液面与量气管液面相平
②视线与量气管中的凹液面相平进行读数
③冷却气体至室温
若用电子天平称取0.40g固体产物进行实验,测得气体体积________ 1120mL(填“>”、“=”或“<”)时,产物中混有X。

已知这些化合物均由前20号元素组成;A为离子化合物,由
 或
或 离子构成,阴阳离子数目为1:1;常温下C、Y均为气态双原子分子。
离子构成,阴阳离子数目为1:1;常温下C、Y均为气态双原子分子。(1)若A中含有非极性共价键,焰色试验显砖红色,则A的电子式为
(2)若A中阴阳离子的核外电子排布相同,则阴阳离子的半径大小关系为

测定气体体积时需要在反应停止后的操作顺序为
①向下移动漏斗,使漏斗中液面与量气管液面相平
②视线与量气管中的凹液面相平进行读数
③冷却气体至室温
若用电子天平称取0.40g固体产物进行实验,测得气体体积
您最近一年使用:0次



