名校
1 . 碘钨灯比白炽灯使用寿命长.灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应: (温度
(温度 ).下列说法正确的是
).下列说法正确的是
 (温度
(温度 ).下列说法正确的是
).下列说法正确的是A.灯管工作时,扩散到灯丝附近高温区的 会分解出W重新沉积到灯丝上 会分解出W重新沉积到灯丝上 |
B.灯丝附近温度越高, 的转化率越低 的转化率越低 |
C.该反应的平衡常数表达式是 |
D.该灯泡不工作时 会全部转化为 会全部转化为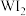 |
您最近一年使用:0次
2024-02-14更新
|
89次组卷
|
2卷引用:河南省济源第一中学2022-2023学年高二上学期11月月考 化学试题
名校
解题方法
2 . 在恒温恒容的密闭容器中充入丁烷,同时发生反应:C4H10(g)⇌C2H6(g)+C2H4(g)、C4H10(g)⇌CH4(g)+C3H6(g)。下列情况表明上述反应都达到平衡状态的是
| A.混合气体的密度保持不变 | B. |
| C.气体总压强保持不变 | D. |
您最近一年使用:0次
2024-02-14更新
|
101次组卷
|
2卷引用:河南省济源高级中学2022-2023学年高二上学期10月月考 化学试题
名校
3 . 某催化剂的M型、N型均可催化反应为2CO(g)+O2(g)⇌2CO2(g)。向容积相同的恒容密闭容器中分别充入等量的CO和O2,在相同时间段内,不同温度下测得CO的转化率(α)如图所示。由图推断下列说法正确的是
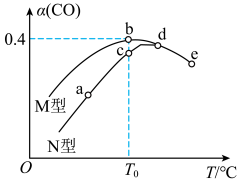

| A.a、b、c、d点均达到平衡状态 |
| B.该反应的平衡常数K(b)大于K(c) |
| C.b点反应物的有效碰撞几率最大 |
| D.图中五个点对应状态下,a点反应速率最慢 |
您最近一年使用:0次
2024-02-14更新
|
118次组卷
|
2卷引用:河南省济源高级中学2022-2023学年高二上学期10月月考 化学试题
名校
4 . 在教材测定中和热的实验中,用50mL0.55mol∙L-1的NaOH溶液与50mL0.50mol∙L-1的盐酸测定中和热。下列说法不正确的是
| A.在测定中和热实验中需要使用的仪器有量筒、烧杯、普通玻璃棒、温度计 |
| B.为了准确测定反应混合溶液的温度,实验中温度计水银球不能与小烧杯底部接触 |
| C.若用60mL0.50mol∙L-1的盐酸反应,测得的中和热数值不变 |
| D.如将NaOH溶液分多次滴加,可导致测定的中和热数值偏低 |
您最近一年使用:0次
2024-02-13更新
|
119次组卷
|
2卷引用:河南省济源高级中学2022-2023学年高二上学期10月月考 化学试题
5 . 下列说法不正确的是
| A.已知冰的熔化热为6.0kJ•mol-1,冰中氢键键能为20kJ•mol-1,假设1mol冰中有2mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 |
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α, 。若加入少量醋酸钠固体,则CH3COOH⇌CH3COO-+H+向左移动,α减小,Ka变小 。若加入少量醋酸钠固体,则CH3COOH⇌CH3COO-+H+向左移动,α减小,Ka变小 |
C.实验测得环己烷(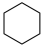 )、环己烯( )、环己烯(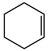 )和苯( )和苯(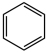 )的标准燃烧热分别为3916kJ∙mol-1、3747kJ∙mol-1和3265kJ∙mol-1,可以证明在苯分子中不存在独立的碳碳双键 )的标准燃烧热分别为3916kJ∙mol-1、3747kJ∙mol-1和3265kJ∙mol-1,可以证明在苯分子中不存在独立的碳碳双键 |
| D.已知Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g),△H=+489.0kJ∙mol-1;CO和C(石墨)的燃烧热分别为283.0kJ∙mol-1和393.5kJ∙mol-1。则4Fe(s)+3O2(g)=2Fe2O3(s);△H=-1641.0kJ∙mol-1 |
您最近一年使用:0次
2024-02-13更新
|
56次组卷
|
2卷引用:河南省济源高级中学2022-2023学年高二上学期10月月考 化学试题
名校
6 . 已知汽车尾气中的主要污染物为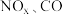 、超细颗粒(
、超细颗粒(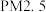 )等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.
)等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.
(1)工业上可采用 和
和 合成甲醇,发生反应为(Ⅰ)
合成甲醇,发生反应为(Ⅰ)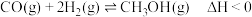
在恒容密闭容器里按体积比为 充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的
充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的某一个 条件后,下列变化能说明平衡一定 向正反应方向移动的是___________ .
A.正反应速率先增大后减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
E.混合气体的密度减小 F.氢气的转化率减小
(2)①汽车在行驶过程中有如下反应发生:i.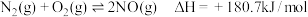
ii.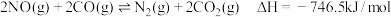
写出表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_____________________________________________ .
②在汽车上安装三元催化转化器可实现反应:
(Ⅱ)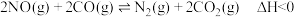 .
.
则该反应在___________ (填高温、低温或任何温度)下能自发进行.
(3)将 和
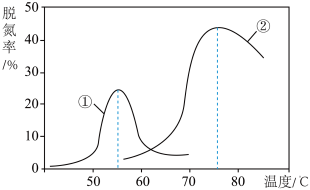
和 以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中
以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中 的含量,从而确定尾气脱氮率(脱氮率即
的含量,从而确定尾气脱氮率(脱氮率即 的转化率),结果如图所示.以下说法正确的是___________
的转化率),结果如图所示.以下说法正确的是___________
(4)用焦炭还原 的反应为:
的反应为: ,在恒温条件下,
,在恒温条件下,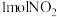 和足量C发生该反应,测得平衡时
和足量C发生该反应,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
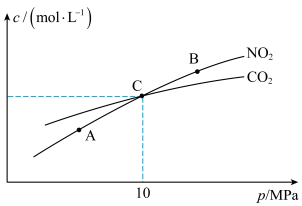
①A、B两点的浓度平衡常数关系: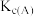
___________ 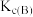 (填“<”或“>”或“=”).
(填“<”或“>”或“=”).
②A、B、C三点中 的转化率最高的是
的转化率最高的是___________ (填“A”或“B”或“C”)点.
③计算C点时该反应的压强平衡常数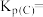
___________ ( 是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(5)在汽车尾气的净化装置中 和
和 发生如下反应:
发生如下反应: .实验测得,
.实验测得,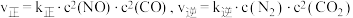 (
( 为速率常数,只与温度有关).
为速率常数,只与温度有关).
①达到平衡后,仅升高温度, 增大的倍数
增大的倍数___________ (填“>”、“<”或“=”) 增大的倍数.
增大的倍数.
②若在 的密闭容器中充入
的密闭容器中充入 和
和 ,在一定温度下达到平衡时,
,在一定温度下达到平衡时, 的转化率为40%,则
的转化率为40%,则
___________ (保留2位有效数字).
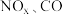 、超细颗粒(
、超细颗粒( )等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.
)等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.(1)工业上可采用
 和
和 合成甲醇,发生反应为(Ⅰ)
合成甲醇,发生反应为(Ⅰ)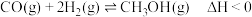
在恒容密闭容器里按体积比为
 充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的
充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的A.正反应速率先增大后减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
E.混合气体的密度减小 F.氢气的转化率减小
(2)①汽车在行驶过程中有如下反应发生:i.
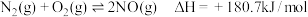
ii.
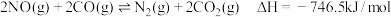
写出表示
 燃烧热的热化学方程式为
燃烧热的热化学方程式为②在汽车上安装三元催化转化器可实现反应:
(Ⅱ)
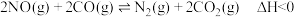 .
.则该反应在
(3)将
 和
和 以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中
以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中 的含量,从而确定尾气脱氮率(脱氮率即
的含量,从而确定尾气脱氮率(脱氮率即 的转化率),结果如图所示.以下说法正确的是___________
的转化率),结果如图所示.以下说法正确的是___________
| A.第②种催化剂比第①种催化剂脱氮率高 |
| B.相同条件下,改变压强对脱氮率没有影响 |
| C.曲线①、②最高点表示此时平衡转化率最高 |
D.两种催化剂分别适宜于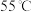 和 和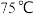 左右脱氮 左右脱氮 |
(4)用焦炭还原
 的反应为:
的反应为: ,在恒温条件下,
,在恒温条件下,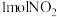 和足量C发生该反应,测得平衡时
和足量C发生该反应,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
①A、B两点的浓度平衡常数关系:
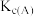
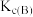 (填“<”或“>”或“=”).
(填“<”或“>”或“=”).②A、B、C三点中
 的转化率最高的是
的转化率最高的是③计算C点时该反应的压强平衡常数
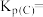
 是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).(5)在汽车尾气的净化装置中
 和
和 发生如下反应:
发生如下反应: .实验测得,
.实验测得,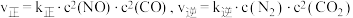 (
( 为速率常数,只与温度有关).
为速率常数,只与温度有关).①达到平衡后,仅升高温度,
 增大的倍数
增大的倍数 增大的倍数.
增大的倍数.②若在
 的密闭容器中充入
的密闭容器中充入 和
和 ,在一定温度下达到平衡时,
,在一定温度下达到平衡时, 的转化率为40%,则
的转化率为40%,则
您最近一年使用:0次
2024-02-11更新
|
84次组卷
|
2卷引用:河南省济源第一中学2022-2023学年高二上学期11月月考 化学试题
名校
解题方法
7 . CS2是一种重要的化工原料。工业上可以利用固体硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应2S2(g)+CH4(g)⇌CS2(g)+2H2S(g),回答下列问题:
(1)某温度下,若S8完全分解成气态S2.在恒温密闭容器中,S2与CH4物质的量比为2:1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为___________ 。
②当以下数值不变时,能说明该反应达到平衡的是___________ (填序号)。
a.气体密度 b.气体总压 c.CH4与S2体积比 d.CS2的体积分数
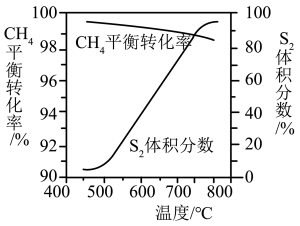
(2)一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为___________ (填“放热”或“吸热”)反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是___________ 。
(3)已知常温常压下,64gS8完全分解为S2气体吸收的热量为akJ,S2气体的燃烧热为 ,写出表示S8燃烧热的热化学方程式:
,写出表示S8燃烧热的热化学方程式:___________ 。
(1)某温度下,若S8完全分解成气态S2.在恒温密闭容器中,S2与CH4物质的量比为2:1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为
②当以下数值不变时,能说明该反应达到平衡的是
a.气体密度 b.气体总压 c.CH4与S2体积比 d.CS2的体积分数
(2)一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为

(3)已知常温常压下,64gS8完全分解为S2气体吸收的热量为akJ,S2气体的燃烧热为
 ,写出表示S8燃烧热的热化学方程式:
,写出表示S8燃烧热的热化学方程式:
您最近一年使用:0次
名校
解题方法
8 . 25℃时,在体积为2L的恒容密闭容器中通入0.08molNO和0.04molCl2发生反应2NO(g)+Cl2(g)⇌2NOCl(g) △H。
(1)若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图I实线所示,则△H___________ 0(填“>”、“<”或“=”);
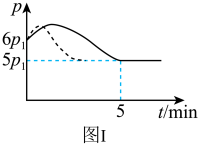
(2)若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图I虚线所示,则改变的条件是___________ ;在5min时,再充入0.08molNO和0.04molCl2,则混合气体的平均相对分子质量将___________ (填“增大”、“减小”或“不变”)。
(3)图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是___________ (填“甲”或“乙”),a值为___________ 。25℃时测得该反应在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正___________ v逆(填“>”、“<”或“=”)

(1)若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图I实线所示,则△H

(2)若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图I虚线所示,则改变的条件是
(3)图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是

您最近一年使用:0次
名校
9 . 按要求回答下列问题
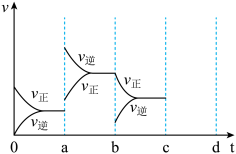
(1)在密闭容器中反应:2SO2+O2⇌2SO3 △H=-QkJmol∙L-1到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况如图1所示,a→b过程中改变的条件可能是___________ ;b→c过程中改变的条件可能是___________ ;若增大压强时,将反应速率变化情况画在c~d处(d前已经达到化学平衡)___________ 。
(2)在一个容积固定的密闭容器中进行反应2X(g)+Y(g)⇌2Z(g),已知将2molX和1molY充入该容器,反应在绝热条件下进行达到平衡时,加入催化剂和未加催化剂的速率-时间图(v-t)如图所示,下列说法正确的有___________ (填序号)
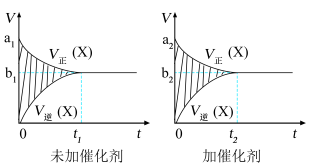
①a1>a2 ②b1>b2 ③t1>t2 ④两图阴影部分面积一样大 ⑤加催化剂的图阴影面积更大
(3)可逆反应CO(g)+H2(g)⇌H2O(g)+C(s),在500K下,向体积为2L的密闭刚性容器中充入1molCO和2molH2进行反应,经10min达到平衡。若初始压强为akPa,平衡时H2的转化率为25%。CO在10min内的平均速率为________ ;500K下,该反应的压强平衡常数为Kp=________ (用含a的式子表示);若平衡后向该容器中加入CO和H2O各0.5mol,平衡_________ (填“向左移动”“向右移动”或“不移动”)。
(1)在密闭容器中反应:2SO2+O2⇌2SO3 △H=-QkJmol∙L-1到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况如图1所示,a→b过程中改变的条件可能是

(2)在一个容积固定的密闭容器中进行反应2X(g)+Y(g)⇌2Z(g),已知将2molX和1molY充入该容器,反应在绝热条件下进行达到平衡时,加入催化剂和未加催化剂的速率-时间图(v-t)如图所示,下列说法正确的有

①a1>a2 ②b1>b2 ③t1>t2 ④两图阴影部分面积一样大 ⑤加催化剂的图阴影面积更大
(3)可逆反应CO(g)+H2(g)⇌H2O(g)+C(s),在500K下,向体积为2L的密闭刚性容器中充入1molCO和2molH2进行反应,经10min达到平衡。若初始压强为akPa,平衡时H2的转化率为25%。CO在10min内的平均速率为
您最近一年使用:0次
名校
10 . 按要求回答下列问题。
(1)汽车尾气是城市主要空气污染物,汽车内燃机工作时发生反应N2(g)+O2(g)⇌2NO(g)是导致汽车尾气中含有NO的原因之一、已知H2可以催化还原NO达到消除污染的目的。
N2(g)+O2(g)⇌2NO(g) △H=+180.5kJ∙mol-1
2H2(g)+O2(g)⇌2H2O(l) △H=-571.6kJ∙mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是___________ ,判断该反应自发进行的条件:___________ 。(填“高温自发”或“低温自发”)
(2)已知H2S为二元弱酸,欲使0.1mol•L-1的H2S溶液中 的比值变大,下列措施可行的是
的比值变大,下列措施可行的是___________
a.加入H2O b.通入少量H2S c.通入少量HCl d.加入少量NaOH固体
(3)有下列物质:①Zn②KAl(SO4)2∙12H2O③Ba(OH)2④乙醇⑤冰醋酸⑥盐酸⑦Cu(NO3)2溶液⑧熔融态AlCl3⑨NH3∙H2O⑩熔融态CH3COONa⑪NaHCO3。其中属于能导电的电解质的是___________ (填编号)属于弱电解质的是___________ (填编号)
(4)若向0.1mol∙L-1的弱碱MOH溶液中逐滴加入0.1mol∙L-1的弱酸HB至恰好反应,溶液的导电性变化规律是___________ (填“逐渐变强”、“逐渐变弱”、“先变强后变弱”、“先变弱后变强”和“几乎不变”)
(1)汽车尾气是城市主要空气污染物,汽车内燃机工作时发生反应N2(g)+O2(g)⇌2NO(g)是导致汽车尾气中含有NO的原因之一、已知H2可以催化还原NO达到消除污染的目的。
N2(g)+O2(g)⇌2NO(g) △H=+180.5kJ∙mol-1
2H2(g)+O2(g)⇌2H2O(l) △H=-571.6kJ∙mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是
(2)已知H2S为二元弱酸,欲使0.1mol•L-1的H2S溶液中
 的比值变大,下列措施可行的是
的比值变大,下列措施可行的是a.加入H2O b.通入少量H2S c.通入少量HCl d.加入少量NaOH固体
(3)有下列物质:①Zn②KAl(SO4)2∙12H2O③Ba(OH)2④乙醇⑤冰醋酸⑥盐酸⑦Cu(NO3)2溶液⑧熔融态AlCl3⑨NH3∙H2O⑩熔融态CH3COONa⑪NaHCO3。其中属于能导电的电解质的是
(4)若向0.1mol∙L-1的弱碱MOH溶液中逐滴加入0.1mol∙L-1的弱酸HB至恰好反应,溶液的导电性变化规律是
您最近一年使用:0次



